-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Dospělý onkologický nemocný v intenzivní péči
Je již čas říci „ano, zvážíme to“ než říkat „ne“?!
The adult oncological patient in intensive care
Is it time to start saying "yes, we will consider" instead of just "no"?An increasing number of cancer patients are being admitted to the intensive care and high dependency units due to the rising incidence of solid and/or haematological malignancies together with an expanding range of therapeutic options and improved survival of these patients. The reasons for admission are the potentially life-threatening cancer-related complications and/or treatment-associated side-effects or eventual co-morbidities. Epidemiology, indication criteria, extension of treatment, prognosis of the acute disease and changes applied to the general prognosis as a consequence of the critical illness are some of the most common and frequently unanswered questions the intensivists need to examine, and they are discussed within this review.
Keywords:
malignancy – haematological malignancy – intensive care – organ failure
Autoři: T. Karvunidis 1,2; D. Lysák 2,3; M. Matějovič 1,2
Působiště autorů: I. interní klinika, Lékařská fakulta v Plzni, Univerzita Karlova a Fakultní nemocnice Plzeň 1; Biomedicínské centrum, Lékařská fakulta v Plzni, Univerzita Karlova 2; Hematologicko-onkologické oddělení, Fakultní nemocnice Plzeň 3
Vyšlo v časopise: Anest. intenziv. Med., 28, 2017, č. 6, s. 346-353
Kategorie: Intenzivní medicína - Přehledný článek
Souhrn
Spolu s rostoucí incidencí nádorových onemocnění, rozšiřujícími se možnostmi léčby a zlepšením jejich přežívání je na jednotky intenzivní péče a/nebo anesteziologicko-resuscitační oddělení přijímáno stále více onkologických nemocných. Důvodem přijetí jsou (potenciálně) život ohrožující komplikace spojené přímo s malignitami a/nebo jejich terapií či komplikace případných komorbidit. Epidemiologie, indikace k přijetí do intenzivní péče, rozsah léčby, stejně jako prognóza akutního stavu a případná změna prognózy základního onemocnění v důsledku akutní komplikace zůstávají častými nezodpovězenými otázkami (nejen) intenzivistů. Tato problematika bude diskutována v tomto přehledovém článku.
Klíčová slova:
malignita – hematologická malignita – intenzivní péče – orgánové selháníKAZUISTIKA
Třiašedesátiletá obézní hypertonička a diabetička 2. typu léčená perorálními antidiabetiky byla přijata na standardní oddělení periferní nemocnice pro komunitní bronchopneumonii. Laboratorní výsledky potvrzovaly systémovou infekci a současně prokázaly hyperleukocytózu, těžkou anémii a trombocytopenii. Byla zahájena empirická antibiotická léčba (ATB, ceftriaxon + ciprofloxacin) a nemocná byla následující den přeložena na Hematologicko-onkologické oddělení (HOO) FN Plzeň k diagnostice suspektní akutní hemoblastózy. Zde proběhla rychlá diagnostika, která potvrdila akutní myeloidní leukémii (AML – M1, NPM1 pozitivní – prognosticky příznivá mutace genu NPM) a spolu s pokračující ATB léčbou byla zahájena i indukční chemoterapie (idarubicin + cytosinarabinosid). Třetí den hospitalizace došlo k rozvoji a rychlé progresi respirační insuficience/selhání (pneumonie + hyperhydratace / kardiální subkompenzace + tumor-lysis syndrom) a současně i akutního poškození ledvin (sepse + tumor-lysis syndrom + suspektní podíl chronické diabetické nefropatie). Vzhledem k uvedenému byla nemocná přeložena na JIP I. interní kliniky FN Plzeň. Zde byla nezbytná umělá plicní ventilace (UPV), podpora oběhu vazopresorem a náhrada funkce ledvin (RRT; kontinuální venovenózní hemodialýza, CVVHD). Zdrojem infekce byla zmiňovaná pneumonie, patogenem pak meticilin senzitivní Staphylococcus aureus. Současně jsme pokračovali i v aplikaci chemoterapeutik ve snaze o potenciálně kauzální léčbu základního onemocnění. Další průběh hospitalizace byl charakterizován protrahovanou pancytopenií, pomalou kontrolou systémové infekce a reparací orgánových funkcí. Po celkem sedmnácti dnech bylo možné ukončit UPV i RRT. Po dalších čtyřech dnech byla nemocná v dobrém funkčním stavu přeložena zpět na standardní lůžko HOO a následně propuštěna do ambulantní péče. V současné době, po dalších cca 10 měsících a absolvování konsolidační chemoterapie, je nemocná stále v ambulantní dispenzární hematologické péči s dobrou kvalitou života a velmi dobrým funkčním stavem.
NELEHKÉ ROZHODOVÁNÍ
V situacích, kdy u onkologických nemocných dochází k alteraci vitálních funkcí, vyvstávají následující otázky, na které není vždy snadné nalézt odpovědi, často navíc v časové tísni:
Měl by být daný nemocný přijat k intenzivní péči?
Pokud ano, jaký rozsah intenzivní péče by měl být užit?
Špatný úsudek a rozhodnutí mohou vést ke ztrátě šance na kurativní terapii, či naopak ke zbytečně excesivní, stresující, marné a neúčelné léčbě nemocného na konci života. Toto podporuje i prospektivní práce Thiéryho a spol.: třicetidenní mortalita nemocných s malignitami, kteří nebyli iniciálně přijati do intenzivní péče (IP), protože byli shledáni v „příliš dobrém stavu“, byla nečekaně vysoká – 21 % –, a naopak smrtnost pacientů, kteří byli také odmítnuti, protože byli „příliš nemocní“ a jejich prognóza byla zhodnocena jako infaustní, byla „pouze“ 74 % [1].
V posledních letech jsme svědky významných pokroků v diagnostice i léčbě maligních onemocnění. Široká dostupnost a zpřesnění grafických vyšetření (CT, MR, PET/CT, PET/MR aj.) spolu s identifikací nových nádorových biomarkerů, použitím vysoce sofistikovaných metod k jejich detekci (molekulární genetika vč. microarrays, cytogenetika, průtoková cytometrie aj.) je s přirozeně narůstající incidencí a stárnoucí populací důvodem značného vzestupu počtu onkologických nemocných [2, 3]. Je léčeno mnohem více nemocných než v minulých letech, více nemocných pokročilého věku a polymorbidních a léčba je v mnoha případech agresivnější [4, 5]. Pokroky v transplantologii (kostní dřeně, respektive kmenových buněk krvetvorby) současně také umožňují indikovat a použít tuto léčebnou modalitu u většího množství nemocných. Vše uvedené vede k většímu počtu aktivně léčených nemocných, ke zlepšení krátkodobé, ale i dlouhodobé mortality nádorových onemocnění [4, 5], ale současně i k větší incidenci komplikací samotných maligních chorob i jejich léčby. Jejich základní přehled je uveden v tabulce 1. Komplikace alterující vitální funkce pak přivádějí až 5 % nemocných se solidními tumory a až 15 % pacientů s hematologickými malignitami do intenzivní péče (IP) [6–8]. Rovněž nelze nezmínit možnosti a pokroky samotné IP, kterých jsme svědky. Úzká spolupráce intenzivisty a onkologa/hematoonkologa je pro úspěšnou léčbu této populace nemocných klíčová.
Tab. 1. Seznam vybraných komplikací pacientů s maligním onemocněním 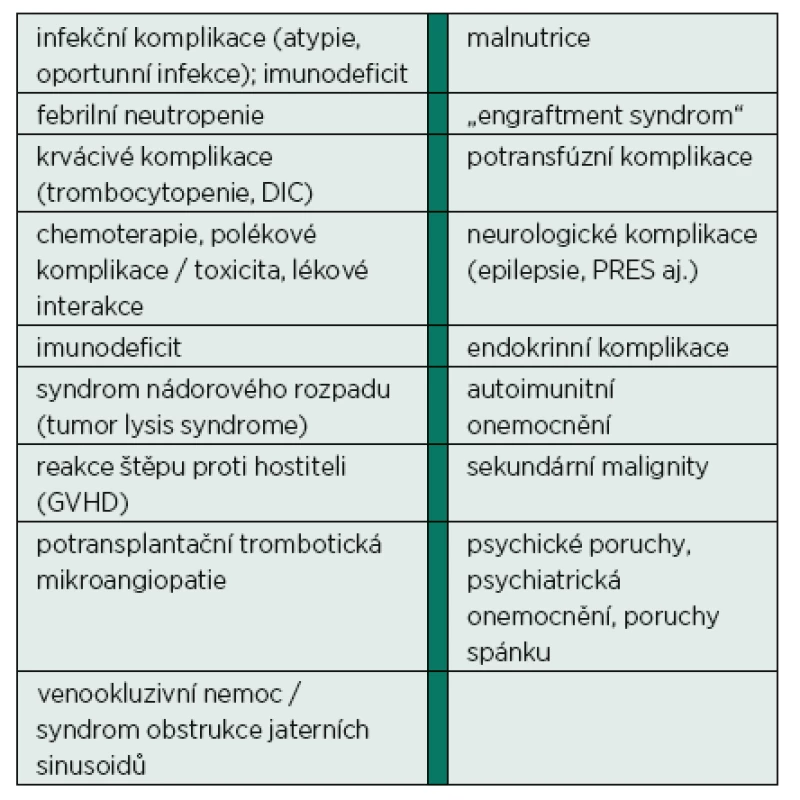
DIC: disseminovaná intravaskulární koagulace; PRES: syndrom posteriorní reverzibilní encefalopatie Cílem tohoto článku je na pozadí recentních epidemiologických dat diskutovat základní principy rozhodování o přijetí onkologického pacienta do intenzivní péče a vyhodnocení jejího přínosu. Intenzivní péče po elektivních chirurgických výkonech u nemocných se solidními tumory překračuje zamýšlený rámec článku a nebude dále diskutována.
INDIKACE PŘIJETÍ DOSPĚLÝCH PACIENTŮ S MALIGNÍM ONEMOCNĚNÍM DO INTENZIVNÍ PÉČE
Přijetí do IP je obecně indikováno v případech, kdy: 1. existuje reálný předpoklad ovlivnění a zlepšení klinického stavu nemocného, 2. povaha a dlouhodobá prognóza onkologického onemocnění a dalších případných komorbidit ospravedlňují tuto agresivní a potenciálně rizikovou léčbu, 3. nemocný IP neodmítá a samozřejmě 4. tato péče respektuje základní etické principy medicíny (autonomie, beneficience, nonmaleficience, spravedlnost) a je konaná v (předpokládaném) zájmu nemocného [9, 10]. Jistou výhodu v plánování strategie léčby představuje předchozí citlivá diskuse s nemocnými (a jejich příbuznými) o postupech v případě zásadní deteriorace jejich zdravotního stavu, a tedy znalost vlastního názoru konkrétního pacienta (a jeho blízkých) na eventuální extenzi léčby o IP a její rozsah (advance care planning) [11].
NOVÁ PARADIGMATA INTENZIVNÍ PÉČE PRO NEMOCNÉ S MALIGNITAMI
Mortalita
Poskytování IP nemocným s maligními onemocněními bylo dlouhou dobu, a v určité míře stále ještě je, kontroverzní. Studie provedené v 80.–90. letech minulého století demonstrovaly vysokou mortalitu těchto nemocných, zejména pokud vyžadovali umělou plicní ventilaci (UPV), byli neutropeničtí či byli po transplantaci kostní dřeně [12, 13]. Řada autorů proto doporučovala velkou zdrženlivost v jejich intenzivní léčbě, aby se tak předešlo marné a neopodstatněné léčbě [12]. Menší povědomí onkologů o širokých možnostech a zlepšujících se výsledcích IP jako takové může sehrávat roli v tom, že jejich pacienti nejsou k takové extenzi léčby často indikováni či tato indikace přichází s významnou časovou prodlevou, která se následně může podílet na nepříznivém terapeutickém výstupu [14, 15]. Celá řada recentních studií však dokazuje, že „tradiční“ pohled na postavení a výsledky intenzivní péče o nemocné s malignitami již není zcela relevantní. Recentní data přesvědčivě ukazují výrazné zlepšení jejich přežití, i když jejich mortalita je stále vysoká, zvláště u vybraných skupin – např. jedinců po transplantaci kostní dřeně se selháním dvou a více orgánů [16–18]. Nicméně, většina zmiňovaných prací hodnotí pouze krátkodobé přežití – JIP-mortalitu, nemocniční mortalitu, osmadvacetidenní mortalitu a pouze velmi vzácně tří - či šestiměsíční přežití. Pouze minimum studií dosud popisovalo smysluplné proměnné, jako přežívání bez nemoci (disease-free survival – DFS) a/nebo kvalitu života (quality-of-life – QoL) po kritickém stonání v intenzivní péči [19, 20].
Prediktory mortality a prognóza
V porovnání s populací kriticky nemocných se závažnými chronickými onemocněními (např. diabetes mellitus) a/nebo chronickými orgánovými dysfunkcemi (chronické onemocnění srdce, chronické onemocnění ledvin, chronické onemocnění jater aj.) se mortalita pacientů s malignitami výrazně neliší [21]. Multicentrická observační studie Tacconeho a spol. prokázala srovnatelnou mortalitu kriticky nemocných se solidními nádory a bez nich [8]. Také další práce potvrzují, že i u nemocných s malignitami (solidními i hematologickými) v IP lze dosáhnout relativně dobrého (krátkodobého) přežití [22–24]. Tento fakt se týká i nemocných s potřebou UPV, RRT, oběhové podpory a s neurologickými komplikacemi [25–28]. Smrtnost nemocných s malignitami a současným poškozením ≥ 3 orgánů/systémů je stále vysoká, dosahuje až 75 %, v porovnání s pacienty bez nádorového onemocnění se stejným rozsahem orgánového postižení (50 %) [8]. Akutní respirační selhání je nejdůležitějším rizikovým faktorem krátkodobé mortality nemocných s malignitami v IP [29]. Dokonce i nemocní s potřebou neinvazivní oxygenoterapie (nosní hroty/polomaska) s velmi malými průtoky kyslíku (1–2 l/min) mají smrtnost významně vyšší a tato se dále zvyšuje u těch s invazivní umělou plicní ventilací a maximální je u pacientů s ARDS [30].
Studií zabývajících se dlouhodobým přežitím, funkčním stavem a kvalitou života kriticky nemocných s malignitami je velmi málo. Starší práce popisovaly roční přežití u 25 % těchto pacientů (smíšená populace onkologických a hematoonkologických nemocných) [31]. Recentní studie zabývající se většinou hematoonkologickými nemocnými již ukazují 32‒64 % přeživších [17, 19, 32]. Na základě dostupných dat je dlouhodobé přežití pacientů s malignitami po IP více závislé na charakteristikách a prognóze vlastních nádorových onemocnění, zatímco tíže kritického stonání nejspíše nemá zásadní vliv [6, 31, 33]. I na tyto závěry však musíme pohlížet kriticky, jelikož vycházejí z limitovaného počtu prací na omezeném souboru nemocných, navíc z heterogenních populací ve smyslu typu malignity (solidní vs. hematologická), pokročilosti/stadiu základního onemocnění a terapie včetně případné transplantační léčby [6, 7, 32].
Aktuální literární data ukazují, že řada užívaných „klasických“ prediktorů krátkodobé (ICU/in-hospital) mortality kriticky nemocných pacientů s nádorovým onemocněním není vždy relevantní. Jak již bylo zmíněno výše, významnou asociaci s mortalitou má samotná tíže akutní deteriorace stavu nemocných charakterizovaná počtem a závažností selhávajících orgánů/systémů a případnou potřebou orgánových podpor a náhrad. Naopak vlastní charakteristiky maligního onemocnění, recentní či probíhající chemoterapie, anamnéza transplantace kmenových buněk krvetvorby a neutropenie zřejmě nehrají v krátkodobém přežití tak zásadní roli [6, 25, 33, 34]. Platnými rizikovými faktory asociovanými s horším přežitím jsou obdobně jako v běžné populaci kriticky nemocných závažné komorbidity a chronická orgánová onemocnění, špatná kvalita života a funkční stav v předhospitalizačním období. Za zvláštní zmínku stojí zpoždění v přijetí do IP a zahájení adekvátní léčby. Tento faktor je silně spojen s vyšší mortalitou kriticky nemocných s maligním onemocněním a bude diskutován dále. Faktory ovlivňující mortalitu těchto populací nemocných jsou shrnuty v tabulce 2.
Tab. 2. Rizikové faktory krátkodobé mortality (hemato-) onkologických nemocných v intenzivní péči (upraveno dle [16]) ![Rizikové faktory krátkodobé mortality (hemato-) onkologických nemocných v intenzivní péči (upraveno dle [16])](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/d9777cbcbe5e26f0cb1fd063128c87aa.png)
IP: intenzivní péče; GVHD: reakce štěpu proti hostiteli (graft-versus-host disease); BMT: transplantace kostní dřeně (bone marrow transplantation); SCT: transplantace kmenových buněk krvetvorby (stem cells transplantation); CVK: centrální venózní katétr Identifikace skupin nemocných s vysokou mortalitou
Nemocní s pokročilým maligním onemocněním se špatnou krátkodobou prognózou, respektive v terminálním stadiu těchto stonání bez možné, byť jen život prodlužující / symptomatické léčby mají neoddiskutovatelně vysokou mortalitu. Dalšími skupinami s neměnně vysokou a prozatím neovlivnitelnou mortalitou jsou: 1. pacienti s víceorgánovým postižením/selháním (multiple organ dysfunction syndrome, MODS) a pozdním přijetím do IP [14, 15], 2. skupina nemocných se solidními tumory s konkrétním nepříznivým biologickým průběhem (např.: plicní karcinomatózní lymfangitida s respiračním selháním, karcinomatózní meningitida s kómatem, infiltrace kostní dřeně extramedulárními solidními tumory s dřeňovým útlumem aj.) [35, 36] a 3. nemocní po alogenní transplantaci kostní dřeně (bone marrow transplantation, BMT) s těžkou reakcí štěpu proti hostiteli (graft-versus-host disease, GVHD) nereagující na imunosupresivní léčbu [27, 37].
Prognóza nemocných po alogenní BMT zůstává i přes všechny již zmíněné pokroky onkologické a intenzivní péče a selekci těchto nemocných poměrně špatná – roční přežití pacientů vyžadujících UPV je přibližně 10 % [27, 38]. Tato prognóza však není závislá na zdroji kmenových buněk krvetvorby (kostní dřeň vs. kmenové buňky krvetvorby z periferní krve či pupečníkové krve), základním maligním onemocněním ani na demografických charakteristikách nemocných (věk, komorbidity atd.) [27, 37, 38]. Vybrané rizikové faktory spojené se zvýšenou mortalitou této populace pacientů jsou sumarizovány v tabulce 3.
Tab. 3. Rizikové faktory spojené se zvýšenou mortalitou nemocných po BMT/SCT v intenzivní péči 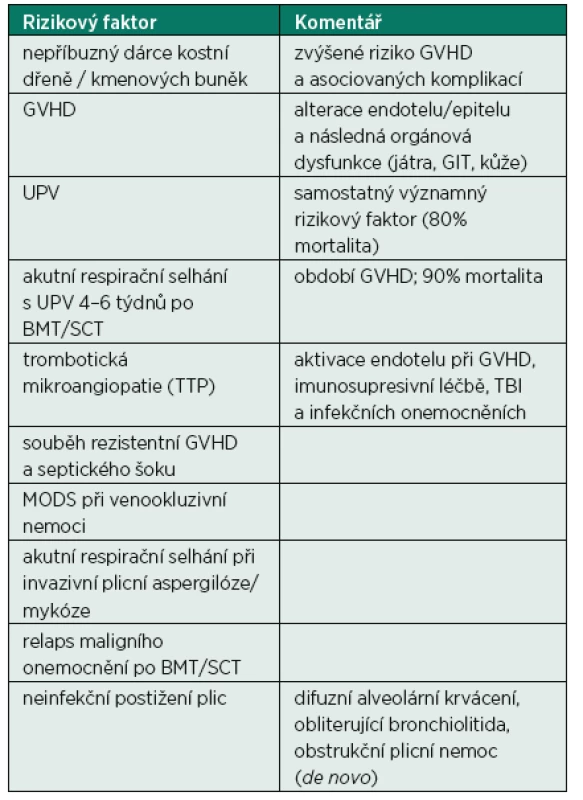
GVHD: reakce štěpu proti hostiteli (graft-versus-host disease); UPV: umělá plicní ventilace; GIT: gastrointestinální trakt; BMT: transplantace kostní dřeně (bone marrow transplantation); SCT: transplantace kmenových buněk krvetvorby (stem cells transplantation); TTP: trombotická trombocytopenická purpura; MODS: syndrom multiorgánové dysfunkce (multiple organ dysfunction syndrome); TBI: celotělové ozáření (total body irradiation) Časné přijetí nemocných s orgánovými dysfunkcemi do intenzivní péče
Všichni onkologicky nemocní pacienti s nestabilními vitálními funkcemi či vážnými akutními orgánovými dysfunkcemi, u kterých ošetřující (hemato)onkolog indikuje (či minimálně zvažuje a a priori nekontraindikuje) další extenzi léčby, by měli být konzultováni s intenzivisty k indikaci přijetí do IP. Veškerá dostupná literární data a praktické zkušenosti (nepublikovaná vlastní data autorů) podporují časné přijetí těchto pacientů do IP a poukazují na významně vyšší (zvyšující se) mortalitu při prodlení [10, 14, 15]. Jako v mnoha jiných klinických situacích však není lehké definovat, jak časně je skutečně dostatečně časně. V tomto ohledu některé práce dokonce ukazují prospěch preemptivního přijetí do IP vysoce rizikových nemocných bez manifestních orgánových dysfunkcí v porovnání s identickou kohortou podstupující iniciální management na standardním oddělení (mortalita 21 % vs. 35 %) [39]. Na základě všech výše diskutovaných faktů může konzultace a/nebo přizvání intenzivisty do péče o (hemato)onkologické nemocné s vysokým rizikem či již počínajícím orgánovým postižením snížit mortalitu těchto pacientů.
ROZSAH INTENZIVNÍ PÉČE PRO NEMOCNÉ S MALIGNITAMI NA ZÁKLADĚ PROGNÓZY ZÁKLADNÍHO ONEMOCNĚNÍ
Strategie přijetí do IP a její rozsah pro kriticky nemocné s malignitami se částečně překrývá a doplňuje s obecně užívanými kategoriemi léčby (plná léčba, zadržená léčba, paliativní péče) [10]. Vždy je však nezbytné přísně individuální posouzení konkrétního nemocného v kontextu základního onemocnění a aktuálního stavu.
Neomezená intenzivní péče („full-code“)
Intenzivní péče v plném rozsahu a bez limitací může být iniciálně doporučena:
- nemocným v remisi základního maligního onemocnění,
- nemocným s nově diagnostikovanou malignitou a dobrou dlouhodobou prognózou (> 1 rok),
- nemocným s malignitou a dostupnou potenciálně kurativní léčbou,
- nemocným s komplikacemi autologní transplantace kmenových buněk krvetvorby,
- selektovaným pacientům s „low-grade“ hematologickými malignitami,
- nemocným v parciální remisi mnohočetného myelomu,
- nemocným s pokročilými solidními tumory a dostupnou život prodlužující léčbou (> 1 rok).
Přehodnocení rozsahu léčby a cílů v průběhu intenzivní péče („ICU trial“)
U řady nemocných nejsou výše uvedená kritéria neomezené IP naplněna. Současně však máme opodstatněný důvod neodmítnout přijetí takových pacientů do IP, a poskytnout jim tak iniciální pokus o optimalizaci léčby. „ICU trial“ je alternativou tvořenou úvodní nelimitovanou péčí, která je následována časným přehodnocením dosažených cílů a dalšího rozsahu a směřování léčby. Stav a počet orgánových dysfunkcí po třetím, respektive pátém dni terapie jsou velmi dobrým parametrem k diskriminaci další prognózy a mortality [23, 24]. Tato strategie současně umožňuje vyřešit případný rozpor v názoru na rozsah péče konkrétního nemocného mezi (hemato)onkology a intenzivisty a případně i rodinnými příslušníky. Je nezbytné zmínit, že „ICU trial“ není standardem a měl by zůstat výjimečným řešením vyžadujícím velmi úzkou mezioborovou spolupráci.
Neindikovaná intenzivní péče
U nemocných se špatnou prognózou bez perspektivy alespoň potenciálně kurativní léčby není dle dostupných dat intenzifikace léčby o resuscitační postupy a náhrady orgánových dysfunkcí indikována. Do této skupiny pacientů můžeme obecně zařadit:
- nemocné bez dostupné (alespoň život prodlužující) protinádorové léčby,
- nemocné po alogenní transplantaci kostní dřeně s léčbou nekontrolovanou GVHD,
- nemocné s velmi špatnou dlouhodobou prognózou i přes adekvátní protinádorovou léčbu (přežití < 1 rok),
- nemocné s velmi špatnou kvalitou života a funkčním stavem v posledních měsících,
- nemocné odmítající IP.
Zvláštní podmínky a strategie intenzivní péče vybraných populací nemocných s malignitami
V rutinní praxi se samozřejmě stejně často, ne-li častěji setkáváme s pacienty, které nelze spolehlivě zařadit ani do jedné z výše uvedených skupin a jednoznačně tak rozhodnout o další léčebné strategii. Jejich kvalita života může být významně negativně ovlivněna samotnou malignitou a efekt protinádorové léčby na zlepšení funkčního stavu a délku přežití může být jen obtížně odhadnutelný. U těchto nemocných můžeme zvážit „výjimečné přijetí do IP“, kdy lze v rámci individuálně zvážené limitované péče získat čas k uplatnění efektu léčby základního onemocnění (bridging) [10] a eventuálně vyřešit spor o patřičný rozsah léčby mezi (hemato)onkology, intenzivisty, pacienty a rodinnými příslušníky. Tuto formu IP lze také zvážit u pacientů bez možnosti ovlivnit základní onemocnění jakoukoliv léčbou, ale současně se zachovalou dobrou QoL. V těchto případech může byt důvodem přijetí do IP dobře reverzibilní stav, jako např. akutní krvácení do gastrointestinálního traktu s významnou krevní ztrátou, iontové dysbalance (hyperkalemie) či přechodná léčba vazoplegie u dobře léčitelných infekcí aj. Tato forma péče může být na druhou stranu rovněž zdrojem dalších konfliktů na základě vytváření falešných nadějí a očekávání s následnou konfrontací se skutečnou realitou a výsledky.
Další strategií IP pro nemocné s neoplaziemi je tzv. profylaktická IP. Její postavení však není v současné době řádně etablováno a vychází z ojedinělých dat, jak již bylo zmíněno výše v textu [39].
Paliativní IP je jako výjimečná modalita určená pro pacienty v terminální fázi onemocnění. V těchto situacích jsou nemocní za jasně definovaných podmínek, limitací rozsahu léčby a cílů přijati do IP ke kontrole distresu, bolestí a dyskomfortu (paliativní péče) [40]. S touto formou IP se však nelze zcela ztotožnit, jelikož prostředí IP není nemocnými i jejich příbuznými ve fázi umírání vnímáno jako nejvhodnější [41]. Je zde většinou nedostatek soukromí a komfortu. Také pro ošetřující personál může tento typ péče představovat významný stres a značnou emoční zátěž. Pokud je však paliativní péče již jediným východiskem, nejedná se pouze o ošetřování umírajícího, nýbrž o komplexní přístup s cílem zlepšit kvalitu života a prožívání jedince vystaveného nezvratnému orgánovému selhání směřujícímu k úmrtí [42, 43]. Paliativní péče by současně neměla být problematikou pouze bezprostředně umírajících; její principy a cíle by měly být nedílnou součástí managementu onkologických kriticky nemocných od samého počátku [44]. Tato strategie může vést ke smysluplnému využívání prostředků IP, zkrácení délky hospitalizace v IP i celkově v nemocnici bez vlivu na mortalitu [45].
Chemoterapie a další cílená léčba (imunoterapie, biologika aj.) jsou nedílnou součástí léčby většiny nemocných s malignitami. Jsou modalitou s případným kurativním potenciálem a současně četnými riziky závažných komplikací. Zahájení či pokračování chemoterapie je v mnoha případech zcela zásadní ke kontrole maligního onemocnění. Aplikace chemoterapie v průběhu IP je možná [46, 47] a nepředstavuje zřejmě rizikový faktor vyšší mortality ani u nemocných se systémovou infekcí a s orgánovým postižením [48]. Krátkodobá mortalita je i u této skupiny nemocných dána akutní komplikací, přítomností, rozsahem a tíží orgánového postižení [48].
ZÁVĚR
Tento přehledový článek si neklade za cíl vyčerpávajícím způsobem sumarizovat všechny recentní poznatky a předložit rigorózní algoritmy péče o kriticky nemocné s malignitami. Autoři spíše předkládají syntézu literárních doporučení a poznatků a vlastních zkušeností. Poukazují na úskalí péče o onkologické nemocné v intenzivní péči, časté kontroverze a otázky plynoucí z této problematiky (tabulka 4). Autoři také v neposlední řadě kladou důraz na přísně individualizovaný přístup k těmto jedincům a racionální multioborovou spolupráci. Tímto způsobem lze mnohem lépe identifikovat jedince, kteří mohou profitovat z intenzivní péče, nastavit její rozsah, a naopak omezit její nadužívání a chránit nemocné před protrahovanou a marnou léčbou, vystavující je i jejich blízké neúměrnému stresu a strádání. Vzhledem k celé řadě nezodpovězených otázek týkajících se této problematiky jsou další výzkum a práce v této problematice více než vítány. Lze s potěšením zmínit, že na mezinárodním poli již třetím rokem existuje iniciativa Caring for critically ill immunocompromized patients multinational network (The Nine – I Network) [49], která cílí na prohloubení poznání v této oblasti za pomocí vytvoření centralizované databáze, iniciace a podpory studií a edukace v této problematice.
Tab. 4. Problematika onkologicky nemocných v intenzivní péči – nezodpovězené otázky a cíle (adaptováno dle [27]) ![Problematika onkologicky nemocných v intenzivní péči – nezodpovězené otázky a cíle (adaptováno dle [27])](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/d34994dc3d21581e3310d1535ce9bbf3.png)
DFS: přežití bez příznaků nemoci (disease free survival); QoL: kvalita života (quality of life); IP: intenzivní péče Kompletní a extenzivní seznam literatury týkající se diskutovaného tématu je k dispozici u autora.
Práce je původní, nebyla publikována ani není zaslána k recenznímu řízení do jiného média.
Autoři prohlašují, že v souvislosti s tématem práce nemají střet zájmů.
Všichni autoři rukopis četli, souhlasí s jeho zněním a zasláním do redakce časopisu Anesteziologie a intenzivní medicína.
Financování: Podpořeno z programu rozvoje vědních oborů Univerzity Karlovy (PROGRES – projekt Q39) a Projektu institucionálního výzkumu MZČR – FNPl 00669806.
Do redakce došlo dne 2. 3. 2017.
Do tisku přijato dne 22. 9. 2017.
Adresa pro korespondenci:
MUDr. Thomas Karvunidis, Ph.D.
e-mail: karvunidist@fnplzen.cz
Zdroje
1. Thiéry G, Azoulay E, Darmon M, et al. Outcome of cancer patients considered for intensive care unit admission: a hospital-wide prospective study. J Clin Oncol. 2005;23 : 4406–4413.
2. Ferlay J, Autier P, Boniol M, et al. Estimates of the cancer incidence and mortality in Europe 2003. Ann Oncol. 2007;18 : 581–592.
3. Rodriguez-Abreu D, Bordoni A, Zucca E. Epidemiology of hematological malignancies. Ann Oncol. 2007;18(Suppl 1):3–8.
4. Coleman MP, Quaresma M, Berrino F, et al. Cancer survival in five continents: a worldwide population-based study (CONCORD). Lancet. 2008;9 : 730–756.
5. Kinsey T, Jemal A, Liff J, et al. Secular trends in mortality from common cancers in the United States by educational attainment, 1993–2001. J Natl Cancer Inst. 2008;100 : 1003–1012.
6. Schellongowski P, Staudinger T, Kundi M, et al. Prognostic factors for intensive care unit admission, intensive care outcome, and post-intensive care survival in patients with de novo acute myeloid leukemia: a single center experience. Haematologica. 2011;96 : 231–237.
7. Puxty K, McLoone P, Quasim T, et al. Risk of critical illness among patients with solid cancers: a population-based observational study. JAMA Oncol. 2015;1 : 1078–1085.
8. Taccone FS, Artigas AA, Sprung CL, et al. Characteristics and outcomes of cancer patients in European ICUs. Crit Care. 2009;13:R15.
9. Černý V, Cvachovec K, Matějovič M. Zásady a principy pro přijímání pacientů na pracoviště intenzivní péče. Česká společnost intenzivní medicíny ČLS JEP – stanovisko výboru. Prakt Lék. 2015;95 : 186–187.
10. Schellongowski P, Sperr WR, Wohlfarht P, et al. Critically ill patients with cancer: chances and limitations of intensive care medicine – a narrative review. ESMO Open. 2016;1 : 18.
11. Tillyard AR. Ethics review: „Living wills“ and intensive care – an overview of the American experience. Crit Care. 2007;11 : 219.
12. Schapira DV, Studnicki J, Bradham DD, et al. Intensive care, survival, and expense of treating critically ill cancer patients. JAMA. 1993;269 : 783–786.
13. Faber-Langendoen K, Caplan AL, McGlave PB. Survival of adult bone marrow transplant patients receiving mechanical ventilation: a case for restricted use. Bone Marrow Transplant. 1993;12 : 501–507.
14. Song JU, Suh GY, Park HY, et al. Early intervention on the outcomes in critically ill cancer patients admitted to intensive care units. Intensive Care Med. 2012;38 : 1505–1513.
15. Mokart D, Lambert J, Schnell D, et al. Delayed intensive care unit admissionis associated with increased mortality in patients with cancer with acute respiratory failure. Leuk Lymphoma. 2013;54 : 1724–1729.
16. Bird GT, Farquhar-Smith P, Wigmore T, et al. Outcomes and prognostic factors in patients with haematological malignancy admitted to a specialist cancer intensive care unit: a 5 year study. Br J Anaesth. 2012;108 : 452–459.
17. Azoulay E, Mokart D, Pène F, et al. Outcomes of critically ill patients with hematologic malignancies: prospective multicenter data from France and Belgium – a groupe de recherche respiratoire en réanimation onco-hématologique study. J Clin Oncol. 2013;31 : 2810–2818.
18. Mokart D, Darmon M, Resche-Rigon M, et al. Prognosis of neutropenic patient sadmitted to the intensive care unit. Intensive Care Med. 2015;41 : 296–303.
19. Oeyen SG, Benoit DD, Annemans L, et al. Long-term outcomes and quality of life in critically ill patients with hematological or solid malignancies: a single center study. Intensive Care Med. 2013;39 : 889–898.
20. Faucher E, Cour M, Jahandiez V, et al. Short - and long-term outcomes in onco-hematological patients admitted to the intensive care unit with classic factors of poor prognosis. Oncotarget. 2016;7 : 2427–2438.
21. Tanvetyanon T, Leighton JC. Life-sustaining treatments in patients who died of chronic congestive heart failure compared to metastatic cancer. Crit Care Med. 2003;31 : 60–64.
22. Benoit DD, Vandewoude KH, Decruyenaere JM, et al. Outcome and early prognostic indicators in patients with a hematologic malignancy admitted to the intensive care unit for life-threatening complication. Crit Care Med. 2003;31 : 104–112.
23. Lecruyer L, Chevret S, Thiery G, et al. The ICU trial: a new admission policy for cabcer patients requiring mechanical ventilation. Crit Care Med. 2007;35 : 808–814.
24. Soares M, Azoulay E. Critical care management of lung cancer patients to prolong life without prolonging dying. Intensive Care Med. 2009;35 : 2012–2014.
25. Azoulay E, Alberti C, Bornstain C, et al. Improved survival in cancer patients requiring mechanical ventilatory support: impact of noninvasive mechanical ventilatory support. Crit Care Med. 2001;29 : 519–525.
26. Larché J, Azoulay E, Fieux F, et al. Improved survival of critically ill cancer patients with septic shock. Intensive Care Med. 2003;29 : 1688–1695.
27. Péne F, Aubron C, Azoulay E, et al. Outcome of critically ill allogeneic hematopoietic stem-cell Transplantation recipients: a reappraisal of indications for organ failure supports. J Clin Oncol. 2006;24 : 643–649.
28. Legriel S, Marijon H, Darmon M, et al. Central neurological complications in critically ill patients with malignancy. Intensive Care Med. 2010;36 : 232–240.
29. Pastores SM, Voigt LP. Acute respiratory failure in the patient with cancer: diagnostic and management strategies. Crit Care Clin, 2010;26 : 21–40.
30. Azoulay E, Lemiale V, Mokart D, et al. Acute respiratory distress syndrome in patients with malignancies. Intensive Care Med. 2014;40 : 1106–1114.
31. Staudinger T, Stoiser B, Müllner M, et al. Outcome and prognostic factors in critically ill cancer patients admitted to the intensive care unit. Crit Care Med. 2000;28 : 1322–1328.
32. Wohlfarth P, Carlström A, Staudinger T, et al. Incidence of intensive care unit admission, outcome and post intensive care survival in patients with diffuse large B-cell lymphoma. Leuk Lymphoma. 2016;57 : 1831–1838.
33. Massion PB, Dive AM, Doyen C, et al. Prognosis of hematologic malignancies does not predict intensive care unit mortality. Crit Care Med. 2002;30 : 2260–2270.
34. Darmon M, Azoulay E, Alberti C, et al. Impact of neutropenia duration on short-term mortality in neutropenic critically ill cancer patients. Intensive Care Med. 2002;28 : 1775–1780.
35. Oh SY, Lee SJ, Lee J, et al. Gastric leptomeningeal carcinomatosis: multi-center retrospective analysis of 54 cases. World J Gastroenterol. 2009;15 : 5086–5090.
36. Ruffato A, Mattioli S, Pileri S, et al. Do bone marrow isolated tumor cells influence long-term survival of non-small cell lung cancer? Eur J Cardiothorac Surg. 2009;35 : 463–468.
37. Afessa B, Azoulay E. Critical care of the hematopoietic stem cell transplant recipient. Crit Care Clin. 2010;26 : 133–150.
38. Afessa B, Tefferi A, Dunn WF, et al. Intensive care unit support and Acute Physiology and Chronic Health Evaluation III performance in hematopoietic stem cell transplant recipients. Crit Care Med. 2003;31 : 1715–1721.
39. Lengliné E, Raffoux E, Lemiale V, et al. Intensive care unit management of patients with newly diagnosed acute myeloid leukemia with no organ failure. Leuk Lymphoma. 2012;53 : 1352–1359.
40. Azoulay E, Kouatchet A, Jaber S, et al. Noninvasive mechanical ventilation in patients having declined tracheal intubation. Intensive Care Med. 2013;39 : 292–301.
41. Wright AA, Keating NL, Ayanian JZ, et al. Family Perspectives on Aggressive Cancer Care Near the End of Life. JAMA. 2016;315 : 284–292.
42. World Health Organization. Definition of palliative care. http://www.who.int/cancer/palliative/definition/en/, 2016.
43. Černý V, Cvachovec K, Pařízková R, et al. Konsenzuální stanovisko k poskytování paliativní péče u nemocných s nezvratným orgánovým postižením (ČSARIM ČLK JEP, ČSIM ČLK JEP). Anesteziol Intensiv Med. 2009;20 : 218–221.
44. Delgado-Guay MO, Parsons HA, Li Z, Palmer LJ, Bruera E. Symptom distress, interventions, and outcomes of intensive care unit cancer patients referred to a palliative care consult team. Cancer. 2009;115 : 437–445.
45. Norton SA, Hogan LA, Holloway RG, et al. Proactive palliative care in the medical intensive care unit: effects on length of stay for selected high-risk patients. Crit Care Med. 2007;35 : 1530–1535.
46. Darmon M, Thiery G, Ciroldi M, et al. Intensive care in patients with newly diagnosed malignancies and a need for cancer chemotherapy. Crit Care Med. 2005;33 : 2488–2493.
47. Benoit DD, Depuydt PO, Vandewoude KH, et al. Outcome in severely ill patients with hematological malignancies who received intravenous chemotherapy in the intensive care unit. Intensive Care Med. 2006;32 : 93–99.
48. Vandijck DM, Benoit DD, Depuydt PO, et al. Impact of recent intravenous chemotherapy on outcome in severe sepsis and septic shock patients with hematological malignancies. Intensive Care Med. 2008;34 : 847–55.
49. Hemelaar P, Azoulay E, Pickers P. Caring for critically ill immunocompromized patients multinational network (The Nine – I Network) – The Bekele Afessa Research Day. Netherlands J Crit Care. 2016;24 : 37–38.
Štítky
Anestéziológia a resuscitácia Intenzívna medicína
Článok vyšiel v časopiseAnesteziologie a intenzivní medicína
Najčítanejšie tento týždeň
2017 Číslo 6- Realita liečby bolesti v paliatívnej starostlivosti v Nemecku
- MUDr. Lenka Klimešová: Multiodborová vizita je kľúč k efektívnejšej perioperačnej liečbe chronickej bolesti
- Metamizol v liečbe pooperačnej bolesti u opioid-tolerantnej pacientky – kazuistika
- e-Konzilium.cz — Masivní plicní embolie při tromboembolické nemoci
- DESATORO PRE PRAX: Aktuálne odporúčanie ESPEN pre nutričný manažment u pacientov s COVID-19
-
Všetky články tohto čísla
- Srovnání monitorace srdečního výdeje metodou „Pulse wave transit time“ a analýzou arteriální křivky
-
Dospělý onkologický nemocný v intenzivní péči
Je již čas říci „ano, zvážíme to“ než říkat „ne“?! - Ultrazvukově asistovaná infraklavikulární pokračující blokáda brachiálního plexu
- Srdce jako zdroj systémových embolizací
- TotalTrack VLM – nová pomůcka pro obtížné zajištění dýchacích cest
- Perioperační nutrice – význam a nutnost edukace pacientů
- Statistika v biomedicínském výzkumu III
- Bezpečné podávání farmak během anesteziologické péče
- ETIKA V INTENZIVNÍ PÉČI
- Mapovitá spinální anestezie – co je příčinou?
- MUDr. Milan Poledna (1. 6. 1922 – 1. 12. 2017)
- Doporučení pro léčbu kardiálního selhání
- Pravidelná chůze znamená menší riziko smrti
-
Anestezie v Rakousko-Uhersku během I. světové války a po vzniku samostatného československého státu
Část III – Intravenózní regionální anestezie a neuroaxiální metody anestezie - Zajímavosti, tipy a triky
- Rejstříky
- Anesteziologie a intenzivní medicína
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- ETIKA V INTENZIVNÍ PÉČI
- Srdce jako zdroj systémových embolizací
- Srovnání monitorace srdečního výdeje metodou „Pulse wave transit time“ a analýzou arteriální křivky
- Ultrazvukově asistovaná infraklavikulární pokračující blokáda brachiálního plexu
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



