-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Vybrané aspekty péče o dárce orgánů s mozkovou smrtí
Selected aspects of the management of the brain-dead organ donor
Transplantation medicine is undergoing an extraordinary progress nowadays. The number of organ transplants has been permanently increasing. The organ donation program represents a cornerstone of transplantation medicine. The majority of organs for transplantation in the Czech Republic is harvested from brain-dead donors. The legislative and organisational framework has been defined by the Transplantation Act and related documents. In this atricle we review the basics of brain death pathofysiology, brain death diagnostics and the complex management of the organ donor in intensive care units.
Keywords:
organ donor – organ transplantation – brain death
Autori: L. Kielberger 1,2; J. Beneš 2,3
Pôsobisko autorov: 1. interní klinika, Lékařská fakulta v Plzni, Univerzita Karlova 1; Biomedicínské centrum, Lékařská fakulta v Plzni, Univerzita Karlova 2; Klinika anesteziologie, resuscitace a intenzivní medicíny, Lékařská fakulta v Plzni, Univerzita Karlova 3
Vyšlo v časopise: Anest. intenziv. Med., 29, 2018, č. 1, s. 23-32
Kategória: Intenzivní medicína - Přehledový článek
Súhrn
Transplantační medicína zaznamenává v posledních letech nebývalý rozvoj, počet nemocných léčených orgánovou transplantací setrvale narůstá. Dárcovský program je pak úhelným kamenem celé transplantační medicíny. V České republice představují dárci se smrtí mozku většinový zdroj orgánů pro potřeby transplantace. Legislativní a organizační rámec je v našich podmínkách definován transplantačním zákonem a souvisejícími předpisy. V následujícím přehledu dále shrnujeme patofyziologické pochody v souvislosti s mozkovou smrtí, diagnostický postup k potvrzení smrti mozku a základní opatření v péči o hemodynamiku, ventilaci a vnitřní prostředí potenciálního dárce orgánů na jednotce intenzivní péče.
Klíčová slova:
dárce orgánů – transplantace orgánů – smrt mozkuÚVOD
Kadaverózní dárci orgánů a tkání představují základní pilíř transplantologie. V České republice byl dle údajů Koordinačního střediska transplantací v roce 2017 indikován odběr orgánů od 269 zemřelých dárců, z toho od 256 dárců po průkazu mozkové smrti a dále od 13 dárců v rámci programu odběru orgánů po zástavě oběhu. Od zemřelých dárců bylo provedeno celkem 418 transplantací ledvin, 74 transplantací srdce, 205 transplantací jater, 44 transplantací plic, 39 transplantací pankreatu, 1 transplantace tenkého střeva a 2 transplantace dělohy. Výsledky transplantačního programu v České republice jsou shrnuty v tabulce 1. S ohledem na narůstající počet čekatelů indikovaných k orgánové transplantaci je nutné rozšiřování kritérií pro dárcovství a současně i pečlivé vyhledávání potenciálních dárců v rámci oddělení akutního příjmu či lůžkových oddělení intenzivní péče. Funkce transplantovaných orgánů v těle příjemce se, mimo jiné, odvíjí od správné péče o dárce orgánů před stanovením smrti a vlastním odběrem v rámci jednotky intenzivní péče.
Tab. 1. Přežití pacientů po orgánových transplantacích (Zdroj: Česká transplantační společnost [1]) ![Přežití pacientů po orgánových transplantacích
(Zdroj: Česká transplantační společnost [1])](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/b435f3f81e4fe962238ee01bca010eec.png)
Pozn. Nezahrnuje retransplantace. Údaje z databáze České transplantační společnosti z let 2000–2013. N/A – data nejsou dostupná PRÁVNÍ RÁMEC DÁRCOVSKÉHO PROGRAMU
Platná novelizace transplantačního zákona [2] definuje povinnosti jednotlivých organizačních složek transplantačního programu v České republice. Koordinační středisko transplantací (KST) je odpovědné za vedení registru dárců a provedených transplantací, koordinaci jednotlivých odběrových týmů včetně mezinárodní spolupráce a současně i za vedení a správu čekací listiny a alokaci odebraných orgánů na základě definovaného algoritmu. Dalším úkolem KST je spolupráce s ministerstvem zdravotnictví a jednotlivými transplantačními centry na zajištění jakosti a bezpečnosti transplantací orgánů a administrativní úkony s tím spojené. Samotné transplantační centrum indikuje a provádí vlastní odběry orgánů a orgánové transplantace, vede vyšetřování a přípravu příjemců k transplantaci a následnou pooperační péči o příjemce po orgánových transplantacích. Transplantační centrum komunikuje s jednotlivými regionálními pracovišti intenzivní péče a s Koordinačním střediskem transplantací. Poskytovatel zdravotních služeb je podle platných norem povinen informovat příslušné transplantační centrum o možném dárci orgánů. Ve spolupráci s transplantačním centrem pak probíhá další diagnostika se zaměřením na smrt mozku a posouzení funkce a morfologie jednotlivých orgánů. Na odběru jednotlivých orgánů u jednoho dárce mohou pak spolupracovat týmy z více transplantačních center (tab. 2).
Tab. 2. Síť transplantačních center v České republice 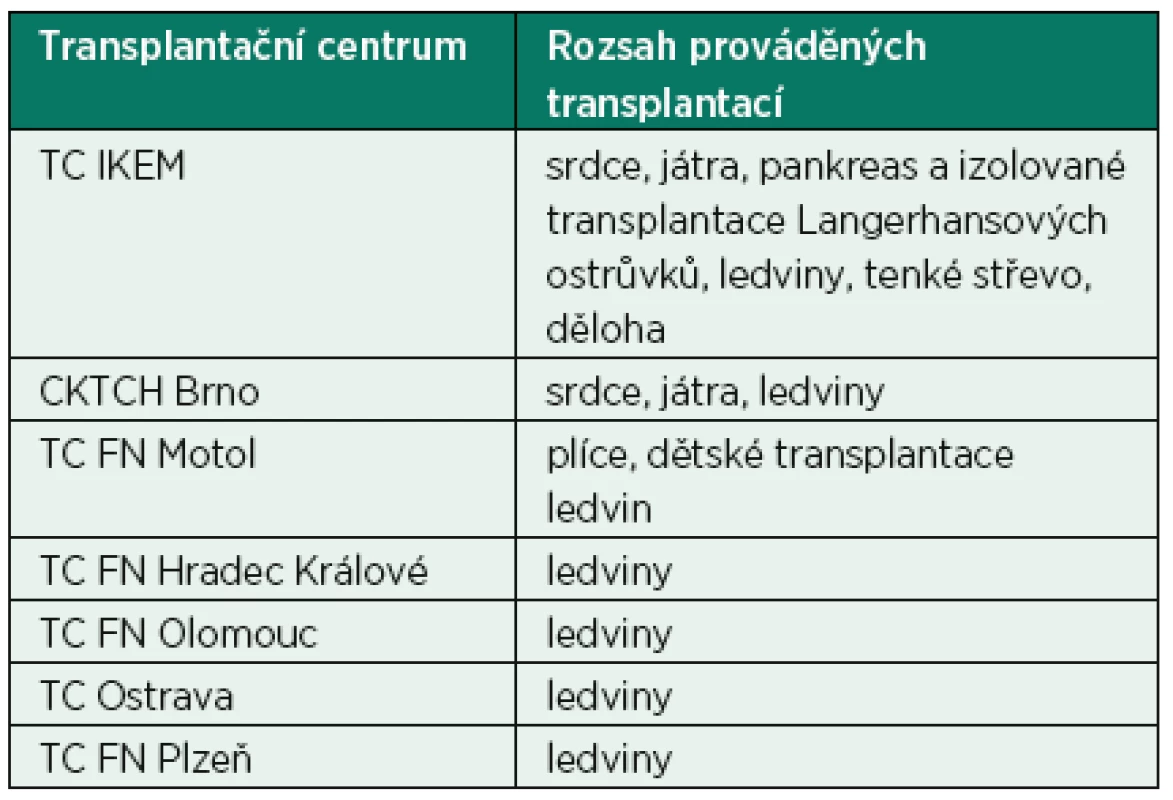
Právní kontraindikace odběru jsou jasně definované transplantačním zákonem a příslušnými vyhláškami [2]. V České republice, stejně jako v celé řadě dalších zemí, platí předpokládaný souhlas zemřelého s posmrtným odběrem orgánů. Zákon stanoví způsob vyjádření nesouhlasu s odběrem orgánů a tkání. Nesouhlas je třeba zanést do formuláře Národního registru osob nesouhlasících s posmrtným odběrem orgánů a tkání (NROD). Vyjádření nesouhlasu je možné i tak, že zemřelý ještě za svého života přímo ve zdravotnickém zařízení před ošetřujícím lékařem a svědkem prohlásí, že nesouhlasí s odběrem v případě smrti. I takto vyjádřený nesouhlas by měl být následně zaevidován do zmíněného registru. V případě nezletilých a osob nezpůsobilých k právním úkonům může být nesouhlas vyjádřen zákonným zástupcem.
Zákon ukládá povinnost ošetřujícího lékaře informovat osoby blízké zemřelému o možnosti odběru orgánů a tkání. V případě vyjádření nesouhlasu s odběrem orgánů ze strany osoby blízké je tento postoj v rámci zvyklostí v České republice v naprosté většině případů respektován. Tento nesouhlas však není pro poskytovatele péče právně závazný a nemusí představovat překážku odběru.
KONTRAINDIKACE DÁRCOVSTVÍ
Absolutní medicínské kontraindikace vyplývají z rizika přenosu infekčního či maligního onemocnění do těla příjemce (tab. 3). Vyšetření základní infekční sérologie je součástí standardního protokolu u všech zvažovaných dárců orgánů a zahrnuje sérologické vyšetření hepatitidy B a C, syfilis a HIV. Léčené infekční onemocnění se známým agens není kontraindikací odběru ani transplantace orgánů při možnosti současného zajištění příjemce cílenou antibiotickou léčbou. Neexistují jednoznačná doporučení týkající se délky antibiotické léčby před odběrem orgánů u dárce s prokázanou systémovou infekcí, respektive bakteriemií. Léčba by v tomto případě měla být řízena podle vlastního zdroje infektu a jeho kontroly a současně známek klinické i laboratorní odpovědi, dle možností i včetně negativního kontrolního kultivačního vyšetření. Kazuistické práce zmiňují délku léčby 48 hodin [5]. Naproti tomu nekontrolovaná bakteriální infekce je jednoznačnou kontraindikací dárcovství. Vysoký věk sám o sobě nebrání odběru orgánů, stejně tak ani přítomnost civilizačních chorob včetně hypertenze a diabetu. K posouzení biologického věku a transplantability jednotlivých orgánů pomáhají jednotlivá doplňková vyšetření včetně biopsie prováděné během odběru. Akutní poškození ledvin s potenciálem k reparaci nemusí představovat překážku odběru i transplantace ledviny. Hodnocení kvality odebíraných ledvin vyplývá z posouzení tíže a dynamiky poškození funkce ledvin, močového nálezu či z biopsie provedené v rámci odběru.
Tab. 3. Kontraindikace odběru orgánů [3, 4] ![Kontraindikace odběru orgánů [3, 4]](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/604f9d192361af5784ae5c8b116d0336.png)
U nemocných s anamnézou léčené malignity se rozhodujeme podle jejího typu, časového odstupu od navození remise a dokumentovaných známek rozsevu. Minimální riziko transferu je u nemocných s bazocelulárním karcinomem kůže, obecně s karcinomy in situ či povrchového neinvazivního papilokarcinomu močového měchýře a u vybraných intrakraniálních nádorů [6, 7]. Nádory s častým výskytem pozdních metastáz, jako karcinom prsu, karcinom střeva, maligní melanom, leukémie či lymfom, jsou u dárců spojeny s vysokým rizikem přenosu [8]. Výjimkou mohou být pacienti s karcinomem prsu stadia T1a aT1b nebo s karcinomem tlustého střeva stadia T1 s remisí trvající 10 let [9, 10]. U potenciálních dárců s anamnézou nevyléčitelného tumoru nebo s nedostatečným sledováním je riziko transferu malignity vysoké [6] a je jasnou kontraindikací dárcovství orgánů. Obecně lze konstatovat, že u dárců s odstupem 5 let od navození remise s pravděpodobností vyléčení > 99 % je riziko přenosu nízké. V případě ex post zjištění malignity v rámci pitvy již po uskutečněném odběru a transplantaci jednotlivých orgánů je nutné pečlivé sledování příjemce.
DIAGNOSTIKA SMRTI MOZKU
Mozková smrt je definována jako nezvratné vymizení všech mozkových funkcí včetně funkcí mozkového kmene bez ohledu na přetrvávající činnost kardiovaskulárního aparátu a jiných orgánů [11]. Podmínky stanovení smrti mozku jsou jasně definovány transplantačním zákonem [2]. Vyšetření za účelem prokázání klinických známek smrti mozku provádějí nezávisle na sobě dva lékaři s příslušnou specializovanou způsobilostí. Alespoň jeden z lékařů posuzujících smrt mozku musí mít specializovanou způsobilost nejméně v jednom z oborů, kterým je anesteziologie a intenzivní medicína, neurologie nebo neurochirurgie v případě dospělých dárců. U dárců do 18 let věku musí mít alespoň jeden z lékařů zjišťujících smrt dítěte specializovanou způsobilost v oboru dětské lékařství nebo anesteziologie a intenzivní medicína, neurologie nebo neurochirurgie anebo zvláštní odbornou způsobilost v oboru dětská neurologie. V případě novorozenců do 27. dne věku či u zemřelých na neonatologickém oddělení je výčet odborností rozšířen o lékaře s odbornou způsobilostí v oboru neonatologie [3].
Výsledek klinického vyšetření je pak zaznamenán do protokolu o zjištění smrti. U dětí do jednoho roku věku se vyšetření klinických známek smrti mozku provádí dvakrát v odstupu nejméně 48 hodin.
Stavem, na jehož základě lze uvažovat o diagnóze smrti mozku, je stav, kdy:
- u pacienta není pochybnost o diagnóze strukturálního poškození mozku ani o jeho nevratnosti,
- pacient je v hlubokém bezvědomí, na umělé plicní ventilaci a je vyloučeno, že se na bezvědomí v okamžiku vyšetření podílí intoxikace, tlumivé a relaxační účinky léčiv, primární podchlazení, metabolický nebo endokrinní rozvrat.
Klinickými známkami smrti mozku, na základě jejichž prokázání lze stanovit diagnózu smrti mozku, jsou:
- hluboké bezvědomí,
- zornicová areflexie,
- korneální areflexie,
- vestibulookulární areflexie,
- absence jakékoli motorické reakce na algický podnět aplikovaný v inervační oblasti hlavových nervů,
- absence kašlacího reflexu nebo jakékoli bezprostřední motorické reakce na hluboké tracheobronchiální odsávání,
- trvalá zástava spontánního dýchání prokázaná apnoickým testem.
Apnoický test se provádí po splnění všech ostatních klinických kritérií smrti mozku. Podmínkou provedení testu je normotermie a stabilizace oběhu. Standardním způsobem provedení testu je rozpojení ventilačního okruhu po předchozí preoxygenaci 100% kyslíkem při současné eukapnii s následným promýváním dýchacích cest 100% kyslíkem rychlostí 6l/min. Jako pozitivní výsledek je definována absence dechové odpovědi, nejčastěji sledována jako absence dechových pohybů při vzestupu paCO2 nad 60 mmHg (8 kPa) či při zvýšení paCO2 o 20 mmHg (2,67 kPa) od výchozí hodnoty [11]. Pokles saturace kyslíkem v průběhu testu pod 85 % trvající déle než 30 vteřin je důvodem k přerušení testu, ke zvážení je pak jeho zopakování s použitím CPAP (viz níže). U potenciálních dárců plic je vhodné provedení apnoického testu se současným udržením přetlaku v dýchacích cestách pomocí napojení tracheální rourky na T-piece s udržením pozitivního přetlaku (CPAP 10 cm H2O) a konstantním průtokem 100% kyslíku 12 l/min [12]. Samotný apnoický test má omezenou výpovědní hodnotu u nemocných s chronickou respirační insuficiencí adaptovaných na vysoké hodnoty arteriálního paCO2 a u případů s neuromuskulární paralýzou, s vysokou míšní lézí či u nemocných se závažným traumatem hrudníku. Tyto okolnosti však a priori nejsou důvodem neprovádění průkazu smrti mozku předepsanými technikami včetně apnoického testu. O možných limitacích standardního vyšetřovacího protokolu musí být vždy proveden záznam v dokumentaci.
Další pomocné vyšetření představuje atropinový test s absencí vzestupu tepové frekvence o 3 % po bolusovém podání 3 mg atropinu [13]. Atropinový test však není povinnou součástí protokolárního vyšetření u nemocného s mozkovou smrtí dle platné legislativy. Doplňkové vyšetření založené na posouzení poměru saturace žilní krve z pravé síně a z bulbu jugulární žíly je spojeno s vysokou senzitivitou i specificitou, nicméně pro technickou náročnost jej nelze doporučit jako plošné vyšetření [14].
Klinická diagnóza musí být potvrzena vyšetřením potvrzujícím nevratnost klinických známek smrti mozku. Dle zákona je možné využít tyto vyšetřovací modality:
- angiografie mozkových tepen,
- mozková perfuzní scintigrafie,
- počítačová tomografická angiografie (CT-Ag),
- transkraniální dopplerovská ultrasonografie,
- vyšetření sluchových kmenových evokovaných potenciálů (BAEP).
Protokoly provedení vlastních doplňkových vyšetření jsou formulovány příslušnými odbornými společnostmi. V současnosti není v rámci ČR vydán jasný protokol vyšetření ke stanovení smrti mozku pomocí CT-Ag vyšetření. Rutinnímu použití této metody zatím brání nejednotnost v metodice vyšetření, rozpory v diagnostické přesnosti metody a nejasnosti v interpretaci výsledků. Z tohoto důvodu jsou doposud preferovány spíše ostatní instrumentální metody.
U zemřelých osob s jasně objektivně prokázanou těžkou strukturální infratentoriální lézí se provádí pouze klinické vyšetření bez nutnosti instrumentálního potvrzení. Za takových okolností je třeba konzultovat specialistu v oboru neurochirurgie k ověření nemožnosti chirurgické intervence.
Za stavy s klinickým obrazem podobným mozkové smrti lze považovat locked-in syndrom, neuromuskulární paralýzu u těžkých polyneuropatií (s autonomní složkou), hypotermii, intoxikaci či těžkou formu Guillainova-Barréova syndromu. Příčinou locked-in syndromu je ložiskové poškození ventrální části pontu. Důsledkem je ztráta hybnosti všech příčně pruhovaných svalů (s výjimkou okohybných svalů) a stejně tak ztráta citlivosti při zcela zachovaném vědomí. Při locked-in syndromu je zachován vertikální pohled a případně pohyblivost víček [15, 16]. U stavů s primární patologií v oblasti mozkového kmene platí požadavek na velmi důsledné klinické vyšetření v rámci diferenciální diagnostiky mozkové smrti, respektive locked-in syndromu. Ostatní uvedené stavy imitující smrt mozku mohou být vyloučeny při dodržení základních podmínek klinického vyšetření (viz výše).
PATOFYZIOLOGICKÉ ZMĚNY A PRAKTICKÉ ASPEKTY PÉČE
Podstatou patofyziologických změn v důsledku mozkové smrti je progresivní rostrální-kaudální ischemie při narůstajícím nitrolebním tlaku. Komplexní patofyziologické důsledky jsou dány jak vlastní intrakraniální hypertenzí, tak vyvolávající příčinou mozkové smrti a dále provedenými resuscitačními a léčebnými opatřeními.
Hemodynamické změny
Hlavním mechanismem hemodynamické instability a kardiovaskulárních změn u potenciálního dárce je vzestup nitrolebního tlaku, který indukuje reaktivní hypertenzi s cílem udržet mozkovou a kmenovou perfuzi. Progrese ischemie kaudálně pak vede k parasympatické reaktivní bradykardii. Další rozšíření ischemie směrem k jádrům prodloužené míchy je provázeno přechodnou katecholaminovou bouří s intenzivní periferní vazokonstrikcí při hyperaktivaci sympatiku bez funkční „parasympatické brzdy“. Kompletní herniace s míšním ischemickým postižením je následně spojena se ztrátou sympatického a vaskulárního tonu a vede k progresivní hypotenzi a kardiovaskulárnímu kolapsu [17–19]. K hemodynamické nestabilitě může dále přispívat intravaskulární deplece v souvislosti s kapilárním únikem tekutiny v rámci systémové inflamatorní odpovědi, krvácení vyvolané sdruženým poraněním, ale také polyurie při rozvoji centrálního diabetu insipidu (DI).
V důsledku těchto mechanismů může docházet k poškození cílových orgánů. Akcelerace hypertenze (případně ve spojení s tachykardií) má obvykle tranzitorní charakter v rámci fyziologické odpovědi na vzestup nitrolebního tlaku či na vyplavení katecholaminů při manipulaci s pacientem či v přímé souvislosti s odběrem. Vzestup krevního tlaku je v tomto případě obvykle sebelimitující a často nevyžaduje léčebný zásah. Nicméně prolongované hypertenze/tachykardie u dárce orgánů mohou vést k orgánovému poškození. V tomto případě je k jejich ovlivnění indikováno užití (ultra-)krátce účinných vazodilatátorů či betablokátorů. Podávání medikace s déletrvajícím účinkem není žádoucí, neboť může vést k rozvoji následné obtížně ovlivnitelné hypotenze [20, 21]. Strukturální poškození myokardu v důsledku katecholaminové bouře je popisováno v různém rozsahu až u čtvrtiny všech dárců srdce se smrtí mozku [22] a je ekvivalentem stresem indukované (nebo též tako-tsubo) kardiomyopatie z jiných příčin [23]. Echokardiografické známky kardiální dysfunkce v souvislosti se smrtí mozku jsou popisovány až u 40 % dárců [24]. V důsledku funkčního a strukturálního postižení myokardu je vysoké riziko arytmických příhod. Stupeň poškození myokardu je ovlivněn rychlostí vzestupu nitrolebního tlaku. Na experimentálním psím modelu byl explozivní nástup nitrolební hypertenze spojen s tisícinásobným vzestupem hladin katecholaminů a průkazem těžkých ischemických myokardiálních změn v 93 % oproti pozvolnému vzestupu nitrolebního tlaku, kdy byl vzestup hladin katecholaminů 200násobný a ischemické změny myokardu v 23 % [25].
Udržení oběhové stability a dostatečné orgánové perfuze představuje klíčovou část péče o dárce. Základní hemodynamické cíle a monitorace (invazivní měření krevního tlaku, centrálního žilního tlaku, sledování diurézy) v zásadě nevybočují z běžných principů intenzivní péče (tab. 4). Pokročilejší monitorace hemodynamiky ve smyslu využití plicnicového katétru či méně invazivní měření srdečního výdeje není v současnosti u dárců běžným standardem, nicméně může přispět k optimalizaci hemodynamického stavu, a tedy regionální perfuze.
Tab. 4. Návrh cílových hodnot hemodynamických parametrů u dárce orgánů 
* Pozn: je-li měřen, autoři měření nepovažují za nutné Základním opatřením k udržení kardiovaskulární stability pacienta je doplnění intravaskulárního objemu a současně podpora vazoaktivními látkami. Balancované krystaloidy jsou roztokem volby u dárců orgánů. Konkrétní typ roztoku, jeho dávku a rychlost podání volíme podle aktuálního stavu, vnitřního prostředí a přítomnosti DI. Fyziologický roztok je s ohledem na své složení spíše spojen s rizikem progrese nežádoucí hypernatrémie a potenciace renálního poškození při rozvoji hyperchloremické metabolické acidózy. Při signifikantních ztrátách bezsolutové vody v rámci polyurie je naopak často nutné využití hypotonických roztoků. Opakovaně byl prokázán negativní efekt roztoků hydroxyethylškrobu na rozvoj funkce transplantované ledviny [26, 27], a tudíž je jeho použití u potenciálních dárců kontraindikováno. U ostatních syntetických koloidů zatím nejsou jednoznačné důkazy proti jejich využití, nicméně z patofyziologického pohledu k nim lze u potenciálních dárců orgánů přistupovat stejně jako ke škrobovým roztokům.
Agresivní substituce tekutin s přetížením může v plicích vést k extraalveolární akumulaci tekutiny a ve výsledku ke snížení počtu odebraných plic [28]. Jak ukázala španělská práce, racionální tekutinová restrikce nevedla ke zhoršení funkce odebraných ledvin [29]. Statické parametry preloadu (centrální žilní tlak nebo tlak v zaklínění) nejsou vhodnými vodítky ke korekci volemie. Jako nástroj k posouzení adekvátnosti tekutinové resuscitace je lépe užít dynamických parametrů předtížení (ventilací indukovaná variabilita pulsního tlaku nebo tepového objemu, distenzibilita dolní duté žíly hodnocená echokardiograficky). Nicméně tekutinová optimalizace dárců pomocí rozšířené monitorace hemodynamiky kalibrovanou analýzou tepové křivky (přístroj LiDCO Plus) nevedla k významnému zvýšení počtu odebraných orgánů v recentní prospektivní multicentrické studii [30]. Vzhledem ke komplexnosti protokolu a technickým obtížím ale u řady nemocných (24 %) nebyla provedena požadovaná intervence. Naproti tomu využití komplexního protokolu péče o dárce zahrnující hemodynamickou monitoraci systémem PiCCO (včetně sledování extravaskulární plicní vody) současně s prováděním recruitment manévrů zlepšilo prezervaci plic a umožnilo zvýšení četnosti jejich odběru pro potřeby transplantace [31]. Spíše než specifické práce v oblasti péče o dárce orgánů můžeme ale stran hledání optimální cévní náplně zohlednit aktuální požadavky na tekutinovou terapii v běžné intenzivní péči [32].
Adekvátní centrální volemie bohužel není většinou dostatečná k dosažení požadovaných perfuzních tlaků a 80–90 % dárců se smrtí mozku vyžaduje podporu vazoaktivními látkami [33]. Stejně jako v ostatních stavech spojených se snížením systémové vaskulární rezistence je lékem volby u dospělých podání noradrenalinu. Užití dopaminu v rámci podpory hemodynamiky u dárců orgánů bylo historicky velmi přeceňované, nicméně předpokládaný pozitivní efekt na splanchnickou perfuzi byl již vyvrácen [34]. Strategii užití katecholaminů spíše řídíme podle aktuálního klinického obrazu a léčebné odpovědi. Při zvažování dárcovství srdce je obecným pravidlem dosažení euvolemie s optimálním srdečním výdejem při minimálních dávkách betaadrenergní podpory. V případě nutnosti vysoko dávkované oběhové podpory je možné rozšířit léčbu o podání vazopresinu/argipresinu (rychlostí 0,2–0,4 IU/hod) [35]. Užití běžněji dostupného vasopresinového analogu terlipresinu není s ohledem na větší riziko splanchnické hypoperfuze, protrahovaný účinek a špatnou řiditelnost vhodné. Podávání tzv. „stresové dávky“ kortikosteroidů (200 mg hydrokortizonu/den, lépe v kontinuální infuzi) může podle některých autorů přispět k oběhové stabilizaci nemocného [19, 20, 36, 37]. V současnosti není explicitně definována hodnota dávky oběhové podpory, která by byla kontraindikací k dárcovství srdce, nicméně je známo, že vysoká potřeba noradrenalinu je spojena s horší prognózou provedené transplantace srdce [38].
Hormonální změny
Nitrolební hypertenze a ischemické poškození hypotalamo-hypofyzárního systému vede k poškození základních endokrinních regulačních mechanismů. Deplece antidiuretického hormonu (ADH) v souvislosti se zánikem funkce zadního laloku hypofýzy v souvislosti se smrtí mozku je přítomna ve více než 90 % případů [39, 40] a je patofyziologickou podstatou rozvinutého DI. Ten je charakterizován polyurií (> 300 ml/hod), hypernatrémií a močovou hypoosmolalitou. Přítomná polyurie může přispívat k hypovolemii a nepřímo i k orgánovému poškození. Velmi sporné jsou údaje o negativním dopadu hypernatrémie na funkci jaterního transplantátu [41]. K prostému zvládnutí DI a polyurie je výhodné včasné nasazení desmopresinu (v iniciální dávce 60 μg sublinguálně) díky jeho preferenčnímu působení na úrovni V2 receptoru s dominantním antidiuretickým účinkem. Je nutno zmínit, že podání desmopresinu ulehčí péči o vnitřní prostředí a volemii dárce, ale jeho rutinní podání není nutně spojeno se zlepšením funkce transplantované ledviny [42]. Substituce intravenózně podanými analogy vasopresinu přispívá k udržení sérové osmolality a zvládnutí polyurie a současně přispívá ke snížení potřeby dávky vazopresorů [34, 35]. Na druhou stranu využití jejich vysokých dávek může způsobovat nadměrnou splanchnickou vazokonstrikci s poškozením cílových orgánů [43].
S postižením předního laloku hypofýzy dochází k narušení adrenokortikální osy, jejímž důsledkem je pokles sérových hladin kortizolu. Stejně tak je narušena i regulace sekrece thyroideálních hormonů. S přihlédnutím k cévnímu zásobení přední části hypofýzy z karotického povodí může být funkce předního laloku hypofýzy v různé míře zachována [44].
Thyroideální změny v případě smrti mozku odpovídají v různé míře vyjádřenému „euthyroid sick syndromu“, jsou provázeny poklesem hladin volného T3, v menší míře pak volného T4 [45]. Na zvířecích modelech smrti mozku je tento pokles spojen s posunem směrem k anaerobnímu metabolismu v myokardu a s tím spojeným kardiodepresivním účinkem vedoucím k oběhové nestabilitě [46, 47]. U zvířecího modelu došlo po podání T3 ke zvrácení této metabolické odchylky k normálnímu aerobnímu metabolismu [46]. Tato zjištění jsou podkladem dlouhodobých diskusí nad suplementací T3 u potenciálních dárců orgánů se smrtí mozku, nicméně toto téma je i nadále kontroverzní. Metaanalýza placebem kontrolovaných studií neprokázala v tomto ohledu pozitivní vliv [48]. Z dostupných dat lze konstatovat, že substituci thyroideálních hormonů lze zvážit u potenciálních dárců srdce se zhoršeným hemodynamickým stavem [36]. Doporučované intravenózní dávky substituce jsou v případě prokázané smrti mozku při použití trijodthyroninu 3 mcg/hod v kontinuální infuzi [19, 36]. Dostupnost intravenózních forem T-hormonů je v České republice velmi omezená. Doporučené dávkování parenterálního levythyroxinu při využití u dárců s mozkovou smrtí je bolusové podání 20 mcg s následnou infuzí 10 mcg/hod [19]. Podání enterálních přípravků je vysoce nespolehlivé z hlediska dosažených sérových koncentrací a nejsou dostupné žádné literární prameny doporučující tento postup.
Podávání kortikosteroidů u dárců se smrtí mozku je podobně kontroverzní téma. V podmínkách České republiky je rutinou podávání metylprednisolonu u dárců plic bezprostředně před odběrem po dohodě s týmem odebírajících chirurgů. Terapeutickým cílem v tomto případě není substituční léčba hypokortikalismu, ale zmírnění dopadů inflamatorní bouře nastalé po smrti mozku a minimalizace ischemicko-reperfuzního poškození štěpu. V klinickém užití vedlo podání kortikoidu ke snížení imunitní aktivace, snížení exprese cytokinů ve štěpu [49, 50] a ke snížení potřeby katecholaminů před vlastním odběrem [20]. U dárců plic byl v prospektivní práci prokázán efekt na redukci extravaskulární plicní tekutiny [28]. Klinický dopad snížení zánětové odpovědi na vlastní výsledek transplantace je ale pravděpodobně minimální. V prospektivní studii německých autorů podání kortikosteroidu dárcům se smrtí mozku nevedlo k signifikantnímu rozdílu v opoždění nástupu funkce štěpu či v incidenci časného selhání štěpu [51]. Ani výsledky recentní studie CORTICOME [37] nesvědčí pro významný vliv rutinního podání suplementační dávky hydrokortizonu na funkci transplantátu, byť autoři práce tuto praxi doporučují jako součást péče o hemodynamicky nestabilní dárce. Z poslední systematické analýzy randomizovaných kontrolovaných a observačních studií nevyplývá jasný benefit pro příjemce, a proto nelze plošně doporučit podávání kortikosteroidů u dárců orgánů [52].
Smrt mozku běžně provází hyperglykemie. Mechanismus jejího vzniku je multifaktoriální s podílem stresové situace, periferní inzulinové rezistence, poklesu sekrece inzulinu a podávání roztoků s obsahem glukózy. Hyperglykemie u dárce orgánů není spolehlivým ukazatelem funkce beta buněk a nesouvisí s morfologickými změnami pankreatu. Nově vzniklá hyperglykemie provázející smrt mozku není kontraindikací dárcovství [19] pankreatu. V současnosti není dostatek dat podporujících těsnou kontrolu glykemie u dárců orgánů, práce britských autorů navrhuje cílovou glykemii při léčbě inzulinem 6–8 mmol/l [20], naproti tomu americká doporučení nabízejí poněkud benevolentnější rozpětí do hodnot 10 mmol/l [53].
Hypotermie
Ztráta hypotalamické termoregulace v důsledku smrti mozku, systémová vazodilatace v souvislosti se ztrátou sympatického tonu a pokles tkáňové metabolické aktivity, podávání neohřívaných infuzí spolu s tepelnými ztrátami vedou k neschopnosti udržení teploty tělesného jádra ve fyziologickém rozmezí s následnou hypotermií. Důsledkem hypotermie je nežádoucí kardiální dysfunkce, arytmie, mikrocirkulační změny či koagulopatie. Doposud bylo doporučováno udržování tělesné teploty > 35 °C s použitím podávání ohřívaných infuzních roztoků, ohřívání vdechovaného vzduchu a externího zahřívání [20, 36]. Recentně publikovaná randomizovaná studie [54] ukázala protektivní vliv mírné hypotermie (34–35 °C) dosažené po potvrzení diagnózy smrti mozku na rozvoj funkce transplantované ledviny ve smyslu dramatického snížení výskytu opožděného nástupu funkce štěpu oproti udržování normotermie (36,5–37,5 °C). Tato studie vyřazovala potenciální dárce nitrohrudních orgánů z obavy kardiodepresivního efektu hypotermie, hemodynamicky nestabilní dárce a dárce s koagulopatií či významnou trombocytopenií, tudíž její závěry nelze přenést na celou populaci dárců. Pro rutinní provádění teplotního managementu nicméně nejsou dostatečná data. U hemodynamicky stabilních dárců ledvin a jater jinak kontraindikovaných k odběru srdce a plic lze na základě uvedené práce zvážit intervenci ve smyslu hypotermie po potvrzení diagnózy smrti mozku.
Ventilace
Příčinou alterace plicních funkcí může být u dárců orgánů se smrtí mozku přímé poranění, barotrauma, aspirace, ventilátorová pneumonie, kongesce plic či poškození v rámci systémové zánětlivé odpovědi. Standardní kritéria dárcovství plic zahrnují věk < 55 let, normální nález na snímku hrudníku, negativní anamnézu stran aspirace, kuřáckou anamnézu s < 20 pack-years, absenci traumatu hrudníku či kardiopulmonální operace v anamnéze, poměr paO2/FiO2 > 300 mmHg při PEEP 5 cm H2O a absenci purulentní sekrece při odsávání nebo při bronchoskopii [55]. Překročení jednoho či více klinických kritérií však nevylučuje nemocného z dárcovství plic a adekvátní péčí lze dosáhnout uspokojivých výsledků i u dárců při nedodržení těchto standardních kritérií [56]. Atelektázy a tekutinové přetížení jsou hlavní zvratitelné příčiny hypoxemie stojící za netransplantabilitou plic [57].
V souladu s trendy obecné intenzivní medicíny ukázala multicentrická studie italských autorů benefit z protektivních ventilačních režimů s dechovými objemy 6–8 ml/kg optimální tělesné hmotnosti a PEEP 8–10 cm H2O oproti konvenční strategii s vyššími dechovými objemy a nižším PEEP [58]. Aplikace protokolu kombinujícího protektivní ventilační režim s poměrně agresivní snahou o zlepšení vzdušnosti plic (bronchoskopické sanace, otevírací manévry) a nehemodynamické péče v recentní španělské multicentrické studii umožnila zdvojnásobit počet odebraných plic bez alterace jejich kvality (tab. 5) [31].
Tab. 5. Protokol péče o dárce plic se smrtí mozku ve studii Miñambres E., et al. [31] ![Protokol péče o dárce plic se smrtí mozku ve studii Miñambres E., et al. [31]](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/e1a525756d3d6be1b32c8b5f3b74c31b.png)
PICCO – Pulse Contour Cardiac Output DÁRCOVSTVÍ U PACIENTŮ NA MIMOTĚLNÍ MEMBRÁNOVÉ OXYGENACI
V současnosti v intenzivní péči sledujeme nárůst využití extrakorporální membránové oxygenace (ECMO) u pacientů s respiračním či kardiorespiračním selháním. Dárcovství orgánů při využití této léčebné modality je možné, nicméně zkušenost je založená na jednotlivých kazuistikách, či v lepším případě na kazuistických sériích [59]. V případě klinického obrazu mozkové smrti se zásady péče o potenciálního dárce významněji neliší od nemocných bez ECMO podpory. V rámci diagnostiky smrti mozku je nutné postupovat dle platných předpisů. K provedení apnoického testu neexistují platná doporučení, dostupné práce v tomto ohledu postupují dle různých protokolů nastavení oxygenátoru [60]. V našich podmínkách legislativa připouští klinickou diagnostiku bez apnoického testu prováděného standardním způsobem v případech, kdy apnoický test standardní cestou nelze provést, tedy mj. i v situaci pacientů na ECMO.
ZÁVĚR
Orgánové transplantace přinášejí příjemcům významné zlepšení kvality života a u některých typů transplantací představují i život zachraňující výkon. Včasné pomýšlení na možnost dárcovství orgánů s důslednou péčí o dárce na jednotce intenzivní péče může vést k vyšší dostupnosti orgánů v rámci transplantačního programu. Poskytnutí kvalitní intenzivní péče ve smyslu protektivní ventilace a hemodynamické stabilizace představuje hlavní léčebný cíl péče o případného dárce orgánů. Abychom dosáhli těchto cílů, můžeme u některých pacientů přistoupit k rozšíření péče o hormonální substituci či jiné postupy s potenciálem zlepšení záchovy orgánů určených k transplantaci.
Práce je původní, nebyla publikována ani není zaslána k recenznímu řízení do jiného média.
Autoři prohlašují, že nemají střet zájmů v souvislosti s tématem práce.
Oba autoři se podíleli na vzniku textu, výsledný rukopis četli, souhlasí s jeho zněním a zasláním do redakce časopisu Anesteziologie a intenzivní medicína.
Poděkování: Práce vznikala za finanční podpory z Národního programu udržitelnosti I (NPU I) č. LO1503 poskytovaného Ministerstvem školství, mládeže a tělovýchovy a z Programu rozvoje vědních oborů Univerzity Karlovy (PROGRES Q39).
Do redakce došlo dne 5. 9. 2017.
Do tisku přijato dne 4. 1. 2018.
Adresa pro korespondenci:
MUDr. Lukáš Kielberger, Ph.D.
E-mail: kielbergerl@fnplzen.cz
Zdroje
1. Valentová Bartáková L, Fila L, Šimonek J, Lischke R. Transplantace plic v České republice. Postgraduální medicína. 2014;16 : 191–200.
2. Zákon 44/2013, kterým se mění zákon č. 285/2002 Sb., o darování, odběrech a transplantacích tkání a orgánů a o změně některých zákonů (transplantační zákon), ve znění pozdějších předpisů, a další související zákony. In: Sbírka zákonů. 25. 2. 2013, částka 19. Dostupný z http://www.psp.cz/sqw/sbirka.sqw?cz=44&r=2013
3. Vyhláška Ministerstva zdravotnictví ČR 115/2013 Sb., Vyhláška o stanovení specializované způsobilosti lékařů zjišťujících smrt a lékařů provádějících vyšetření potvrzující nevratnost smrti pro účely odběru tkání nebo orgánů určených pro transplantaci. In: Sbírka zákonů. 7. 5. 2013, částka 51, dostupné z http://www.psp.cz/sqw/sbirka.sqw?cz=115&r=2013
4. Vyhláška Ministerstva zdravotnictví ČR 114/2013 Sb. Vyhláška o stanovení bližších podmínek posuzování zdravotní způsobilosti a rozsahu vyšetření žijícího nebo zemřelého dárce tkání nebo orgánů pro účely transplantací (vyhláška o zdravotní způsobilosti dárce tkání a orgánů pro účely transplantací). In: Sbírka zákonů. 7. 5. 2013, částka 51, dostupné z https://www.psp.cz/sqw/sbirka.sqw?cz=114&r=2013
5. Sözen H, Fidan K, Mahli A, et al. Successful solid organ transplantation from septicemic cadaveric donors: case report. Transplant Proc. 2008;40 : 299–301.
6. Nalesnik MA, Woodle ES, Dimaio JM, et al. Donor-transmitted malignancies in organ transplantation: assessment of clinical risk. Am J Transplant. 2011;11 : 1140–1147.
7. Ison MG, Hager J, Blumberg E, et al. Donor-derived disease transmission events in the United States: data reviewed by the OPTN/UNOS Disease Transmission Advisory Committee. Am J Transplant. 2009;9 : 1929–1935.
8. Kauffman HM, Cherikh WS, McBride MA, Cheng Y, Hanto DW. Deceased donors with a past history of malignancy: An organ procurement and transplantation network/united network for organ sharing update. Transplantation. 2007;84 : 272–274.
9. Feng S, Buell JF, Chari RS, DiMaio JM, Hanto DW. Tumors and transplantation: The 2003 third annual ASTS stateof-the-art winter symposium. Am J Transplant. 2003;3 : 148–1487.
10. Edge SB, Byrd DR, Compton CC, Fritz AG, Greene FL, Trotti III A, eds. AJCC cancer staging manual. 7th Ed: Springer: New York, 2010.
11. Wijdicks EF, Varelas PN, Gronseth GS, et al. Evidence-based guideline update: determining brain death in adults: report of the Quality Standards Subcommittee of the American Academy of Neurology. Neurology. 2010;74 : 1911–1918.
12. Lévesque S, Lessard MR, Nicole PC, et al. Efficacy of a T-piece system and a continuous positive airway pressure system for apnea testing in the diagnosis of brain death. Crit Care Med. 2006;34 : 2213–2216.
13. Hüttemann E, Schelenz C, Sakka SG, Reinhart K. Atropine test and circulatory arrest in the fossa posterior assessed by transcranial Doppler. Intensive Care Med. 2000;26 : 422–425.
14. Díaz-Regañón G, Miñambres E, Holanda M, et al. Usefulness of venous oxygen saturation in the jugular bulb for the diagnosis of brain death: report of 118 patients. Intensive Care Med. 2002;28 : 1724–1728.
15. Young GB. Diagnosis of brain death. In: UpToDate, Post TW (Ed), UpToDate, Waltham, MA. Dostupné z http://www.uptodate.com/contents/diagnosis-of-brain-death#H3 ; 4. 1. 2016.
16. Chisholm N, Gillett G. The patient‘s journey: living with locked-in syndrome. BMJ. 2005;331 : 94–97.
17. Bugge JF. Brain death and its implications for management of the potential organ donor. Acta Anaesthesiol Scand. 2009;53 : 1239–1250.
18. Dare AJ, Bartlett AS, Fraser JF. Critical care of the potential organ donor. Curr Neurol Neurosci Rep. 2012;12 : 456–465.
19. Wood KE, Becker BN, McCartney JG, D'Alessandro AM, Coursin DB. Care of the potential organ donor. N Engl J Med. 2004;351 : 2730–2739.
20. McKeown DW, Bonser RS, Kellum JA. Management of the heartbeating brain-dead organ donor. Br J Anaesth. 2012;108 Suppl 1:i96–107.
21. Demetriades D, Lam L. Assessment, Monitoring, and Management of Brain-Dead Potential Organ Donors in the USA. In: Novitzky D., Cooper D. (eds.). The Brain-Dead Organ Donor. Springer: New York, 2013.
22. Novitzky D, Rhodin J, Cooper DK, et al. Ultrastructure changes associated with brain death in the human donor heart. Transpl Int. 1997;10 : 24–32.
23. Boland TA, Lee VH, Bleck TP. Stress-induced cardiomyopathy. Crit Care Med. 2015;43 : 686–693.
24. Dujardin KS, McCully RB, Wijdicks EF, et al. Myocardial dysfunction associated with brain death: clinical, echocardiographic, and pathologic features. J Heart Lung Transplant. 2001;20 : 350–7.
25. Shivalkar B, Van Loon J, Wieland W, et al. Variable effects of explosive or gradual increase of intracranial pressure on myocardial structure and function. Circulation. 1993;87 : 230–239.
26. Cittanova ML, Leblanc I, Legendre C, et al. Effect of hydroxyethylstarch in brain-dead kidney donors on renal function in kidney-transplant recipients. Lancet. 1996;348 : 1620–1622.
27. Patel MS, Niemann CU, Sally MB, et al. The Impact of Hydroxyethyl Starch Use in Deceased Organ Donors on the Development of Delayed Graft Function in Kidney Transplant Recipients: A Propensity-Adjusted Analysis. Am J Transplant. 2015;15 : 2152–2158.
28. Venkateswaran RV, Patchell VB, Wilson IC, et al. Early donor management increases the retrieval rate of lungs for transplantation. Ann Thorac Surg. 2008;85 : 278–286.
29. Miñambres E, Rodrigo E, Ballesteros MA, et al. Impact of restrictive fluid balance focused to increase lung procurement on renal function after kidney transplantation. Nephrol Dial Transplant. 2010;25 : 2352–2356.
30. Al-Khafaji A, Elder M, Lebovitz DJ, et al. Protocolized fluid therapy in brain-dead donors: the multicenter randomized MOnIToR trial. Intensive Care Med. 2015;41 : 418–426.
31. Miñambres E, Pérez-Villares JM, Chico-Fernández M, et al. Lung donor treatment protocol in brain dead-donors: A multicenter study. J Heart Lung Transplant. 2015;34 : 773–780.
32. Beneš J. Tekutinová terapie v intenzivní péči. Anest intenziv Med. 2016;27 : 107–115.
33. Wood KE, Coursin DB. Intensivists and organ donor management. Curr Opin Anaesthesiol. 2007;20 : 97–99.
34. De Backer D, Biston P, Devriendt J, et al. Comparison of dopamine and norepinephrine in the treatment of shock. N Engl J Med. 2010;362 : 779–789.
35. Callahan DS, Neville A, Bricker S, et al. The effect of arginine vasopressin on organ donor procurement and lung function. J Surg Res. 2014;186 : 452–457
36. Youn TS, Greer DM. Brain death and management of a potential organ donor in the intensive care unit. Crit Care Clin. 2014;30 : 813–831.
37. Pinsard M, Ragot S, Mertes PM, et al. Interest of low-dose hydrocortisone therapy during brain-dead organ donor resuscitation: the CORTICOME study. Crit Care. 2014;18:R158.
38. Stehlik J, Feldman DS, Brown RN, et al. Cardiac Transplant Research Database Group. Interactions among donor characteristics influence post-transplant survival: a multi-institutional analysis. J Heart Lung Transplant. 2010;29 : 291–298.
39. Novitzsky D, Cooper D, Rosendale J, Kauffman H. Hormonal therapy of the brain-dead organ donor: experimental and clinical studies. Transplantation. 2006;82 : 1396–1401.
40. Dictus C, Vienenkoetter B, Esmaeilzadeh M, Unterberg A, Ahmadi R. Critical care management of potential organ donors: our current standard. Clin Transplant. 2009;23,Suppl 21 : 2–9.
41. Totsuka E, Dodson F, Urakami A, et al. Influence of high donor serum sodium levels on early postoperative graft function in human liver transplantation: effect of correction of donor hypernatremia. Liver Transpl Surg. 1999;5 : 421–428.
42. Rech TH, Moraes RB, Crispim D, Czepielewski MA, Leitão CB. Management of the brain-dead organ donor: a systematic review and meta-analysis. Transplantation. 2013;95 : 966–974.
43. Holmes CL, Patel BM, Russell JA, Walley KR. Physiology of vasopressin relevant to management of septic shock. Chest. 2001;120 : 989–1002.
44. Tien RD. Sequence of enhancement of various portions of the pituitary gland on gadolinium-enhanced MR images: correlation with regional blood supply. AJR: Am J Roentgenol. 1992;158 : 651–654.
45. Nair-Collins M, Northrup J, Olcese J. Hypothalamic-Pituitary Function in Brain Death: A Review. J Intensive Care Med. 2016;31 : 41–50.
46. Novitzky D, Cooper DKC, Morrell D, Isaacs S. Change from aerobic to anaerobic metabolism after brain death, and reversal following triiodothyronine (T3) therapy. Transplantation. 1988;45 : 32–36.
47. Novitzky D, Cooper DK, Reichart B. Hemodynamic and metabolic responses to hormonal therapy in brain-dead potential organ donors. Transplantation. 1987;43 : 852–854.
48. Macdonald PS, Aneman A, Bhonagiri D, et al. A systematic review and meta-analysis of clinical trials of thyroid hormone administration to brain dead potential organ donors. Crit Care Med. 2012;40 : 1635–1644.
49. Kuecuek O, Mantouvalou L, Klemz R, et al. Significant reduction of proinflammatory cytokines by treatment of the brain-dead donor. Transplant Proc. 2005;37 : 387–388.
50. Kotsch K, Ulrich F, Reutzel-Selke A et al. Methylprednisolone therapy in deceased donors reduces inflammation in the donor liver and improves outcome after liver transplantation: a prospective randomized controlled trial. Ann Surg. 2008;248 : 1042–1050.
51. Kainz A, Wilflingseder J, Mitterbauer C, et al. Steroid pretreatment of organ donors to prevent postischemic renal allograft failure: a randomized, controlled trial. Ann Intern Med. 2010;153 : 222–230.
52. Dupuis S, Amiel JA, Desgroseilliers M, et al. Corticosteroids in the management of brain-dead potential organ donors: a systematic review. Br J Anaesth. 2014;113 : 346–359.
53. United Network for Organ Sharing. Critical pathway for the organ donor. Dostupné z www.unos.orgorg/wp-content/uploads/unos/Critical_Pathway.pdf. 15. 6. 2017.
54. Niemann CU, Feiner J, Swain S, el al. Therapeutic Hypothermia in Deceased Organ Donors and Kidney-Graft Function. N Engl J Med. 2015;373 : 405–414.
55. Bhorade, SM, Vigneswaran, W, McCabe, MA, Garrity, ER. Liberalization of donor criteria may expand the donor pool without adverse consequence in lung transplantation. J Heart Lung Transplant. 2000;19 : 1199.
56. Pêgo-Fernandes PM, Samano MN, Fiorelli AI, et al. Recommendations for the use of extended criteria donors in lung transplantation Transplant Proc. 2011;43 : 216–219.
57. Reilly PM, Grossman MD, Rosengard BR, et al. Lung procurement from solid organ donors: role of fluid resuscitation in procurement failures. Chest. 1996;110 : 222S.
58. Mascia L, Pasero D, Slutsky AS, et al. Effect of a lung protective strategy for organ donors on eligibility and availability of lungs for transplantation: a randomized controlled trial. JAMA. 2010;304 : 2620–2627.
59. Migliaccio ML, Zagli G, Cianchi G, et al. Extracorporeal membrane oxygenation in brain-death organ and tissues donors: a single-centre experience. Br J Anaesth. 2013;111 : 673–674.
60. Shah V, Lazaridis C. Apnea testing on extracorporeal membrane oxygenation: Case report and literature review. J Crit Care. 2015;30 : 784–786.
Štítky
Anestéziológia a resuscitácia Intenzívna medicína
Článok vyšiel v časopiseAnesteziologie a intenzivní medicína
Najčítanejšie tento týždeň
2018 Číslo 1- Realita liečby bolesti v paliatívnej starostlivosti v Nemecku
- MUDr. Lenka Klimešová: Multiodborová vizita je kľúč k efektívnejšej perioperačnej liečbe chronickej bolesti
- Metamizol v liečbe pooperačnej bolesti u opioid-tolerantnej pacientky – kazuistika
- e-Konzilium.cz — Masivní plicní embolie při tromboembolické nemoci
- DESATORO PRE PRAX: Aktuálne odporúčanie ESPEN pre nutričný manažment u pacientov s COVID-19
-
Všetky články tohto čísla
- Anesteziologická léčba při spinálním traumatu
- Perioperační poranění myokardu: naše vina, nebo zánět?
- Vybrané aspekty péče o dárce orgánů s mozkovou smrtí
- Vztah variability srdeční frekvence a perioperační systémové zánětlivé odpovědi
- VAS a opioidní krize v USA
- Perioperační infuzní léčba
- Migrenici/migreničky a expozice světlu jako algeziologické téma
- Anestezie rostlin – cesta k poznání mechanismů účinku anestetik u člověka?
- Jsou sestry ohrožovány profesionálně používanými dezinficiencii?
- Doporučení pro bezpečné bolusové podávání vazopresorů na oddělení akutního příjmu
- Je nebulizovaný 3% hypertonický roztok NaCl účinný při bronchiolitidě malých dětí?
- Doporučení American Society for Enhanced Recovery a Perioperative Quality Initiative pro prevenci a léčbu pooperační gastrointestinální dysfunkce (POGD) při elektivních kolorektálních operacích
- Stanovisko výboru ČSARIM k používání pojmu „vitální indikace“ při poskytování anesteziologické péče
-
Anestezie v Rakousko-Uhersku během I. světové války a po vzniku samostatného československého státu
Část IV – Celková anestezie I - Zajímavosti, tipy a triky
-
Abstrakty z XXIV. kongresu ČSARIM
Brno, 7.–9. 9. 2017
- Anesteziologie a intenzivní medicína
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Perioperační infuzní léčba
- Vybrané aspekty péče o dárce orgánů s mozkovou smrtí
- Je nebulizovaný 3% hypertonický roztok NaCl účinný při bronchiolitidě malých dětí?
- Doporučení pro bezpečné bolusové podávání vazopresorů na oddělení akutního příjmu
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



