-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Sedace kombinací dexmedetomidin-ketamin- midazolam pro endovaskulární léčbu mozkových arteri ovenózních malformací a stenóz karotických tepen
Dexmedetomidine - Ketamine - Midazolam Combinati on for Sedati on in Endovascular Tre atment of Cerebral Arteri o - Veno us Malformati ons and Carotid Artery Stenosis
Backgro und:
Immobility, analgesi a, anxi olysis, amnesi a, preserved pati ent co operati on and hemodynamic stability witho ut respiratory depressi on are the requirements for sedati on in endovascular tre atment of cerebral arteri oveno us malformati ons and carotid artery stenting. The go al of o ur study was to assess dexmedetomidine - ketamine - midazolam sedati on for this use and compare it with ro utine sufentanil - midazolam sedati on.Methods:
62 pati ents undergo ing elective endovascular ne uro - interventi ons were randomly divided into two gro ups for sedati on. Gro up A: intraveno us bolus applicati on of dexmedetomidine 0.5 µg/ kg, ketamine 0.25 mg/ kg and midazolam 0.02 mg/ kg during five minutes followed by infusi on of dexmedetomidine 0.25 µg/ kg/ h and ketamine 0.25 mg/ kg/ h. Gro up B: bolus applicati on of sufentanil 10 µg and midazolam 0.02 mg/ kg. Sedati on was then titrated to keep the pati ent sedated, but responsive to vocal commands. Parameters which were monitored: blo od pressure, ECG, haemoglobin saturati on, respiratory rate, arteri al carbon di oxide tensi on, depth of sedati on, side effects, complicati ons and recovery. Pati ent co operati on (excellent - suffici ent - po or) was assessed by the radi ologist, who was blind to the method used. Statistical analysis: t - test, χ2 test, ANOVA.Results:
Decre ases of blo od pressure and he art rate were significantly more marked in gro up A (p < 0.001), tho ugh the number of episodes of hypotensi on or bradycardi a did not differ significantly. Vari ability of blo od pressure within individu al pati ents was lower in gro up A (p < 0.05). Co operati on was better in gro up A (p < 0.001). No other statistically significant differences were fo und. No clinically significant complicati ons were recorded.Conclusi on:
Sedati on by dexmedetomidine-ketamin - midazolam combinati on seems to be a safe and suitable method for endovascular ne uro - interventi ons. It secures very go od co operati on with the pati ent and hemodynamic stability witho ut respiratory depressi on.Key words:
endovascular ne uro - interventi ons – sedati on – dexmedetomidine - ketamine - midazolam combinati on
Autoři: J. Schreiberová 1; L. Hess 2; A. Krajina 3; Miroslav Lojík 3
Působiště autorů: Klinika anestezi ologi e, resuscitace a intenzivní medicíny LF UK a FN Hradec Králové 1; Institut klinické a experimentální medicíny Praha, IPVZ Praha 2; Radi ologická klinika LF UK a FN Hradec Králové 3
Vyšlo v časopise: Cesk Slov Neurol N 2008; 71/104(4): 446-452
Kategorie: Původní práce
Studie byla podpořena grantem IGA MZ ČR č. NR 8508-3
Souhrn
Úvod:
Nehybnost, analgezi e, anxi olýza, amnézi e, zachovaná spolupráce s nemocným a hemodynamická stabilita bez útlumu dýchání jso u požadavky na sedaci pro endovaskulární léčbu mozkových arteri ovenózních malformací a stenóz krkavice. Cílem studi e bylo zhodnotit sedaci kombinací dexmedetomidin‑ketamin‑midazolam k tomuto užití a porovnat ji s běžno u sedací kombinací sufentanil-midazolam.Metodika:
62 paci enti indikovaných k elektivní endovaskulární léčbě byli randomizováni k sedaci do dvo u skupin. Skupina A: bolusové intravenózní podání dexmedetomidinu 0,5 µg/ kg, ketaminu 0,25 mg/ kg a midazolamu 0,02 mg/ kg během pěti minut, následované kontinuální infuzí dexmedetomidinu 0,25 µg/ kg/ hod a ketaminu 0,25 mg/ kg/ hod. Skupina B: bolusové podání sufentanilu 10 µg a midazolamu 0,02 mg/ kg. Sedace byla následně titrována tak, aby byl paci ent sedován, ale re agoval na slovní výzvu. Sledované parametry: systémový krevní tlak, EKG křivka, saturace hemoglobinu kyslíkem, dechová frekvence, arteri ální tenze oxidu uhličitého, hlo ubka sedace, nežádo ucí účinky, komplikace, zotavení. Spolupráci s nemocným (výborná/ dostačující/ špatná) hodnotil radi olog neznalý užité metody sedace. Statistická analýza: t-test, χ2 test, ANOVA.Výsledky:
Pokles krevního tlaku a srdeční frekvence byl signifikantně větší ve skupině A (p < 0,001), ačkoliv počet epizod hypotenze či bradykardi e se významně nelišil. Hodnoty krevního tlaku vykazovaly menší intraindividuální vari abilitu ve skupině A (p < 0,05). Spolupráce s nemocným byla lepší ve skupině A (p < 0,001). Další statisticky významné rozdíly nebyly nalezeny. Nevyskytly se klinicky závažné komplikace.Závěr:
Sedace kombinací dexmedetomidin‑ketamin‑midazolam je bezpečná a vhodná metoda pro endovaskulární ne uro intervence. Zajišťuje velmi dobro u spolupráci s nemocným, hemodynamicko u stabilitu a netlumí dýchání.Klíčová slova:
endovaskulární ne uro intervence – sedace – kombinace dexmedetomidin - ketamin - midazolamÚvod
Rozvoj endovaskulárních ne uro intervenčních postupů přináší výrazný nárůst počtu výkonů, u kterých je zajištění anestezi ologické péče jedno u z podmínek jejich re alizace. Anestezi olog musí znát povahu jednotlivých výkonů, aby mohl zajistit bezpečnost paci enta a vyhovět požadavkům jak ze strany paci enta, tak výkon provádějícího radi ologa. Ne uro intervenci lze provést v celkové anestezii nebo monitorované sedaci [1]. Výhody a nevýhody obo u postupů shrnuje tab.1 a 2 [2].
Tab. 1. Výhody a nevýhody celkové anestezie. 
Tab. 2. Výhody a nevýhody monitorované sedace. 
Monitorovaná sedace (Monitored Anaesthesi a Care) je technika, která spočívá v systémové aplikaci látek s analgetickým a sedativním účinkem, přičemž jso u adekvátními metodami monitorovány vitální funkce paci enta. Na rozdíl od celkové anestezi e však nedochází ke ztrátě vědomí, paci ent je dle stupně sedace schopen komunikace, je výrazně psychicky uvolněn, zbaven strachu, úzkosti a bolesti, na výkon má amnézii. Při monitorované sedaci dochází k menšímu ovlivnění funkce kardi ovaskulárního systému, zůstává zachována spontánní ventilace a ochranné reflexy dýchacích cest [3]. Monitorovaná sedace je v praxi využívána při endovaskulární léčbě mozkových arteri ovenózních malformací (mAVM) a stenóz karotických tepen (SK) perkutánní angi oplastiko u se zavedením stentu a protekcí vůči embolizaci. Kromě obecného požadavku na motorický klid, hemodynamicko u stabilitu, dostatečno u spontánní ventilaci, sedaci, anxi olýzu a analgezii je nezbytné vyvarovat se systémové hypertenze a zachovat dobrý kontakt s nemocným umožňující ori entačně zhodnotit ne urologický stav a provést funkční ne urologické testy. Ide ální látka k sedaci zatím nebyla nalezena. K monitorované sedaci se využívá kombinace látek se sedativně - hypnoticko - anxi olytickými, analgetickými a sympatolytickými účinky (tab. 3).
Tab. 3. Látky užívané k monitorované sedaci 
Sedace kombinací opi o idů s midazolamem nebo propofolem patří v so učasné době k nejužívanějším. Hlavní nevýhodo u těchto kombinací je riziko vzniku dechové deprese. Proto pokračuje hledání nové kombinace farmak vhodné k monitorované sedaci. Jedním z hlavních kandidátů je agonista alfa2A adrenoreceptoru dexmedetomidin, který je po užíván ke krátkodobé sedaci na jednotkách intenzivní péče [4]. Sedace dexmedetomidinem je charakteristická tím, že nemocný nevyrušován pospává, ale jakmile je aplikován taktilní nebo zvukový podnět, rychle se probo uzí a je schopen re akce a adekvátní komunikace [5,6]. Dexmedetomidin má slabý analgetický účinek, který může být potencován ketaminem [7], a méně výrazný anxi olytický a amnestický účinek než benzodi azepiny [8]. Ačkoliv je dexmedetomidin úspěšně užíván k sedaci při „awake“ krani otomi ích [9], o jeho po užití pro ne uro intervenční výkony jso u po uze kazuistická sdělení [10]. Jako vhodné se jeví doplnění sedace dexmedetomidinem podáním ketaminu (analgetická dávka prohlubující slabý analgetický účinek dexmedetomidinu) a midazolamu (předpokládané prohlo ubení anxi olytického a amnestického účinku). Užití kombinace dexmedetomidin-ketamin - midazolam pro ne uro intervenční výkony nebylo dosud v literatuře uvedeno. Cílem naší studi e bylo poso udit bezpečnost a vhodnost užití sedace kombinací dexmedetomidin‑ketamin‑midazolam pro endovaskulární léčbu mozkových AVM a SK jako alternativy sedace s opi o idní složko u a provést srovnání s rutinní sedací kombinací sufentanilu s midazolamem.
Materi ál a metodika
So ubor
Po obdržení so uhlasu Etické komise Fakultní nemocnice a Lékařské fakulty UK v Hradci Králové bylo do studi e zařazeno 62 paci entů obojího pohlaví ve věku nad 18 let podstupujících elektivní endovaskulární léčbu mozkových AVM nebo SK. Vstupní kritéri a byla: 1. fyzický stav paci enta ASA 1 – 3 (dle klasifikace Americké anestezi ologické společnosti); 2. obdržení informovaného so uhlasu s účastí ve studii. Vylučovací kritéri a byla: 1. vstupní Glasgow Coma Scale (GCS) < 15; 2. nekorigovaná arteri ální hypertenze (TK > 160/ 90 mm Hg); 3. psychické onemocnění v anamnéze; 4. epilepsi e nekorigovaná léčbo u; 5. arytmi e (atri oventrikulární blok II. a III. stupně, sick sinus syndrom, závažné komorové arytmi e); 6. alergi e na jako ukoliv z podávaných látek.
Randomizace
Randomizace paci entů do skupin k sedaci byla provedena obálkovo u metodo u: 1. sedace kombinací dexmedetomidin-ketamin‑midazolam (skupina A); 2. sedace kombinací sufentanil-midazolam (skupina B).
Premedikace, peroperační monitoring a zajištění
45 min před začátkem výkonu byla paci entům podána premedikace – bisulepin (Dithi aden, Léčiva) 2 mg p.o. Na operačním sále byl zaveden periferní žilní katétr (18 G) do kubitální žíly a zahájeno kontinuální podávání fyzi ologického roztoku rychlostí 100 ml/ hod. Do podpažní jamky byl zaveden digitální teploměr. Monitor vitálních funkcí (SC 6002 XL, Si emens) byl užit k monitorování EKG – reprezentativní svod II, saturace hemoglobinu kyslíkem – pulzní oxymetrické čidlo na prstu horní končetiny, dechové frekvence a neinvazivnímu měření tlaku krve oscilometricky manžeto u na horní končetině v intervalu 5 min. Nosními brýlemi byl podáván zvlhčený kyslík průtokem 4 l/ min po celo u dobu výkonu.
Vedení sedace
Skupina A: Indukce sedace byla provedena podáním midazolamu (Dormicum, Roche) v dávce 0,02 mg/ kg intravenózně (i.v.), za 2 min poté dexmedetomidinu (Precedex, Abbott) v dávce 0,5 µg/ kg a po dalších 2 min ketaminu (Narkamon 1%, Spofa) v dávce 0,25 mg/ kg i.v. Navazovalo kontinuální podání dexmedetomidinu (injekční pumpa ID 20/ 50, Chirana) infuzní rychlostí 0,25 µg/ kg/ hod spolu s ketaminem rychlostí 0,25 mg/ kg/ hod. Farmaka byla podávána v jedné injekční stříkačce, 100 µg dexmedetomidinu a 100 mg ketaminu bylo naředěno do 20 ml fyzi ologického roztoku. Rychlost infuze byla přizpůsobována tak, aby byl udržován stupeň sedace 1 – 2 dle Ramsaye (sedovaný nemocný re agující na slovní výzvu). V případě potřeby byla rychlost zvýšena či snížena vždy o 50 % nastavené aktuální rychlosti.
Skupina B: Indukce sedace byla provedena podáním midazolamu v dávce 0,02 mg/ kg i.v. a sufentanilu (Sufenta, Janssen-Cilag) v dávce 10 µg i.v. Navazovalo bolusové podání sufentanilu v jednotlivé dávce 5 µg/ kg i.v. a midazolamu 1 mg i.v. tak, aby byl udržován stupeň sedace 1 – 2 dle Ramsaye.
Sledované parametry
Během výkonu byly sledovány následující parametry: 1. hlo ubka sedace dle Ramsaye (stupeň 0 – 5) hodnocená po 5 min; 2. systolický a di astolický TK (mmHg) měřený po 5 min; 3. srdeční frekvence (SF/ min); 4. saturace hemoglobinu kyslíkem (sat O2 %); 5. dechová frekvence (DF/ min); 6. parci ální tlak oxidu uhličitého v arteri ální krvi (paCO2 [kPa] – jednorázový odběr 30 min po zahájení sedace).
Sledovali a zaznamenávali jsme výskyt (počet) nežádo ucích účinků: 1. bradykardi e (SF < 45/ min); 2. tachykardi e (SF > 100/ min); 3. jiných arytmi í; 4. hypotenze (pokles o více než 20 % výchozích hodnot středního arteri álního TK nebo systolický TK < 90 mmHg); 5. hypertenze (vzestup o více než 30 % výchozích hodnot středního arteri álního TK nebo systolický TK > 160 mmHg); 6. bradypnoe (DF < 10/ min); 7. hypoxi e (sat O2 < 90 %); 8. hyperkapni e (paCO2 > 6 kPa); 9. dalších výše ne uvedených nežádo ucích účinků; 10. podání záchranné („rescue“) medikace (podání jakékoliv medikace nutné k zachování hemodynamické a respirační stability – inotropika, antihypertenziva, anti arytmika, antagonisté podávaných anestetik).
Kvalitu peroperační spolupráce paci enta s radi ologem zhodnotil po ukončení výkonu radi olog neznalý užité metody sedace. Stupnice hodnocení: 1. výborná (nemocný zachovává motorický klid, výzvě vyhoví okamžitě a plně, je zcela ori entován); 2. dostačující (nemocný zachovává motorický klid, výzvě vyhoví s latencí či nepřesně, má zachovánu základní ori entaci); 3. nedostatečná (nemocný motoricky neklidný nebo nevyhoví výzvě nebo dezori entovaný).
Amnézi e na výkon byla zhodnocena paci entem za 1 hod po ukončení výkonu. Stupnice hodnocení: 1. žádná; 2. parci ální; 3. úplná.
Psychomotorické zotavení zhodnotil anestezi olog za 1 hod po ukončení výkonu na základě provedení ori entačního testu, jehož obsahem bylo: 1. taxe prst – nos; 2. ori entace osobo u, místem, časem; 3. jednoduché matematické úkony. Stupnice hodnocení: 1. úplné zotavení – ano; 2. úplné zotavení – ne.
Zaznamenávána byla spotřeba farmak užitých k vedení anestezi e, počet změn rychlosti kontinuální infuze a počet doplňujících bolusových dávek.
Statistická analýza
T - test, chí kvadrát (χ2) test, analýza vari ance (ANOVA) pro opakovaná měření. Pro účely statistického zpracování byla po užita měření získaná u všech výkonů v době od podání sedace do 45. min trvání výkonu (některé výkony skončily již ve 45. min, jiné pokračovaly i po 45. min, měření získaná po 45. min nebyla předmětem statistického zpracování).
Výsledky
Sledované skupiny byly srovnatelné, významné demografické rozdíly nebyly přítomny (tab. 4). Průměrno u spotřebu anestetik během výkonu uvádí tab. 5. Ve skupině A byla měněna rychlost kontinuální infuze u dvo u paci entů v průběhu výkonu jedenkrát, u jednoho paci enta dvakrát, ve všech případech se jednalo o snížení rychlosti. Ve skupině B byly u 10 paci entů podány doplňující bolusové dávky, celkový počet podaných doplňujících bolusů byl 15. Výskyt nežádo ucích účinků (tab. 6) se statisticky významně nelišil. Ve skupině B byl zaznamenán vyšší výskyt nadměrné sedace (u pěti nemocných), statistická významnost nebyla prokázána. Výskyt hypoxi e nebyl zaznamenán. Rescue medikace byla po užita třikrát ve skupině B, jedenkrát se jednalo o korekci hypertenze (Ebrantil 12,5 mg i.v.), jedenkrát bradykardi e (Atropin 0,5 mg i.v.) a jedenkrát hypotenze (Efedrin 10 mg i.v.). Nevyskytly se klinicky závažné komplikace vyžadující ukončení nebo přerušení výkonu. Systolický tlak (tab. 7) a di astolický tlak (tab. 8) se během výkonu snížil více ve sledované skupině A (p < 0,001) než ve skupině B. Hodnoty systolického i di astolického tlaku měly menší intraindividuální vari abilitu (p < 0,05) ve skupině A než skupině B. Srdeční frekvence (tab. 9) se snížila více ve skupině A (p < 0,001) než B, intraindividuální vari abilita se statisticky významně nelišila. Saturace hemoglobinu kyslíkem (tab. 10) se nelišila. Spolupráce s nemocným (tab. 11) byla signifikantně lepší ve skupině A (p < 0,001). Výskyt amnézi e (tab. 12) se signifikantně nelišil mezi skupinami. U všech paci entů bylo zaznamenáno úplné psychomotorické zotavení po jedné hod od ukončení výkonu (tab. 6). Psychomimetické účinky se nevyskytly v průběhu výkonu ani po jeho ukončení.
Tab. 4. Charakteristika souboru. 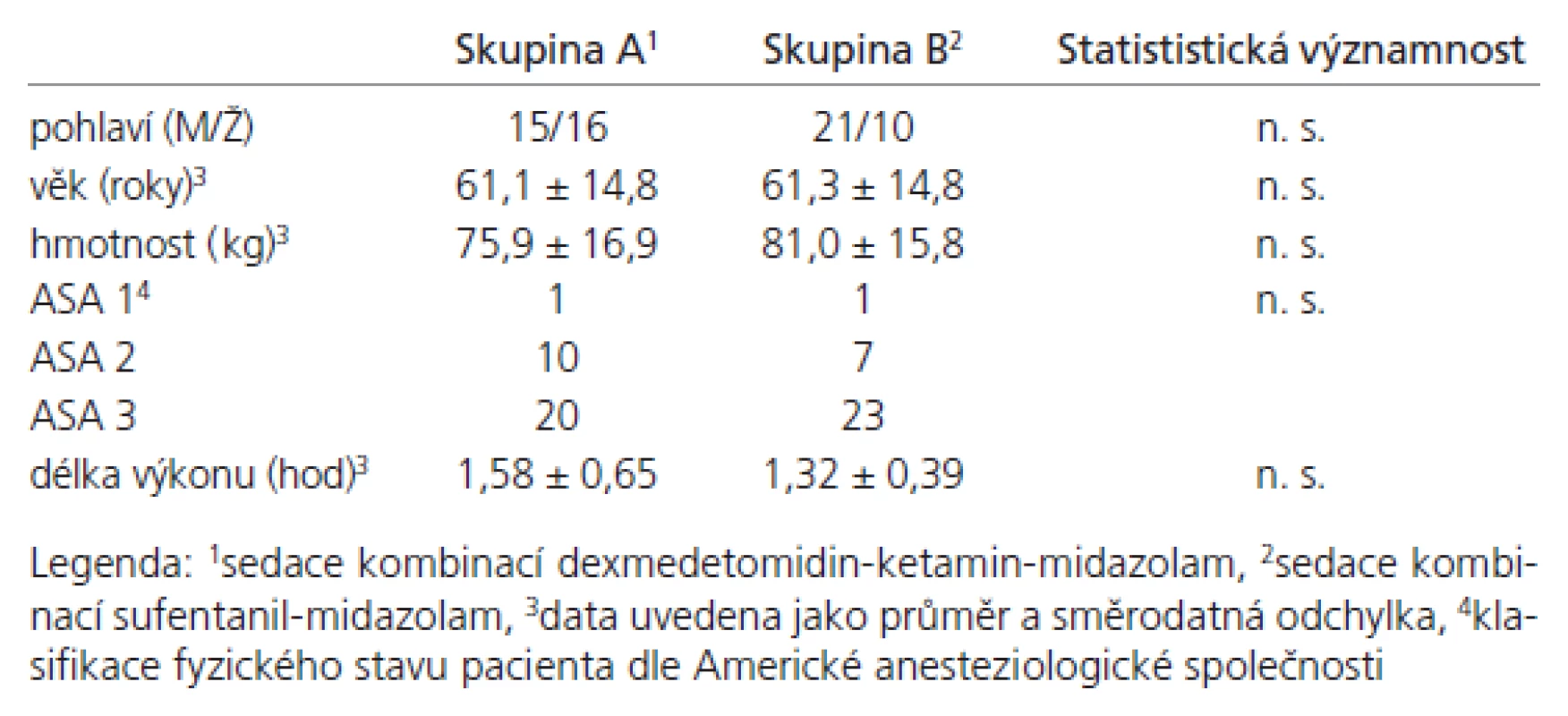
Tab. 6. Výskyt nežádoucích účinků. 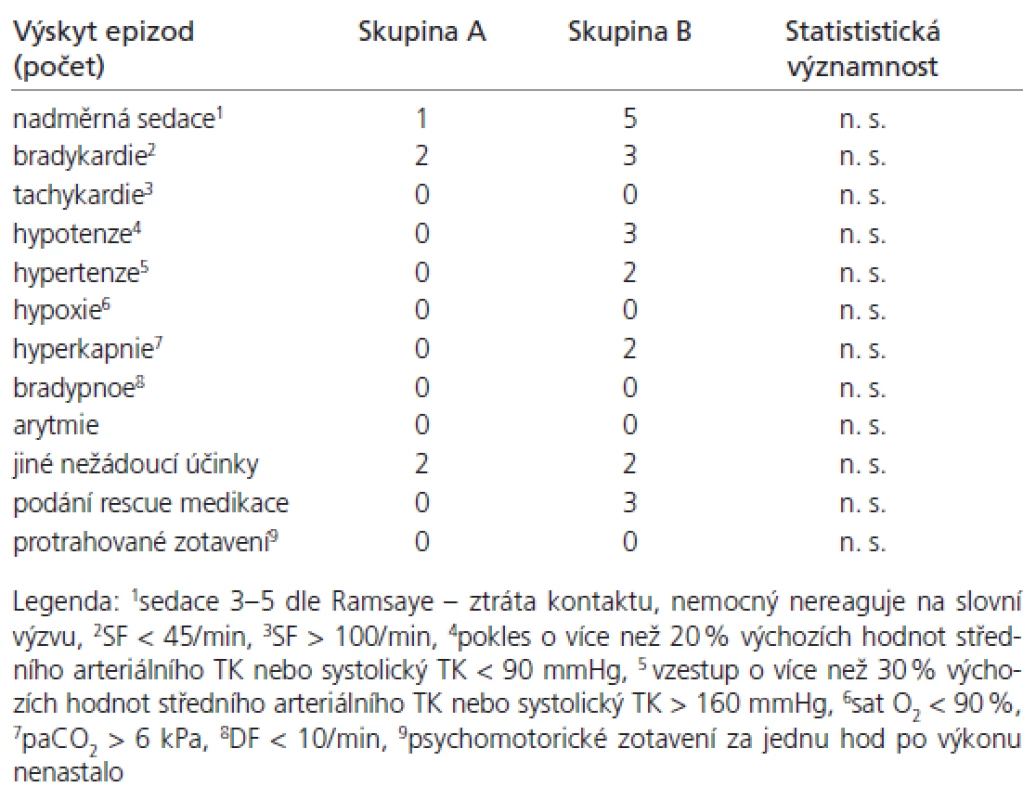
Tab. 10. Saturace hemoglobinu kyslíkem. 
Tab. 11. Spolupráce s nemocným. 
Tab. 12. Výskyt amnézie na výkon. 
Diskuze
Kombinaci dexmedetomidin - ketamin - midazolam (skupina A) jsme užili k sedaci při endovaskulárních ne uro intervenčních výkonech s cílem nalézt vhodno u alternativu k dosud po užívaným způsobům sedace s opi o idní komponento u, u kterých je možný výskyt závažné deprese dýchání. Dexmedetomidinová sedace užívaná k po operační sedaci na jednotkách intenzivní péče je charakteristická tím, že nemocný nevyrušován pospává, jakmile je aplikován zevní podnět, rychle se probo uzí a je schopen re akce a adekvátní komunikace [5]. I v naší studii při kombinaci dexmedetomidinu s malo u dávko u ketaminu a midazolamu se projevil tento typ sedace. Nemocní, pokud k tomu byli vyzváni, velmi dobře spolupracovali s operatérem. Pokud nebyli vyrušováni, pospávali, zůstávali však oslovitelní. Ve skupině sufentanil-midazolam (skupina B) byl statisticky nevýznamně vyšší výskyt nadměrné sedace, kdy nemocní přestávali re agovat na oslovení. Je známo, že dochází k potenci aci hypnotického účinku, pokud se po užije kombinace opi o id - midazolam [11,12]. Ve srovnání s dosud užívano u sedací (sufentanil - midazolam) přináší sedace dexmedetomidin‑ketamin‑midazolam statisticky významné zlepšení spolupráce s paci entem během výkonu. Komunikace a spolupráce s paci entem je zásadním požadavkem na sedaci při endovaskulárních ne uro intervencích. Výskyt amnézi e byl menší ve skupině dexmedetomidin‑ketamin‑midazolam, i když rozdíly nebyly statisticky významné. Nepodařilo se prokázat náš předpoklad, že midazolam v nízkých dávkách klinicky významně potencuje slabý amnestický účinek dexmedetomidinu. Ketamin byl so učástí kombinace s dexmedetomidinem především k potenci aci analgetického účinku, kterého bylo docíleno bez po užití opi o idů. Klinicky významný útlum dýchání nebyl ve studii zaznamenán. Po uze mírná hyperkapni e se vyskytla dvakrát ve skupině sufentanil - midazolam bez prokázané statistické významnosti. Saturace hemoglobinu kyslíkem byla stejná v obo u skupinách, hypoxi e nebyla zaznamenána. Paci enti však vdechovali v průběhu výkonu kyslíkem obohaceno u směs. Dle předpokladů kombinace dexmedetomidin‑ketamin‑midazolam netlumí dýchání. Dexmedetomidin nevyvolává v klinickém dávkování dechový útlum [4] a rovněž ketamin má malý vliv na respiraci, stejně tak jako midazolam [13]. Kromě toho svalový tonus horních dýchacích cest zůstává při podání ketaminu zachován. Naproti tomu opi o idy mají značně individuální depresivní účinek na dýchání a v kombinaci i s nízkými dávkami benzodi azepinů byl pozorován výrazný synergizmus v oblasti respiračně depresivních účinků [14].
Výskyt nežádo ucích účinků na oběh (epizody hypertenze – hypotenze, bradykardi e – tachykardi e, arytmi e) se nelišil. Rescue medikace byla podána třikrát ve skupině B z důvodů hypertenze, hypotenze a bradykardi e. Systolický i di astolický tlak se snížil významně (p < 0,001) více ve skupině dexmedetomidin‑ketamin‑midazolam (A) než v kontrolní skupině sufentanil - midazolam (B). Intraindividuální vari abilita hodnot systémového tlaku však byla menší ve skupině A (p < 0,05), což vypovídá o stabilitě tlaku v této skupině během výkonu. Srdeční frekvence klesla též statisticky významněji ve skupině A (p < 0,001), intraindividuální vari abilita se nelišila v obo u skupinách. Snížení systémového krevního tlaku, srdeční frekvence a hemodynamická stabilita jso u charakteristické pro sedaci dexmedetomidinem, což bylo v so uladu s literárními údaji pozorováno v naší studii [15 – 17]. Nižší hodnoty systémového tlaku a hemodynamická stabilita jso u žádané vlastnosti sedace při endovaskulárních ne uro intervenčních výkonech, což by potenci álně mohlo přispět ke snížení výskytu závažných hemoragických komplikací [18 – 20]. V naší studii se klinicky závažné komplikace nevyskytly. Po jedné hodině od ukončení sedace bylo docíleno psychomotorického zotavení u všech nemocných obo u skupin. Psychomimetické účinky se nevyskytly. Úroveň kognitivních funkcí v časné fázi po ukončení sedace nebyla v naší studii sledována, a nemohla být tedy konfrontována s literárními údaji [10]. Během studi e se nevyskytly žádné klinicky závažné komplikace, které by si vynutily změnu postupu nebo přerušení výkonu. Sedace kombinací dexmedetomidin–ketamin - midazolam, která je neopi o idní alternativo u běžně užívaných způsobů sedace, se jeví jako bezpečná a vhodná metoda pro endovaskulární ne uro intervenční výkony. Zajišťuje velmi dobro u spolupráci s nemocným, hemodynamicko u stabilitu a netlumí dýchání.
J. Schreiberová1, L. Hess2, A. Krajina3, M. Lojík3
1 Klinika anestezi ologi e, resuscitace a intenzivní medicíny LF UK a FN Hradec Králové
2 Institut klinické a experimentální medicíny Praha, IPVZ Praha
3 Radi ologická klinika LF UK a FN Hradec Králové
Zdroje
1. Armonda RA, Vo AH, Dunford J, Bell RS. Anesthesi a for endovascular surgery. Ne urosurgery 2006; 59(Suppl 3): 66 – 76.
2. Schreiberová J, Bašta V, Krajina A. Analgosedace u endovaskulárních embolizací intrakrani álních arteri ovenózních malformací. Anest neodkl Péče 2000; 11(4): 149 – 151.
3. Pino MR. The nature of anesthesi a and procedural sedati on o utside of the operating ro om. Curr Opin Anaesthesi ol 2007; 20 : 347 – 351.
4. Hess L. Dexmedetomidinum. Remedi a 2003; 13 : 2 – 10.
5. Paris A, Tonner PH. Dexmedetomidine in anaesthesi a. Curr Opin Anaesthesi ol 2005; 18(4): 412 – 418.
6. Nelson LE, Lu J, Guo T, Saper CB, Franks NP, Maze M. The alfa2 - adrenoceptor agonist dexmedetomidine converges on an endogeno us sleep - promoting pathway to exert its sedative effects. Anesthesi ology 2003; 98(2): 428 – 436.
7. Vaculín Š, Franěk M, Hess L, Rokyta L. Ovlivnění nocicepce medetomidinem a jeho kombinací s ketaminem u laboratorního potkana. Psychi atri e 2002; 6 (Suppl 4): 14 – 17.
8. Hall JE, Uhrich TD, Barney JA, Arain SR, Ebert JT. Sedative, amnestic, and analgesic properti es of smalldose dexmedetomidine infusi ons. Anesth Analg 2000; 90(3): 699 – 705.
9. Mack PF, Perrine K, Kobylarz E, Schwartz TH, Li en CA. Dexmedetomidine and ne urocognitive testing in awake krani otomy. J Ne urosurg Anesthesi ol 2004; 16(1): 20 – 25.
10. Bustillo MA, Lazar RM, Finck AD, Fitzsimmons B, Berman MF, Pile - Spellman J et al. Dexmedetomidine may impair cognitive testing during endovascular embolizati on of cerebral arteri oveno us malformati ons: A retrospective case report seri es. J Ne urosurg Anesthesi ol 2002; 14(3): 209 – 212.
11. Ben - Shlomo B, adb - el - Khalim H, Ezry J,Zohar S, Tverskoy M. Midazolam acts synergistically with fentanyl for inducti on of anaesthesi a. Br J Anaest 1990; 64(1): 45 – 47.
12. Kissin I, Vinik HR, Castillo R, Bradley EL jr. Alfentanil potenti ates midazolam - induced unconsci o usness in subanalgesic doses. Anesth Analg 1990; 71(1): 65 – 69.
13. Larsen R, Drábková J (eds). Anestezi e. 7th ed. Praha: Grada Publishing 2004.
14. Bailey PL, Streisand JB, East KA, East TD, Isern S, Hansen TW et al. Differences in magnitude and durati on of opi o id - induced respiratory depressi on and analgesi a with fentanyl and sufentanil. Anesth Analg 1990; 70(1): 8 – 15.
15. Hogue CW jr, Talke P, Stein PK, Richardson Ch, Dimitrovich PP, Sessler DI. Autonomic nervo us system responses during sedative infusi ons of dexmedetomidine. Anesthesi ology 2002; 97(3): 592 – 598.
16. Ebert TJ, Hall JE, Barney JA, Uhrich TD, Colinco MD. The effects of incre asing plasma concentrati ons of dexmedetomidine in humans. Anesthesi ology 2000; 93(2): 382 – 394.
17. Penttila J, Helminen A, Anttila M, Hinkka S, Scheinin H. Cardi ovascular and parasympathetic effects of dexmedetomidine in he althy subjects. Can J Physi ol Pharmacol 2004; 82(5): 359 – 362.
18. Heidenreich JO, Hartli eb S, Stendel R, Pi etilä TA, Schlattmann P, Wolf KJ et al. Bleeding complicati ons agter endovascular therapy of cerebral arteri oveno us malformati ons. Am J Ne uroradi ol 2006; 27(2): 313 – 316.
19. Buhk JH, Cepek L, Kna uth M. Hyperacute intracerebral hemorrhage complicating carotid stenting sho uld be distinguished from hyperperfusi on syndrome. AJNR Am J Ne uroradi ol 2006; 27(7): 1508 – 1513.
20. Krajina A, Náhlovský J, Malec R, Němečková J, Drahoko upilová H, Pařízek J, Řehák S et al. Komplikace endovaskulárních ne uro intervenčních výkonů. Cesk Slov Ne urol N 1997; 60/ 93(1): 20 – 26.
Štítky
Detská neurológia Neurochirurgia Neurológia
Článok vyšiel v časopiseČeská a slovenská neurologie a neurochirurgie
Najčítanejšie tento týždeň
2008 Číslo 4- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Kombinace metamizol/paracetamol v léčbě pooperační bolesti u zákroků v rámci jednodenní chirurgie
- Neuromultivit v terapii neuropatií, neuritid a neuralgií u dospělých pacientů
- Antidepresivní efekt kombinovaného analgetika tramadolu s paracetamolem
-
Všetky články tohto čísla
- Stenóza vnitřní krkavice – endarterektomie nebo stent?
- Srovnání karotické endarterektomie a stentingu – výsledky jednoho pracoviště
- Patofyziologie kompresivní radikulopatie
- Timing karotické endarterektomie
- Přínos statické počítačové posturografie ke skríningovému vyšetření kvantifikace posturální rovnováhy
- Botulotoxin v léčbě detruzorové hyperaktivity u pacientek s roztroušenou sklerózou
- Výskyt epileptických záchvatů a/ nebo epileptiformní EEG abnormity u dětí s dětským a atypickým a utizmem
- Komentář ke článku Schreiberová et al. Sedace kombinací dexmedetomidin- ketamin- midazolam pro endovaskulární léčbu mozkových arteri ovenózních malformací a stenóz karotických tepen
- Sedace kombinací dexmedetomidin-ketamin- midazolam pro endovaskulární léčbu mozkových arteri ovenózních malformací a stenóz karotických tepen
- Vývoj adaptace rovnovážného systému po operacích vestibulárního schwannomu
- Komplikace léčby těžké spasticity implantabilními pumpovými systémy
- Analýza souboru pacientů s kraniocerebrálním poraněním léčených na Pracovišti dětské medicíny FN Brno v období let 2000–2007
- Výsledky operační léčby ne uromuskulárních deformit páteře
- Tuberózní skleróza: optimalizace postupu její DNA di agnostiky
- Cerebelární mutizmus po resekci meduloblastomu u dítěte – kazuistika
- Léky navozený systémový lupus erythematodes při terapii interferonem beta‑1b – kazuistika
- Webové okénko
-
Analýza dat v neurologii X.
Vybrané otázky sumární statistiky - Doporučené postupy pro di agnostiku Alzheimerovy nemoci a dalších onemocnění spojených s demencí
- Kraniocerebrální poranění v dětském věku
- Česká a slovenská neurologie a neurochirurgie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Stenóza vnitřní krkavice – endarterektomie nebo stent?
- Výskyt epileptických záchvatů a/ nebo epileptiformní EEG abnormity u dětí s dětským a atypickým a utizmem
- Léky navozený systémový lupus erythematodes při terapii interferonem beta‑1b – kazuistika
- Timing karotické endarterektomie
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy







