-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Parenterální výživa
Autoři: F. Fencl; K. Bláhová
Působiště autorů: Pediatrická klinika UK 2. LF a FN Motol, Praha
Vyšlo v časopise: Čes-slov Pediat 2012; 67 (1): 52-59.
Kategorie: Vybrané kapitoly z nové učebnice Klinická pediatrie
Nakladatelství Galén připravuje k vydání novou učebnici „Klinická pediatrie“, která bude určena jak pro pregraduální studium na lékařských fakultách, tak i v rámci postgraduálního vzdělávání pro přípravu na atestaci z dětského lékařství a z praktického dětského lékařství. Autoři věří, že učebnici ocení i dětští lékaři v praxi.
Ve spolupráci nakladatelství Galén a redakce Česko-slovenské pediatrie na stránkách našeho časopisu postupně uveřejňujeme jednotlivé stati z nové učebnice – a jako bonus také některé kapitoly, které se do nové učebnice už „nevešly“, protože učebnice má přesně stanovený rozsah.
Parenterální výživa
Parenterální výživu zahajujeme v situaci, kdy pacientovi nelze podávat dostatečnou výživu enterální cestou – tedy pokud gastrointestinální trakt není schopen zajistit příjem, trávení a/nebo absorpci adekvátního množství vody, živin, elektrolytů, stopových prvků a vitaminů potřebných pro růst a vývoj dětského organismu. Parenterální výživa může být někdy vedena v kombinaci s enterální výživou – parciální parenterální výživa (PPV), v jiných situacích je nezbytná totální parenterální výživa (TPV), která pak musí pokrývat kompletní nutriční potřeby organismu ve všech složkách. Při totální parenterální výživě je žádoucí minimální enterální výživu zachovat i za předpokladu, že přísun živin touto cestou je zanedbatelný. Typickým příkladem je syndrom krátkého střeva, kde enterální výživa má význam pro adaptaci, resp. stimulaci zbytku střeva. Některé pacienty včetně kojenců je možné dlouhodobě léčit v domácím prostředí (domácí parenterální výživa – DPV).
Indikace parenterální výživy
- Onemocnění trávicího ústrojí související s chirurgickou problematikou: volvulus, malrotace střeva, gastroschíza, omfalokéla, tracheoezofageální píštěl, brániční hernie, mekoniový ileus s peritonitidou, mnohočetné atrézie střeva, jejunostomie atp.
- Onemocnění střev: nezvladatelné kojenecké průjmy, závažné malabsorpce, Hirschsprungova choroba (s enterokolitidou), nespecifická zánětlivá střevní onemocnění (ulcerózní kolitida, Crohnova nemoc – především fistulující forma), pseudomembranózní kolitida, nekrotizující enterokolitida (NEC), chronická idiopatická pseudoobstrukce (poruchy motility), radiační enteritida, vaskulární příhody postihující trávicí ústrojí (např. ischemie na podkladě trombózy a. mesenterica).
- Syndrom krátkého střeva: syndrom krátkého střeva je důsledkem redukce funkčně využitelné plochy střeva pod minimum schopné zajistit nutriční potřeby organismu. Může být důsledkem řady onemocnění jmenovaných v předchozích odstavcích. Patří sem rozsáhlé resekce střeva z různých příčin (např. NEC, volvulus, mnohočetné atrézie střeva, vaskulární příhody trávicího ústrojí) a jiné stavy vedoucí k vyřazení významné části funkčního střeva (např. vysoké stomie vyřazující zbytek zachovaného střeva). Zcela výjimečně se může vyskytnout kongenitální syndrom krátkého střeva. Mezi příčinami rozsáhlých resekcí omezujících resorpční plochu střeva má významné postavení NEC u nedonošených novorozenců. Z hlediska budoucí schopnosti zajištění enterální výživy je rozhodující nejen rozsah resekce, ale také resekovaná oblast střeva.
- Za minimální délku střeva, která může být v pozdějším věku potenciálně dostatečná pro plnou enterální výživu, považujeme u novorozence
- alespoň 30 cm jejuna se zachovanou ileocekální chlopní a nepostižené kolon;
- alespoň 60–70 cm bez ileocekálního přechodu a nepostižené kolon;
- 100 cm jejuna bez ileocekálního přechodu při subtotální resekci kolon.
- Pro budoucí prognózu má velký význam chirurgická rehabilitace střeva – end-to-end anastomózy zachovaných úseků střeva, odstranění píštělí, slepých úseků, možnost prodlužovacích operací.
- Za minimální délku střeva, která může být v pozdějším věku potenciálně dostatečná pro plnou enterální výživu, považujeme u novorozence
- Hypermetabolické stavy: popáleniny, polytraumata, septické stavy.
- Neonatologické indikace: novorozenci s velmi nízkou porodní hmotností, asfyxií, IRDS, nekrotizující enterokolitidou.
- Ostatní indikace: renální, kardiální či jaterní selhání, pankreatitida, onkologická onemocnění, stavy po transplantaci orgánů a kostní dřeně, mentální anorexie, cystická fibróza.
Cévní přístupy k parenterální výživě
Výjimečně lze na krátkou dobu (do 1 týdne) pro parenterální výživu použít periferní žilní přístup. Osmolalita roztoků podávaných do periferního žilního řečiště nemá přesáhnout 800 mosm/kg, aby nedocházelo k poškození žíly. Proto parenterální výživa podávaná do periferie nemůže při adekvátním objemu plně pokrývat energetickou potřebu organismu. U malých dětí je při podávání do periferní žíly limitujícím faktorem i rychlost infuze.
Pro totální parenterální výživu je nutné zavedení centrálního žilního katétru (CŽK). Vlastní zavedení katétru se provádí punkční technikou podle Seldingera (u krátkodobých katétrů) nebo implantací katétru podkožním tunelem (u dlouhodobých katétrů). Důležitý je individuální výběr katétru s ohledem na velikost a materiál (silikon, polyuretan). Pro dlouhodobou parenterální výživu obvykle dáváme přednost jednocestnému silikonovému katétru, tzv. Broviacovu nebo Hickmanovu katétru, který je v oblasti podkožního tunelu opatřen dakronovou manžetou. Následná proliferace fibrotické tkáně v okolí manžety zlepší fixaci katétru a omezí riziko ascendentního šíření infekce. Odstranění katétru tohoto typu je vždy chirurgické (obr. 1).
Obr. 1. Extrahovaný Broviacův katétr s fibrotickou tkání v oblasti dakronové manžety. 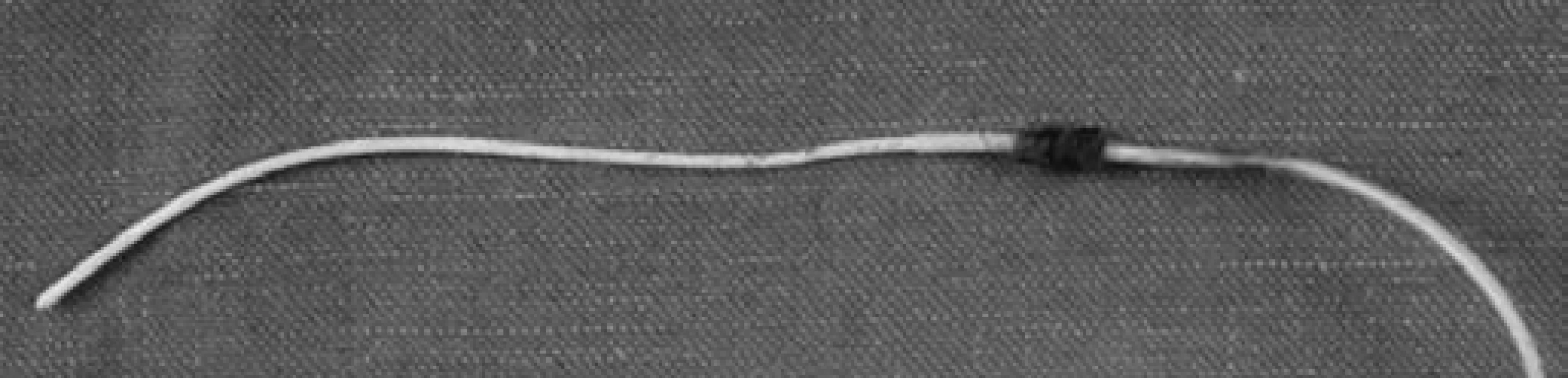
K dispozici jsou také implantabilní systémy s podkožní komůrkou (portem – implantable access port; obr. 2). Komůrka má silikonovou membránu, aplikace infuze či léků se provádí do komůrky speciální jehlou. Pro dlouhodobou aplikaci větších objemů a z hlediska fixace (především u malých dětí) je pro TPV méně výhodná. Využívá se především u onkologických pacientů (chemoterapie) či pacientů s intermitentní aplikací léků (v pediatrii např. u cystické fibrózy s cyklickou antibiotickou léčbou).
Obr. 2. Podkožní komůrka (implantable access port). Konec katétru je zavedený do v. subclavia vpravo. Na obrázku je viditelná i speciální aplikační jehla v komůrce tohoto systému. 
Nejčastěji využívanými vstupy pro ČZK jsou vena subclavia, vena jugularis, vena femoralis (z hlediska dodržování hygieny u dětí není optimální, CŽK ale lze vyvést podkožním tunelem na břicho nebo stehno). U pacientů s vyčerpanými běžnými vstupy lze ve výjimečných případech zavést CŽK ze sternotomie přímo do pravé srdeční síně. Pro úplnost je nutné z neonatologického pohledu zmínit možnost krátkodobého použití umbilikální žíly pro vstup do centrálního žilního řečiště.
Lokalizaci každého katétru kontrolujeme v pediatrii rentgenologicky. Hrot katétru zavedeného cestou vena subclavia, resp. vena jugularis by měl končit v horní duté žíle, těsně před vstupem do pravé srdeční síně. Hrot katétru zavedeného cestou vena femoralis by měl končit v průběhu vena cava inferior (obr. 3a, b, c).
Obr. 3a, b, c. Kontrastní zobrazení katétrů zavedených cestou v. jugularis, v. subclavia a v. femoralis. 
Složení parenterální výživy
V současnosti pro parenterální výživu používáme vaky, které obsahují všechny typy živin (glukózu, aminokyseliny, tuky), elektrolyty, minerály včetně stopových prvků a vitaminy – tzv. all-in-one vaky (AIO vaky, obr. 4). Starší systém parenterální výživy „multi-bottle“ (jednotlivé složky jsou aplikovány samostatnými cestami) je díky technologickému pokroku téměř opuštěn.
Obr. 3. Vak „all-in-one“ (AIO) k totální parenterální výživě. 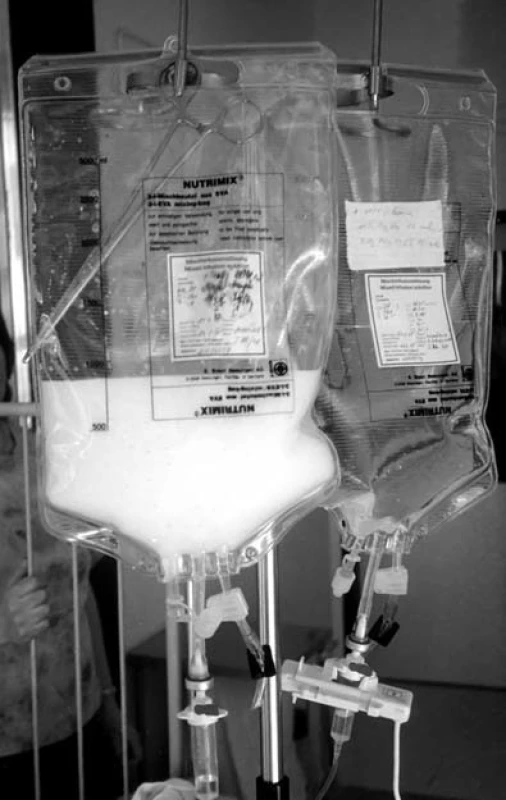
Potřeba tekutin
Při stanovení potřeby tekutin pro daného dětského pacienta vycházíme z jeho bazální potřeby (vztažené k věku a hmotnosti). Tato potřeba může být modifikována dalšími faktory oběma směry. Orientačně platí, že děti s hmotností 1–10 kg mají denní potřebu tekutin 100 ml/kg tělesné hmotnosti, děti vážící 10–20 kg mají potřebu 1000 ml + 50 ml na každý kilogram nad 10 kg tělesné hmotnosti, děti s hmotností nad 20 kg mají denní potřebu 1500 ml + 20 ml na každý kilogram nad 20 kg tělesné hmotnosti. Podrobněji je doporučená základní denní potřeba tekutin pro jednotlivé věkové kategorie uvedena v tabulce 1.
Bazální potřebu tekutin zvyšují ztráty perspirací při teplotách (zvýšení tělesné teploty o 1 ºC zvyšuje potřebu tekutin o 30 %), průjmech, osmotické diuréze, větších odpadech stomiemi, při zevní komorové drenáži, potřebu zvyšuje i současně prováděná fototerapie, pobyt na vyhřívaném lůžku či nízká vlhkost vzduchu. Naopak bazální potřebu tekutin snižuje kardiální nebo renální insuficience, svalová hypotonie, významnější farmakologické tlumení, umělá plicní ventilace a zvýšená sekrece antidiuretického hormonu (např. po operačních zákrocích či úrazech).
Přiměřenost podávaného objemu tekutin kontrolujeme sledováním hmotnosti, bilance tekutin, klinických známek hydratace a eventuálních edémů. Laboratorně sledujeme parametry vnitřního prostředí, odpady iontů do moči a osmolalitu moči.
Tab. 1. Základní potřeba tekutin u dětí. 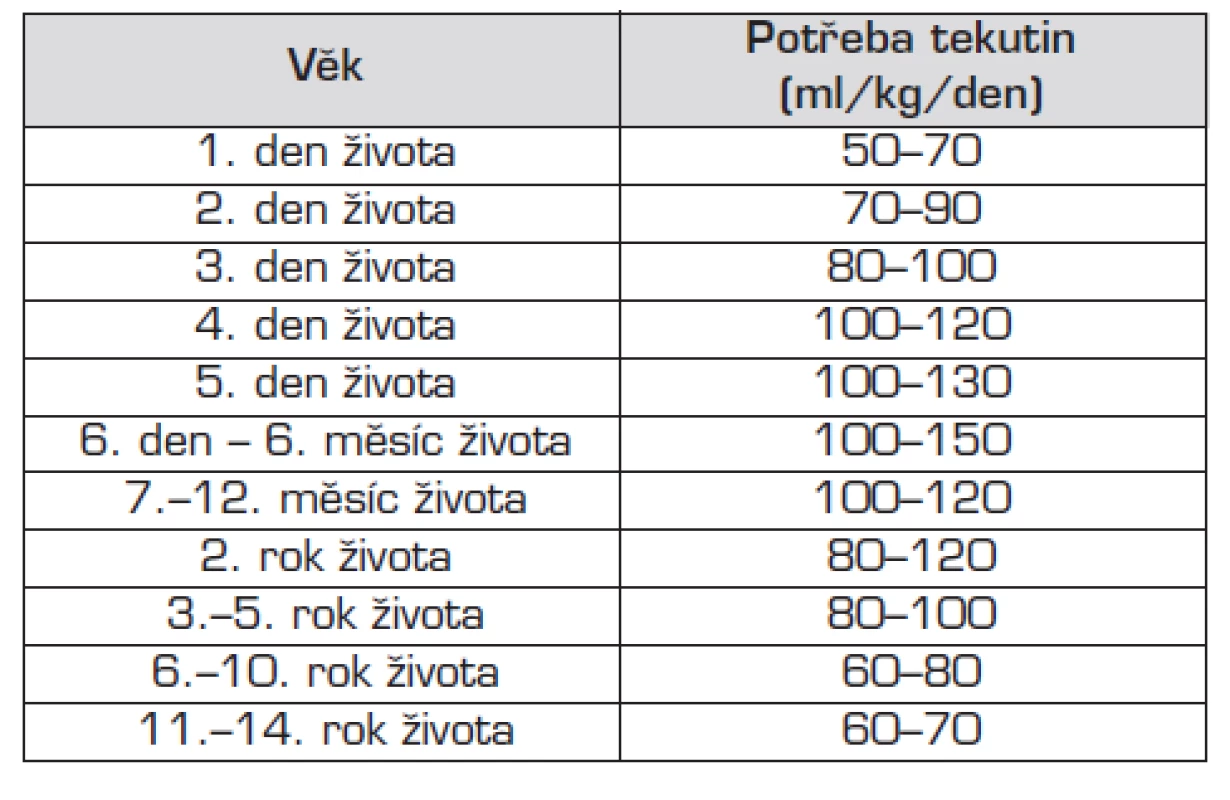
Elektrolyty
Doporučený denní přívod základních iontů při TPV uvádí tabulka 2. Tato potřeba může být odlišná u některých patologických stavů:
- potřeba sodíku stoupá při jeho ztrátách gastrointestinálním traktem (průjmy, stomie), ledvinami (polyurická fáze akutního selhání ledvin) nebo při ztrátách do dalších prostorů (zevní komorová drenáž);
- při fistulující formě Crohnovy choroby je nutná zvýšená suplementace hořčíkem;
- velká opatrnost s přívodem draslíku je nezbytná u pacientů s renálním selháním a v pooperačním období;
- nedonošené děti potřebují více vápníku a fosforu. Vápník a fosfor se pro lepší biokompatibilitu doporučuje aplikovat ve formě kalcium-glukonátu nebo natrium-glycerolfosfátu;
- specifická je situace u novorozenců v prvních dnech života.
Vedle pravidelného vyšetřování plazmatických i močových hladin jednotlivých elektrolytů sledujeme také kalciofosfátový metabolismus včetně hladin vitaminu D, parathormonu a alkalické fosfatázy.
Tab. 2. Průměrná základní potřeba elektrolytů při parenterální výživě. 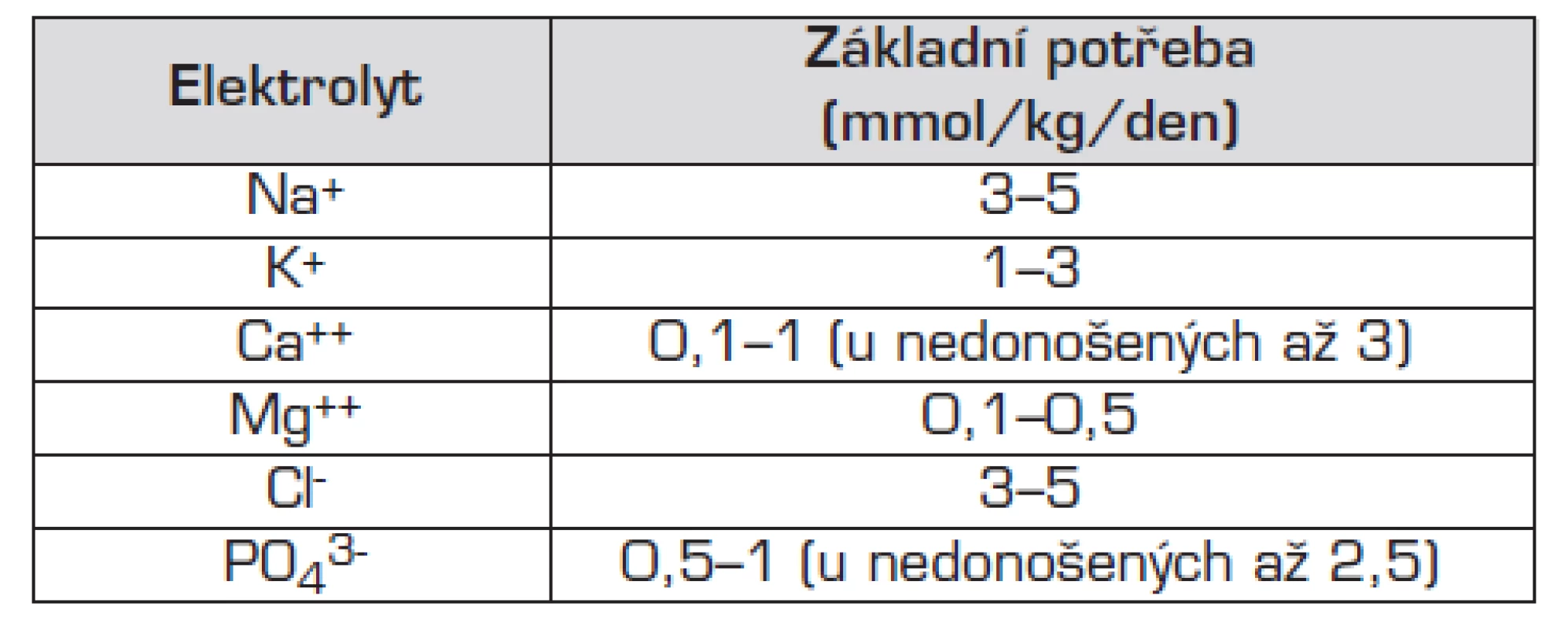
Aminokyseliny
Komerčně vyráběné roztoky aminokyselin (5 až 10% roztoky) k TPV obsahují všechny potřebné esenciální i neesenciální aminokyseliny, 1 g aminokyselin odpovídá 4 kcal energie. Doporučené dávky aminokyselin pro jednotlivé věkové kategorie uvádí tabulka 3. Aby organismus využil aminokyseliny pro syntézu bílkovin a nikoliv jako zdroj energie, musí TPV obsahovat dostatek „neproteinové energie“ – na 1 gram aminokyselin je třeba dodávat 30–40 kcal energie ve formě sacharidů a tuků.
Pro výběr roztoku aminokyselin je rozhodující věk dítěte a fyziologické odlišnosti jeho metabolismu. Roztoky pro nedonošené děti obsahují více cysteinu, roztoky pro kojence více histidinu, taurinu a tyrosinu. Speciální aminokyselinové směsi jsou určeny pro hyperkatabolické stavy a orgánová selhání. Pacientům s jaterním selháním, jaterní encefalopatií a zejména pacientům v jaterním kómatu podáváme směsi obohacené o aminokyseliny s rozvětveným řetězcem (leucin, isoleucin a valin), ale se sníženým obsahem sirných a aromatických aminokyselin. Pro zvýšení schopnosti detoxikovat amoniak je zvýšen obsah argininu.
U renální insuficience se používají směsi obohacené o esenciální aminokyseliny – tyrosin, lysin, threonin a rozvětvené aminokyseliny, snížen je naopak obsah alaninu, glycinu a argininu. V těžkých septických nebo katabolických stavech a u onkologických pacientů je vhodný vysoký podíl rozvětvených aminokyselin, lysinu a argininu.
Pro sledování přiměřené dodávky aminokyselin monitorujeme plazmatické hladiny albuminu, prealbuminu a celkové bílkoviny. Zvýšení plazmatické hladiny urey a amoniaku signalizuje nadměrný přívod aminokyselin. Sleduje se rovněž acidobazická rovnováha. Je možné sledovat i hladiny některých aminokyselin. Z dlouhodobého hlediska je důležitý přiměřený růst a vývoj dítěte.
Tab. 3. Denní potřeba jednotlivých živin a energie při totální parenterální výživě. 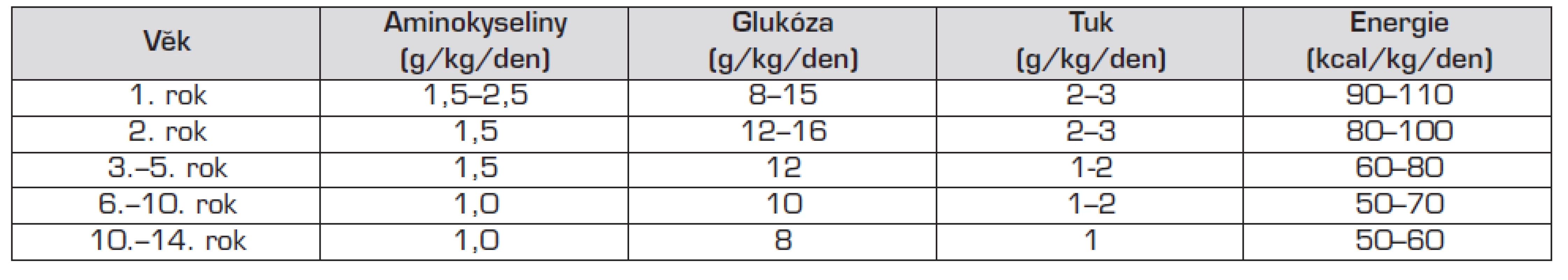
Glukóza
Hlavním energetickým zdrojem je glukóza. Pro mozkové buňky je jediným využitelným zdrojem energie.
Glukóza má pokrývat 60–75 % nebílkovinných zdrojů energie. 1 g glukózy přitom odpovídá 4 kcal energie. Pokud podáváme parenterální výživu do periferní žíly, nelze překročit maximální koncentraci glukózy 10–12 %. Při vyšší koncentraci se rozvine flebitida. U TPV aplikované centrálním žilním katétrem lze použít glukózu i v koncentraci 40 %. Koncentrace glukózy se při TPV navyšuje postupně, cílová dodávka je 10–15 (maximálně 18) g/kg tělesné hmotnosti a den. Podrobné údaje podle věku uvádí tabulka 3.
Děti glukózu zpravidla dobře tolerují, ale při zahajování parenterální výživy je třeba opakovaně kontrolovat glykémii a glykosurii až 3krát denně, abychom se přesvědčili o dostatečné metabolizační rychlosti glukózy. Hyperglykémie je důsledkem nadměrné dodávky glukózy, kterou organismus v dané chvíli nedokáže metabolizovat. Snížená tolerance glukózy je proto častá u pacientů v septickém stavu, po operacích či traumatech. Zejména u novorozenců a malých kojenců může dojít při zahájení a ukončení infuze vaku ke klinicky významnému výkyvu glykémie, riziková je především hypoglykémie při náhlém ukončení aplikace vaku. Proto se doporučuje prvních a posledních 30 minut infuze podávat vak poloviční rychlostí. Vyvážený poměr glukózy a tuků v TPV snižuje riziko steatózy jater – lipogeneze vzniká nadměrným přívodem glukózy. U ventilovaných pacientů může docházet k retenci vody a prohloubení respiračních problémů, pokud je glukóza jediným energetickým zdrojem (stoupá produkce CO2). Při vysokém příjmu glukózy se také poněkud zvyšuje riziko výskytu infekčních komplikací a poruchy metabolismu proteinů.
Tuky
Lipidy jsou u dětí integrální součástí TPV a používají se především k pokrytí energetických potřeb. Mají vysoký energetický obsah – 1 g lipidů obsahuje 9 kcal energie. Energetický příjem z lipidových zdrojů by měl představovat 25–40 % neproteinové energie. Dávku i.v. tukových emulzí zvyšujeme postupně (zhruba o 0,25 g/kg/den), u nezralých novorozenců začínáme s dávkou 0,5 g/kg/den. Cílová dávka je 3 g/kg/den. U novorozenců, kojenců a starších dětí začínáme dávkou 1 g/kg/den, denně navyšujeme dodávku o 0,5 g/kg/den, cílové hodnoty jsou 3, resp. 2 g/kg/den. Doporučené dávkování u jednotlivých věkových kategorií shrnuje tabulka 3.
Tukové emulze určené pro parenterální výživu jsou vodné emulze tukových partikulí, které obsahují esenciální mastné kyseliny. Používají se tukové emulze s mastnými kyselinami s dlouhým řetězcem (vodné emulze sojového oleje/sojového + olivového oleje), emulze s mastnými kyselinami s dlouhým a středním řetězcem (sojový olej + MCT), emulze obsahují omega-3-mastné kyseliny (sojový olej + MCT + rybí olej, případně + olivový olej). V pediatrii dáváme přednost emulzi 20% vzhledem k nižšímu poměru lecitin/triacylglyceroly (u 10 % emulzí je tento poměr dvojnásobný). Nižší hladina lecitinu zlepšuje toleranci tuků a snižuje riziko akumulace fosfolipidů a cholesterolu. Některé roztoky lipidů s vhodnou osmolalitou lze krátkodobě podávat i do periferní žíly, pro dlouhodobou TPV je však nezbytná aplikace do CŽK.
U novorozenců a kojenců je optimální podávat směs obsahující lipidy kontinuálně po celých 24 hodin, aby byla zajištěna co nejlepší metabolizace. Postupně se pak snažíme přecházet na cyklické podávání se střídáním tukové a beztukové směsi. Při nadměrném přívodu hrozí hypertriglyceridémie, proto zejména při zvyšování obsahu lipidů a u nedonošených dětí pravidelně vyšetřujeme hladinu triglyceridů. Dalším rizikem nadměrného přívodu lipidů je hepatopatie a cholestáza (projeví se vzestupem hladin jaterních enzymů a bilirubinu). Vzácně se může objevit trombocytopenie. Všechny tyto komplikace léčíme snížením obsahu tuků v TPV. U septických stavů je vhodné lipidy z parenterální výživy přechodně vysadit úplně.
Tab. 4. Patofyziologické situace, které vedou ke zvýšení energetické potřeby. 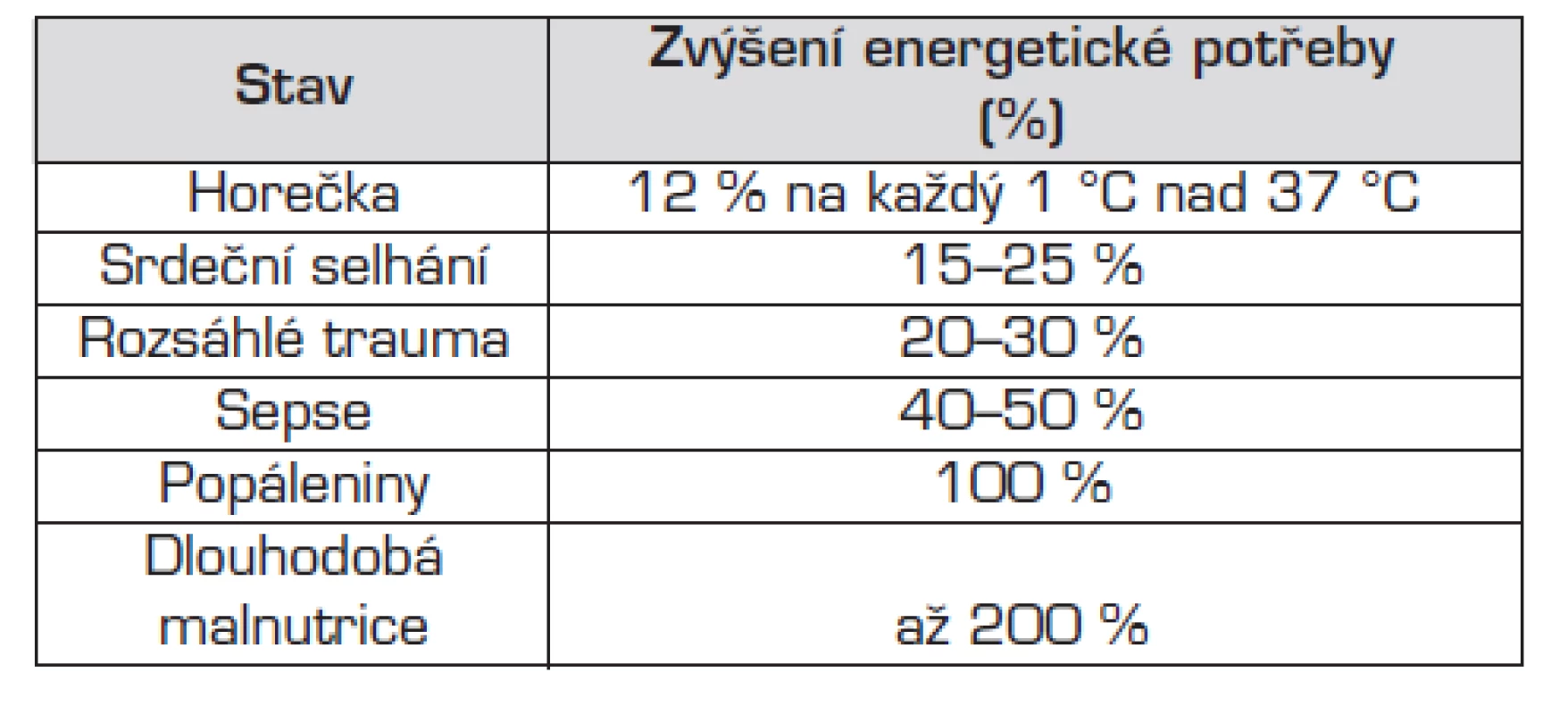
Vitaminy a stopové prvky
I krátkodobou TPV doplňujeme o hydrosolubilní a liposolubilní vitaminy a stopové prvky. Nezbytná je dodávka zinku, mědi, železa, dále chromu, jódu, kobaltu a selenu. Podáváme komerčně vyráběné koncentráty s definovaným obsahem jednotlivých stopových prvků (Tracutil, Addamel, Peditrace), resp. vitaminů (Cernevit, Soluvit, Vitalipid).
Vypočítané množství podáme do posledních 50 ml infuzního vaku s tukovou emulzí (v případě inkompatibility roztoku neznehodnotíme celý vak a zároveň zajistíme rychlou aplikaci, která nepřipustí poškození fotosenzitivní složky přídavku světlem). Deficit jednoho či více vitaminů musí být upraven zvlášť. Pravidelná kontrola hladin vitaminů a stopových prvků patří do schématu sledování všech pacientů na dlouhodobé parenterální výživě.
Komplikace parenterální výživy
Komplikace parenterální výživy mohou souviset
- s CŽK – komplikace při zavádění CŽK, infekce katétru, okluze katétru, trombotizace centrálního žilního řečiště, plicní embolizace, dislokace nebo spontánní vytažení katétru, poškození katétru;
- se stabilitou infuzních roztoků;
- s metabolickými komplikacemi – z nevhodného složení či objemu infuzních roztoků;
- s dalšími orgánovými systémy – hepatobiliární onemocnění (tzv. intestinal failure associated liver disease, IFALD), porucha kalciofosfátového metabolismu (metabolická kostní nemoc, MBD), růstová porucha, refeeding syndrom.
1. Komplikace spojené s centrálním žilním katétrem
Zavádění CŽK. K možným komplikacím patří pneumothorax, hemothorax, nevhodná pozice katétru, traumatizace brachiálního plexu, vznik AV píštěle. Při intrakardiálním zavádění může eventuálně dojít k srdeční tamponádě.
Infekce. Patří k nejčastějším a potenciálně fatálním komplikacím spojeným s aplikací parenterální výživy. Méně závažné jsou lokální infekce místa výstupu CŽK. Život ohrožující může být systémová infekce – katétrová sepse.
Léčba katétrové sepse zahrnuje antibiotika cílená na G+ koky (nejčastějším etiologickým agens je Staphylococcus epidermidis), empirickým antibiotikem první volby je proto obvykle vankomycin, ev. teicoplanin. Podávají se nejméně 10–14 dní. Součástí léčby je zajištění periferního žilního vstupu pro aplikaci léků a infuzních roztoků, vyřazení CŽK z používání po dobu antibiotické léčby a jeho uzavření antibiotickou zátkou. Před ukončením léčby je nezbytná opakovaně negativní hemokultura. Antibiotická léčba cestou CŽK může v těchto situacích představovat určité riziko v podobě trombóz a infekčních embolů (osteomyelitida).
Okluze katétru. Katétr se může ucpat krevní sraženinou nebo vysrážením inkompatibilních složek z aplikovaných roztoků (např. vysoká koncentrace vápníkových iontů v kombinaci s heparinem).
Trombotizace centrálního žilního řečiště. Trombotizace centrálního žilního řečiště je velmi závažná. Vyskytuje se u pacientů s dlouhodobou parenterální výživou a opakovanými katétrovými sepsemi. Symptomy vyplývají z obstrukce velkých cév. Diagnostika je echokardiografická. Rizikem je embolizace trombu do plicního řečiště. Léčba je antikoagulační, při současné infekci je nutné extrahovat katétr.
2. Komplikace spojené se stabilitou roztoků
Průmyslově vyráběné vaky parenterální výživy mají garantovanou stabilitu. U individuálně připravovaných vaků all-in-one (AIO) je třeba dodržet pořadí ředění jednotlivých složek (nejprve se míchá glukóza s ionty a stopovými prvky, poté se přidávají aminokyseliny a fosfor, naposledy se přidá tuková emulze). U vaků s tuky nelze překročit maximálně přípustný obsah iontů. Pro stabilitu roztoků je nepříznivé přidávání léků včetně heparinu.
3. Metabolické komplikace
Tyto komplikace způsobuje nevhodný objem a složení infuzních roztoků – objem tekutin, energetická hodnota, obsah živin, elektrolyty, minerály, stopové prvky. Příkladem je hypo - resp. hyperglykémie, metabolická acidóza, vzestup hladin urey a amoniaku, hypo - resp. hyperhydratace, iontové výkyvy. Příčinou je zpravidla nesprávná preskripce roztoků.
Mezi metabolické komplikace počítáme i lékové interakce – například steroidy indukovaná hyperglykémie, hypoglykémie při podávání inzulinu, farmakologické ovlivnění vazby bilirubinu na albumin u novorozenců (např. sulfonamidy, antimalarika, léky obsahující jako konzervační látku benzylalkohol).
4. Komplikace postihující další orgánové systémy
Hepatobiliární onemocnění – tzv. „Intestinal failure associated liver disease“ (IFALD). Nejzávažnější a nejčastější komplikací dlouhodobé TPV je cholestáza s hepatobiliárním postižením, která může omezovat další aplikaci parenterální výživy. Porucha je častější u dětí s nízkou porodní hmotností a u dětí na dlouhodobé parenterální výživě, k cholestáze přispívá nedostatečná sekrece gastrointestinálních hormonů (např. cholecystokininu) při přerušeném perorálním příjmu stravy, obleněná střevní motilita se zvýšenou enterohepatální cirkulací a následnou hypersekrecí bilirubinu, přerůstání střevních bakterií orálním směrem, toxické působení některých aminokyselin, nadměrný přísun tuků, rozsáhlá antibiotická a antimykotická léčba, ale také základní onemocnění (syndrom krátkého střeva, resekce ilea).
Projevy cholestázy se obvykle zjistí při pravidelném monitorování pacienta (zvýšení hladin bilirubinu, jaterních transamináz, žlučových kyselin, později zvýšení obstrukčních enzymů – ALP, GMT, při klinickém vyšetření ikterus, hepato - či splenomegalie).
Prevencí cholestázy je stimulace gastrointestinálního traktu stravou, zamezení hyperglykemických stavů, střídání tukových emulzí s netukovými roztoky a optimální zastoupení jednotlivých aminokyselin v roztocích. Z léků lze použít kyselinu ursodeoxycholovou (UDCA). Jde o hydrofilní žlučovou kyselinu, která hepatobiliární sekreci stimuluje, chrání hepatocyty před apoptózou vyvolanou hydrofobními (cytotoxickými) žlučovými kyselinami a má i antioxidační, imunomodulační a protizánětlivé účinky.
Porucha kalciofosfátového metabolismu spojená s demineralizací kostí – metabolická kostní nemoc (MBD). Příčinou MBD může být základní onemocnění včetně imobilizace, ale i samotná parenterální výživa – nízký příjem kalcia, fosfátu, vitaminu D, nedostatek magnézia, kontaminace hliníkem. K poruše přispívají kortikosteroidy (podávané například v rámci základního onemocnění). Nutné je sledování plazmatických hladin Ca, P, PTH, vitaminu D, odpadů Ca a P do moči, případně stanovení denzity kostního minerálu.
Refeeding syndrom komplikuje zahájení parenterální výživy u pacientů v dlouhodobé těžké malnutrici. Vzniká po náhlé kalorické a objemové zátěži organismu, který je metabolicky a hormonálně adaptován na nízký energetický příjem (dlouhodobý katabolický stav). Vyžaduje pečlivé monitorování hmotnosti a vnitřního prostředí. V první fázi omezujeme přívod tekutin, natria a glukózy, opatrně korigujeme hypokalémii, hypofosfatémii, udržujeme onkotický tlak a šetrně postupně navyšujeme přívod aminokyselin (nadbytek může vést k hyperamonémii a metabolické acidóze).
K dalším chronickým metabolickým komplikacím TPV patří růstová porucha a anémie v důsledku nedostatečně hrazených krevních ztrát, deficitu železa, kyseliny listové, vitaminu B12 a mědi.
Technické aspekty TPV
Pro parenterální výživu u větších dětí jsou k dispozici průmyslově vyráběné vaky standardního složení o různých objemech. Dvou - a tříkomorové vaky jsou určené jak pro periferní podání, tak pro centrální žilní aplikaci a splňují nároky na výživu stabilizovaných nemocných. Dvoukomorové vaky obsahují v jedné komoře aminokyselinovou směs s kompatibilními elektrolyty a ve druhé glukózu se zbytkem kompatibilních elektrolytů. Tím je oddělen vápník a fosfor, které mají tendenci precipitovat. Tříkomorové vaky mají také oddělenou aminokyselinovou směs od glukózy, třetí část vaku obsahuje tukovou emulzi. Kompletní výživa vznikne u obou typů vaků spojením všech komor a smísením jejich obsahu. Do takto připraveného vaku lze přidat před vlastním podáním vitaminy a stopové prvky. Poté jsou vaky určeny k okamžitému použití.
Výhodou těchto výrobků je relativně dlouhá doba použitelnosti nesmíchaných vaků a možnost skladování bez chlazení. Hlavním problémem je v pediatrii konstantní složení vaků (všech elektrolytů a jednotlivých živin v daném objemu), což omezuje využití u menších dětí do 6 let věku, resp. do hmotnosti 20 kg.
U novorozenců, kojenců, batolat a u pacientů se specifickými nároky na parenterální výživu tyto roztoky nelze používat vůbec, je nutná příprava individuálních roztoků pro každého pacienta. Vyrábějí je specializované lékárny za přísně aseptických podmínek v laminárních boxech. Takové vaky jsou jednokomorové – všechny složky parenterální výživy jsou smíchány již od výroby. Proto je nutné vaky uchovávat v chladu a jejich exspirace je krátká (4–7 dnů). Obrázek 4 ukazuje vak „all-in-one“ (AIO) k totální parenterální výživě.
Režim aplikace parenterální výživy je individuální. U novorozenců a kojenců začínáme kontinuální (24hodinovou) aplikací. Klesá riziko spojené s manipulací s CŽK a je lepší metabolická tolerance při rovnoměrném přívodu všech složek. Po stabilizaci před plánovaným propuštěním do domácí péče se pokoušíme postupně zvyšovat rychlosti infuze a tím vytvořit prostor pro odpojování pacienta. Cílovým stavem je aplikace TPV jen v noci na dobu maximálně 12 hodin. Pro lepší metabolickou toleranci TPV se obvykle střídá podávání vaků s tukem a bez tuku. U pacientů na částečné parenterální výživě jsou možné i zcela individuální režimy zahrnující např. aplikaci vaků obden.
Nutriční efekt TPV u pacienta s Hirschsprungovou nemocí znázorňují obrázky 5a, b, c.
Obr. 5a, b, c. Nutriční efekt totální parenterální výživy u pacienta s Hirschsprungovou nemocí: stav pfied zahájením, v průběhu a po ukončení TPV. 
Štítky
Neonatológia Pediatria Praktické lekárstvo pre deti a dorast
Článok vyšiel v časopiseČesko-slovenská pediatrie
Najčítanejšie tento týždeň
2012 Číslo 1- I „pouhé“ doporučení znamená velkou pomoc. Nasměrujte své pacienty pod křídla Dobrých andělů
- Rizikové období v léčbě růstovým hormonem: přechod mladých pacientů k lékařům pro dospělé
- Gastroezofageální reflux a gastroezofageální refluxní onemocnění u kojenců a batolat
-
Všetky články tohto čísla
- Vliv matrixových metaloproteináz na hojení ran po operaci vrozeného rozštěpu rtu
- Koncentrácia olova v krvi a alergénová senzibilizácia detí predškolského veku v dvoch regiónoch Slovenska
- Thymidin kináza – vhodný marker pro diagnostiku a sledování leukémií dětského věku
- Nárast polinózy u školskej mládeže v meste a na vidieku za posledných 20 rokov (1988–2009)
- Prevalence a typ anémie v době stanovení diagnózy nespecifického střevního zánětu u dětí
- Mikrodeleční syndrom Xp21: Závažná příčina selhání nadledvin, svalové dystrofie, poruchy hladin krevních lipidů a vývojové retardace u dvouměsíčního neprospívajícího kojence
- Ostravský den preventivní pediatrie 16. března 2012, Ostrava (Clarion Congress Hotel)
- Ligneózna konjunktivitída, hydrocefalus a protrahované respiračné infekcie u pacienta s deficitom plazminogénu
- Cmúľanie prstov a jeho vplyv na vývoj tváre a dutiny ústnej v detskom veku
- Ovlivnění bolesti při stomatologickém ošetření dětí
- Parenterální výživa
- Kdy vyšetřovat vrozená trombofilní rizika u dětí?
- Perspektiva dětské lůžkové péče v České republice v roce 2011
- Zkušenosti s dlouhodobou neakutní péčí o dítě s postižením ve Strančicích
- Nedožitých 89 rokov profesora Birčáka
- XVII. Moravskoslezské pediatrické dny s mezinárodní účastí
- Česko-slovenská pediatrie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Parenterální výživa
- Kdy vyšetřovat vrozená trombofilní rizika u dětí?
- Ovlivnění bolesti při stomatologickém ošetření dětí
- Cmúľanie prstov a jeho vplyv na vývoj tváre a dutiny ústnej v detskom veku
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy







