-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Prevalence a typ anémie v době stanovení diagnózy nespecifického střevního zánětu u dětí
Prevalence and type of anemia in IBD children at the time of diagnosis
Introduction:
Prevalence of anemia in inflammatory bowel disease (IBD) is high and it has an important impact of anemia on the quality of life, morbidity and mortality in these patients. Iron deficiency (ID), iron deficiency anemia (IDA), anemia of chronic disease (ACD) and combination of both of these conditions represent the most frequent causes. It can be difficult to distinguish ID in condition of inflammation. In fact, the common diagnostic test (iron, ferritin and transferin saturation) are significantly influenced by inflammation and normal ferritin concentration does not exclude ID. In this case soluble transferin receptor (sTfR) and calculated sTfR/F index (sTfR/log ferritin) can improve ID diagnose.Objective:
The aim of the study was: 1. to determine the total prevalence of anemia, 2. to determine the prevalence of the types of anemia (IDA, ACD, ACD/ID), and 3. to compare common laboratory test against sTfR and calculated sTfR/F index in diagnosis of iron deficiency in children at IBD onset.Methods:
Fifty-six patients with newly diagnosed IBD fulfilled the inclusion criteria in the period from January 2005 to December 2009: newly diagnosed IBD and upper age limit 19 years. In all patients were examined red blood count, serum iron, total iron binding capacity, ferritin, sTfR and calculated sTfR/F index. C-reactive protein >5 mg/l was determined as a marker for inflammation. Anemia was defined by hemoglobin value <-2 SD considering age and sex. Anemic patients were divided in three groups (IDA, ACD, ACD/ID) according to the results of common tests and sTfR and sTfR/F. Both methods were subsequently compared.Results:
Anemia was detected in 66.1% patients; significantly more frequent in Crohn’s disease (CD, 77.5%) and more frequent type of anemia were ACD and ACD/ID. Prevalence of anemia in ulcerative colitis (UC) patients was 37.5%, and there was detected only IDA. The difference in prevalence of IDA, ACD/ID and ACD between CD and UC was statistically significant. The agreement between both diagnostic methods was statistically significant in IDA (p<0.0001), the agreement in ACD/ID was reached in case of ferritin value <30 µg/l.Conclusion:
The prevalence of anemia in IBD children is high at the onset of the disease. Soluble TfR measurement and sTfR/F index calculation can improve ID diagnosis in condition of chronic inflammation.Key words:
anemia of chronic disease, iron deficiency anemia, iron deficiency, soluble transferin receptor, ferritin, children, inflammatory bowel disease
Autoři: A. Šuláková 1; O. Pozler 2; Nováčková L.† 3; D. Šalounová 4
Působiště autorů: Klinika dětského lékařství, FN Ostrava, přednosta doc. MUDr. M. Hladík, Ph. D., Dětská klinika, FN Hradec Králové , přednosta prof. MUDr. M. Bayer, CSc., Ústav klinické biochemie, FN Ostrava , přednosta RNDr. Z. Švagera, Ph. D., Ekonomická f 1
Vyšlo v časopise: Čes-slov Pediat 2012; 67 (1): 3-10.
Kategorie: Původní práce
Souhrn
Pozadí:
Prevalence anémie u nespecifických střevních zánětů (NSZ) je vysoká a významně ovlivňuje kvalitu života, morbiditu i mortalitu těchto nemocných. Deficit železa (ID = iron deficiency, IDA = iron deficiency anemia), chronický zánět (ACD = anemia of chronic disease) a nebo kombinace obou těchto stavů (ACD/ID) jsou její nejčastější příčinou. Diagnostika ID při současně probíhajícím zánětu může být obtížná. Tradiční parametry indikující deficit železa (sérové železo, saturace transferinu, feritin) jsou ovlivněny zánětem a jejich interpretace může být komplikovaná. Normální koncentrace feritinu při probíhajícím zánětu ID nevylučuje. Omezenou výpovědní hodnotu feritinu při koexistenci zánětu zlepší solubilní transferinový receptor (sTfR) a kalkulace sTfR/F indexu (sTfR/log feritin).Cílem studie bylo u dětí s NSZ při stanovení diagnózy:
1. zjistit celkovou prevalenci anémie, 2. zjistit prevalenci jednotlivých typů (ACD, IDA a ACD/ID), 3. porovnat v diagnostice anémie a deficitu železa tradičně užívané laboratorní testy s vyšetřením sTfR a sTfR/F indexem.Metody:
Do souboru bylo zařazeno 56 pacientů s nově diagnostikovaným NSZ v období mezi lednem 2005 a prosincem 2009. Kritéria pro zařazení do souboru byla: nově stanovená diagnóza NSZ splněním diagnostických kritérií a horní věková hranice 19 let. U všech nemocných byl vyšetřen kompletní krevní obraz, sérové železo, vazebné kapacity, feritin, sTfR a kalkulován sTfR/F index. Jako indikátor zánětu byl zvolen C-reaktivní protein >5 mg/l. Anémie byla definována hodnotou hemoglobinu -2 SD vzhledem k věku a pohlaví. Anemičtí pacienti byli rozděleni do 3 skupin (IDA, ACD/ID, ACD) podle výsledků tradičně užívaných parametrů a podle hodnot sTfR a sTfR/F indexu. Následně bylo provedeno porovnání obou metod.Výsledky:
Anémie byla zjištěna u 66,1 % pacientů, statisticky významně častěji u nemocných s Crohnovou nemocí (CN). U nemocných s ulcerózní kolitidou (UC) byla zjištěna pouze IDA (37,5 %), zatímco u CN byla zjištěna anémie u 77,5 % a převažovala ACD a ACD/ID. Rozdíl v prevalenci jednotlivých typů anémie byl mezi CN a UC statisticky významný.
Shoda v diagnóze mezi tradičními testy a testy s využitím sTfR/F indexu byla u IDA statisticky významná (p <0,0001), u ACD/ID shoda nastala při zvýšení cutoff feritinu na <20 µg/l. Zjistili jsme přesah hodnot sTfR mezi neanemickou a anemickou populací a jeho omezenou schopnost samostatně diagnostikovat ID ve srovnání s feritinem. Tento nedostatek byl odstraněn kalkulací sTfR/F indexu. ROC analýza prokázala výbornou diskriminaci pomocí sTfR/F indexu (1,00) a sTfR (0,95) pro ACD/ID a ACD. Cutoff sTfR/F byl 1,12.Závěr:
Studie potvrdila vysokou prevalenci anémie již v době manifestace nespecifického střevního zánětu a význam sTfR a sTfR/F indexu jako nezbytných doplňujících testů v diferenciální diagnostice deficitu železa v přítomnosti zánětu. Výtěžnost vyšetření podporuje širší využití této metody v gastroenterologických ambulancích.Klíčová slova:
anémie chronických nemocí, anémie z deficitu železa, deficit železa, solubilní transferinový receptor, feritin, děti, nespecifický střevní zánětÚvod
Anémie je častým příznakem závažného postižení gastrointestinálního traktu. U nespecifických střevních zánětů (NSZ) bývá přítomná již v době stanovení diagnózy, nebo vedoucím příznakem před abdominálními symptomy. Lze ji považovat více za součást klinického obrazu NSZ než za komplikaci [1]. Protože často probíhá „asymptomaticky“, nevěnuje jí adekvátní pozornost ani pacient, ani jeho ošetřující lékař. Termín asymptomatická však pouze odráží adaptaci nemocného na sníženou výkonnost a kvalitu života.
Prevalence anémie se udává mezi 6,2 % až 75 % u CN, v případě UC mezi 8,8 % až 66,6 % (81 % u dětí v době diagnózy UC) [2, 3, 9, 25, 26]. Rozdíly v prevalenci ovlivňuje studovaná populace (dospělí nebo děti, ambulantní nebo hospitalizovaní pacienti) a použitá kritéria [3]. Vyšší prevalence se uvádí ve starších studiích a u hospitalizovaných pacientů [3]. Závažná anémie (hemoglobin <100 g/l) se vyskytuje až u 1/3 pacientů a 30 % nemocných s NSZ má anémii trvale [1].
V etiopatogenezi dominují dvě příčiny: deficit železa (ID = iron deficiency) a chronický zánět. Anémie chronických nemocí (ACD, anemia of chronic disease) je důsledkem neefektivní erytropoézy a zkráceného přežívání erytrocytů. Aktivace prozánětlivých cytokinů (tumor necrosis factor-α, interferon-γ, interleukin (IL)-1 a IL-6) inhibuje erytropoézu a vede k dysfunkci distribuce a transportu železa do kostní dřeně (tzv. funkční deficit železa) [1, 3]. ACD provází chronické i akutní zánětlivé stavy, infekční a nádorová onemocnění. ID je nejčastěji důsledkem slizničního krvácení a malabsorpce, prevalence se udává 36–90 %, častější je u UC a u CN s postižením tlustého střeva [1, 2, 21]. U CN je častější koexistence obou stavů [1]. Diagnostika ID je esenciální, suplementace železa u IDA (iron deficiency anemia) může zlepšit kvalitu života nemocného s NSZ [8], ale u ACD, kde je nízké sérové železo projevem funkčního deficitu, může suplementace železa zhoršit průběh NSZ [5]. Diagnostika IDA je poměrně jednoduchá, obtíže nastávají při současně probíhajícím jiném onemocnění. Indexy červených krvinek (MCV – mean corpuscular volume, MCHC – mean corpuscular haemoglobin content), saturace transferinu a feritin jsou v přítomnosti zánětu málo spolehlivé parametry [19, 29]. Feritin je reaktant akutní fáze a při současném deficitu železa může být jeho koncentrace normální nebo zvýšená [18, 19]. Koncentrace feritinu <12 μg/l je vysoce specifická pro ID (98 %), ale má velmi nízkou senzitivitu (25 %), kterou lze zvýšit při cutoff <30 μg/l (92 %) [19, 29]. Vyšetření kostní dřeně, event. terapeutický test železem, je vyšetření senzitivní, ale invazivní, drahé a u dětských pacientů málo indikované. Udává se až 30% nepřesnost v hodnocení přítomnosti barvitelného železa v kostní dřeni [29]. Solubilní transferinový receptor (sTfR) je neinvazivní test, má vysokou senzitivitu pro ID a není ovlivněný zánětem [7, 9, 10, 19]. sTfR je ovlivněn stavem zásob železa, signalizuje přechod od vyčerpání zásob železa k depleci ve funkčním kompartmentu a odráží erytropoetickou aktivitu v kostní dřeni [4, 7, 9, 15, 30]. Nedostatek železa a zvýšená erytropoéza zvyšují sTfR i v přítomnosti chronického či akutního zánětu [6, 13], což umožňuje jeho využití v diagnostice ID u chronických nemocí [11]. Inverzní vztah mezi sTfR a feritinem a kalkulace jejich poměru (sTfR/log feritin = sTfR/F index) [4, 13, 22] zvyšuje senzitivitu i specificitu vyšetření ID [6, 7, 9, 17]. Pro ID je charakteristická vysoká hodnota sTfR a sTfR/F indexu ve srovnání s ACD [9]. Feritin <100 μg/l, saturace transferinu <16 % a sTfR/F index >2 jsou v přítomnosti zánětu velmi suspektní z deficitu železa [2, 7].
Cíl studie
Cílem studie bylo u dětí s NSZ při stanovení diagnózy zjistit:
- prevalenci anémie,
- prevalenci ID, IDA, ACD, ACD/ID,
- porovnat v diagnostice deficitu železa a anémie tradičně užívané laboratorní testy s vyšetřením sTfR a sTfR/F indexem.
Pacienti a metody
Charakteristika souboru
Do souboru bylo zařazeno 56 pacientů s nově diagnostikovaným NSZ v období mezi lednem 2005 a prosincem 2009, kteří splňovali diagnostická kritéria ČKSGE pro NSZ [20] (tab. 1) a byli mladší 19 let. Pacientům nebyla podána krevní transfuze ani léčba železem 4 měsíce před zařazením do studie. V souboru 56 nemocných byla častěji diagnostikována CN než UC. Průměrný věk v době stanovení diagnózy NSZ a zastoupení pohlaví jsou uvedeny v tabulce 2.
Tab. 1. Kritéria ČKSGE pro nespecifické střevní záněty. 
Tab. 2. Charakteristika souboru, prevalence a typ anémie u CN a UC. 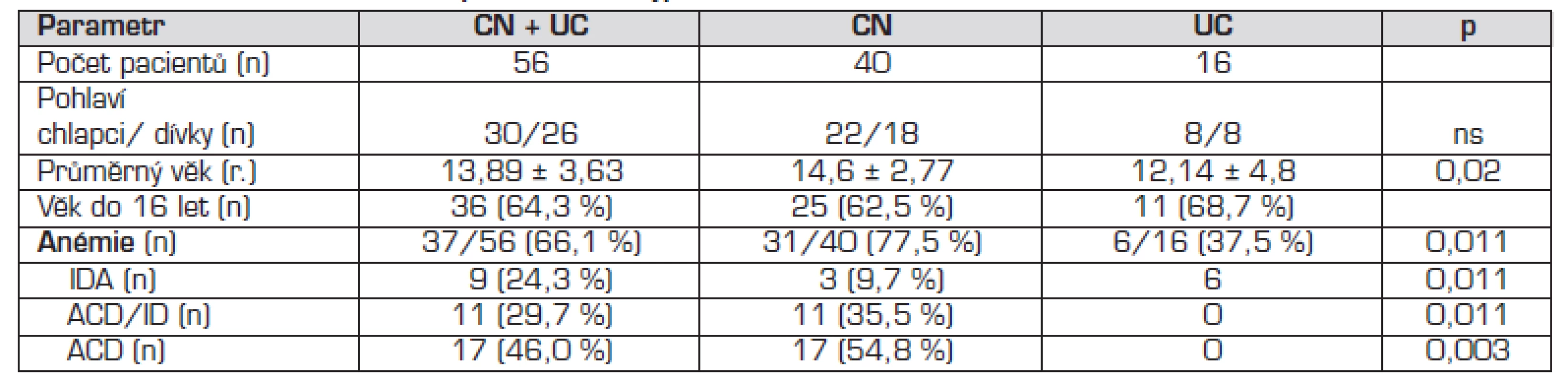
Metody
Laboratorní vyšetření proběhla v době stanovení diagnózy NSZ, kdy pacienti nevykazovali známky jiného akutního zánětlivého onemocnění. Od pacienta na lačno byl mezi 8.–10. hodinou získán vzorek venózní krve. V krevním vzorku byl vyšetřen krevní obraz a diferenciální rozpočet, CRP (mg/l) turbidimetrickou metodou DAKO Citomation (AuOlympus), železo (μmol/l) fotometrickým testem IRON, TPTZ metoda (2,4,6-tri(2-pyridyl)-5-triazin) typu „end point“ (Olympus Diagnostica/Beckman Coulter), vazebná kapacita železa (μmol/l) fotometrickou metodou (AuOlympus), feritin (μg/l) metodou chemiluminiscenční imunoanalýzy (LIA, luminiscenční imunoanalýza, Siemens), sTfR (mg/l) nefelometrickou metodou DADEBehring (Nefelometr BN 100). Matematický výpočet sTfR/F indexu byl proveden podle Punnonnena jako poměr sTfR k log feritinu [7].
Jako referenční hodnoty byly použity hodnoty hemoglobinu, sérového železa a feritinu uvedené v Nathan and Oski’s Hematology of Infancy and Childhood, 1998 (tab. 3A, 3B). Pro sTfR byla stanovena horní mez normálních hodnot 1,8 mg/l a pro CRP 5 mg/l podle referenčních hodnot laboratoře, pro feritin <20 μg/l signalizující ID u pacientů s NSZ [2, 11] a hodnoty sTfR/F indexu >2 pro IDA a <1 pro ACD.
Tab. 3A. Průměrné hodnoty a dolní limity normálních hodnot hemoglobinu, hematokritu a MCV v závislosti na věku. 
Tab. 3B. Hodnoty normálních hodnot feritinu, železa a saturace transferinu v závislosti na věku. 
Definice pojmů
- Anémie byla definována jako průměrná koncentrace hemoglobinu <-2 SD vzhledem k věku a pohlaví.
- Deficit železa (ID, iron deficiency) je definován podle Nutrition Examination Study III (NHANES III) [13, 18] jako přítomnost dvou ze tří následujících parametrů: feritin <10 μg/l, saturace transferinu <10 % a erytrocytární protoporfyrin >1,42 μmol/l. Erytrocytární protoporfyrin jsme nestanovovali, ID v naší studii je definován přítomností feritinu <10 μg/l a saturace transferinu <10 %.
- Anémie z deficitu železa (IDA)
- s využitím obvykle užívaných testů: Hemoglobin průměr <-2 SD vzhledem k věku a pohlaví, feritin <10 μg/l, saturace transferinu <10 %.
- s využitím sTfR: Hemoglobin průměr <-2 SD vzhledem k věku a pohlaví, hodnoty sTfR/F >2 a CRP <5 mg/l.
- Anémie chronických chorob (ACD)
- s využitím obvykle užívaných testů: Hemoglobin <-2 SD vzhledem k věku a pohlaví, feritin >20 μg/l, CRP >5 mg/l.
- s využitím sTfR: Hemoglobin průměr <-2 SD vzhledem k věku a pohlaví, hodnoty sTfR/F <1 a CRP >5 mg/l.
- Anémie chronických chorob kombinovaná s deficitem železa (ACD + ID)
- s využitím obvykle užívaných testů: Hemoglobin průměr <-2 SD vzhledem k věku a pohlaví, feritin <30 μg/l, CRP >5 mg/l.
- s využitím sTfR: Hemoglobin <-2 SD vzhledem k věku a pohlaví, sTfR/F >1, CRP >5 mg/l.
V tabulkách 3A a 3B jsou uvedeny průměrné hodnoty a dolní limity normálních hodnot hemoglobinu, hematokritu a MCV v závislosti na věku a hodnoty normálních hodnot feritinu, železa a saturace transferinu v závislosti na věku.
Statistické metody
Normální rozložení dat bylo testováno D’Agostino Pearsonovým omnibus testem. V případě normálního rozložení jsou výsledky vyjádřeny jako průměr ± standardní odchylka (SD), v opačném případě jako medián + IQR (interquartil range, tj. 25. percentil a 75. percentil). Srovnání mezi dvěma skupinami bylo provedeno Studentovým t-testem, srovnání více než dvou skupin bylo analyzováno metodou rozptylu ANOVA s Bonferroniho korekcí pro mnohočetná porovnávání nebo Kruskalovým-Wallisovým testem s korekcí podle Dunneho pro mnohočetná porovnávání. Hladina shody v počtu pacientů s diagnózou IDA při použití klasických laboratorních ukazovatelů a sTfR/F indexu byla testována pomocí McNammarova testu. Statistická významnost byla stanovena na hladině p = 0,05. Shoda diagnózy byla hodnocena Fisherovým testem.
Všechny statistické analýzy byly provedeny programem GrapPad5 Prism (GraphPad Software Inc., USA). Studie byla schválena etickou komisí FN v Ostravě. Informovaný souhlas s vyšetřením a studií byl získán buď od zákonných zástupců pacientů, nebo samotných pacientů.
Výsledky
Anémie
Anémie byla zjištěna u 37/56 (66,1 %) nemocných, statisticky významně častěji u CN. Výskyt jednotlivých typů anémie je uveden v tabulace 2. Deficit železa (IDA + ACD/ID) byl zjištěn u 20/56 (36 %) nemocných s NSZ, u CN 14/40 (35 %), 6/16 (37,5 %) u UC.
IDA
IDA byla detekována pomocí tradičních testů u 9/37 (24,3 %) anemických nemocných, 6/16 (37,5 %) u UC, 3/31 (9,7 %) u CN. S využitím sTfR/F indexu byla IDA stanovena u 7/37 (18,9 %). Shoda obou metod byla statisticky významná (p <0,0001).
ACD a ACD/ID
ACD byla diagnostikována tradičními testy při cutoff feritinu >20 μg/l u 21/37 (56,8 %), s využitím sTfR/F u 17/37 (46 %) anemických pacientů, zbylí čtyři nemocní byli tímto testem zařazeni jako ACD/ID. Shoda tradičních testů při cutoff feritinu >20 μg/l se sTfR/F byla statisticky významná (p <0,0001).
ACD/ID byla diagnostikována tradičními testy při cutoff feritinu <10 μg/l jen u 2/37 (5,4 %), s využitím sTfR/F indexu u 11/37 (29,7 %) anemických pacientů. Shoda metod nebyla statisticky významná (p = 0,12). Statisticky významná shoda nastala při zvýšení cutoff feritinu na <30 μg/l (u 12/37) (p <0,0001).
Feritin
U 11/37 (29,7 %) anemických pacientů byla koncentrace feritinu <10 μg/l (u všech s IDA a u dvou s ACD/ID). U 5/11 ACD/ID byl feritin >10 μg/l a u 4/11 20–30 μg/l. Cutoff pro odlišení ACD a IDA i pro odlišení ACD a ACD/ID byl 33 μg/l (senzitivita 100 %, specificita 94 %). Cutoff pro odlišení IDA a ACD/ID byl 8,7 μg/l (senzitivita 89 %, specificita 91 %).
sTfR
Koncentrace sTfR byly >1,8 mg/l u většiny nemocných s IDA a ACD/ID, u 3 nemocných s IDA byly v referenčním rozmezí. U ACD byly koncentrace sTfR u 11/17 v referenčním rozmezí a u 6/17 zvýšené. Koncentrace sTfR nebyly statisticky významně rozdílné mezi IDA a kombinovanou anémií ACD/ID, ale byly statisticky významně nižší u ACD proti ACD/ID a IDA (tab. 4).
Tab. 3. Metabolismus železa a CRP v jednotlivých skupinách. 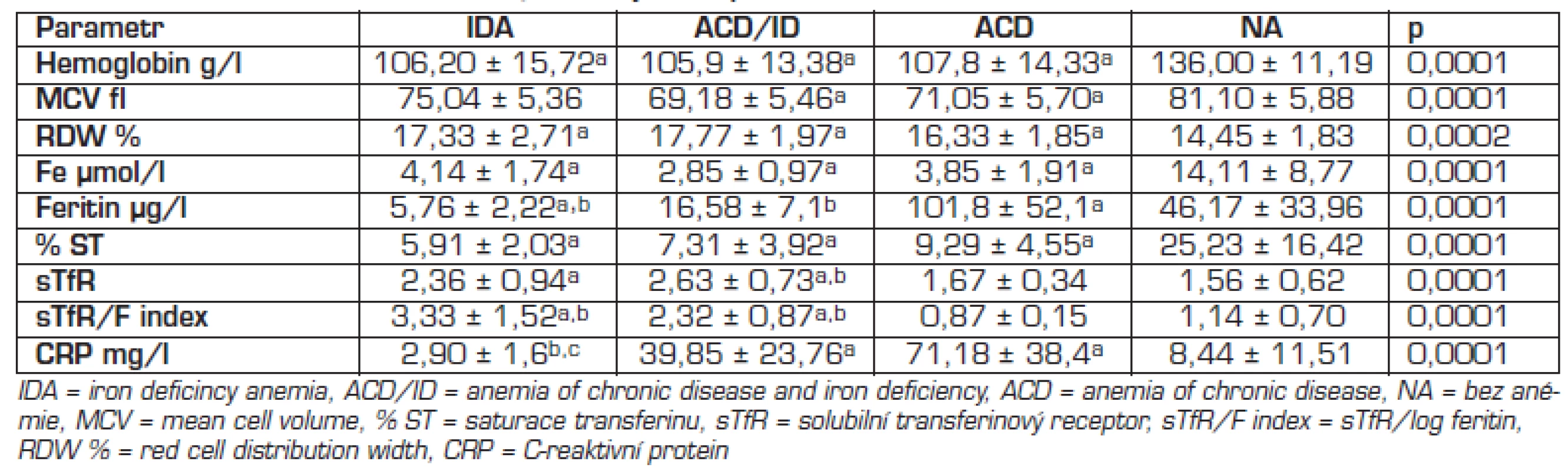
avýznamně odlišné od NA bvýznamně odlišné od ACD cvýznamně odlišné ACD/ID ROC analýza (tab. 5): cutoff 2,2 mg/l pro diskriminaci IDA a ACD měl 55,6% senzitivitu a 94% specificitu, koncentrace 1,8 mg/l měla 67% senzitivitu a 70% specificitu. Pro diskriminaci ACD a ACD/ID měl cutoff 2,2 mg/l 73% senzitivitu a 94% specificitu, cutoff 1,8 mg/l měl 100% senzitivitu a 70% specificitu.
Tab. 4. AUC<sup>ROC</sup> hodnoty (SE) parametrů metabolismu železa v diagnostice typu anémie. 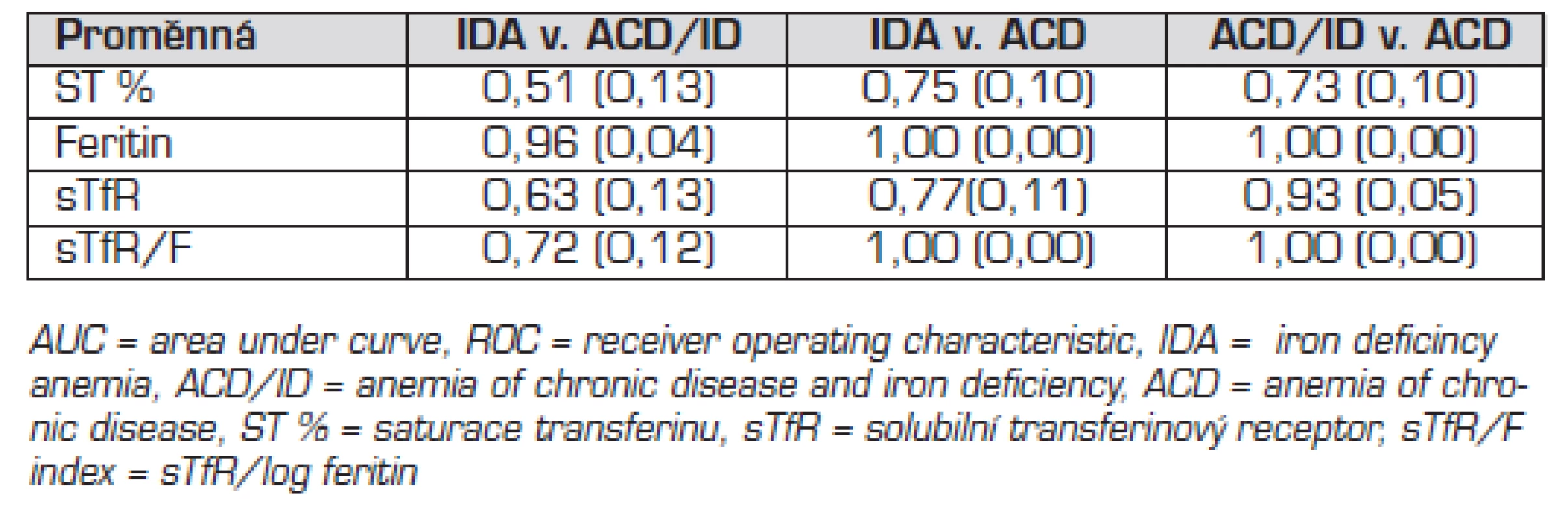
sTfR/F index
Hodnoty sTfR/F indexu byly statisticky významně vyšší u IDA a ACD/ID než u ACD a neanemických pacientů (tab. 4). Kalkulace sTfR/F zlepšila senzitivitu i specificitu diagnostiky ID v přítomnosti zánětu ve srovnání s izolovaným vyšetřením feritinu a sTfR (tab. 5). Rozdíl hodnot sTfR/F indexu mezi skupinami byl statisticky významný. Cutoff 2 pro diskriminaci IDA a ACD měl 77% senzitivitu a 100% specificitu. Cutoff 3 pro diskriminaci IDA a ACD/ID měl 56% senzitivitu a 91% specificitu. Cutoff 1,1 pro diskriminaci ACD/ID a ACD měl senzitivitu 100 % a specificitu 94 %. Porovnání ROC křivek pro sTfR, sTfR/F a feritin nezjistilo statisticky významný rozdíl (p = 0,12 až 1,00) s výjimkou porovnání křivek pro sTfR a feritin v případě diskriminace IDA a ACD/ID (p = 0,02).
Diskuse
Prevalence anémie u dětí s NSZ podle několika dostupných literárních údajů kolísá v rozmezí 41,3–78 % [9, 25, 26]. Anémie je v těchto publikacích různě definovaná: hematokrit <0,30 až <0,36, Hb <110 g/l nebo pro dívky <120 g/l a pro chlapce <125 g/l a v poslední uvedené publikaci Hb <-2 SD k průměrné hodnotě zdravé populace v USA, která se také jako jediná zabývá prevalencí anémie v době stanovení diagnózy NSZ u dětí [26]. Ostatní studie uvádějí prevalenci anémie u různě dlouho léčených pacientů (tab. 6). A tak skutečná hodnota prevalence není zcela jasná, protože tato jednotlivá data se liší jak definicí anémie, tak stadiem onemocnění, ve kterém byla prevalence anémie stanovena.
Tab. 5. Prevalence anémie u dětí s IBD – přehled studií. 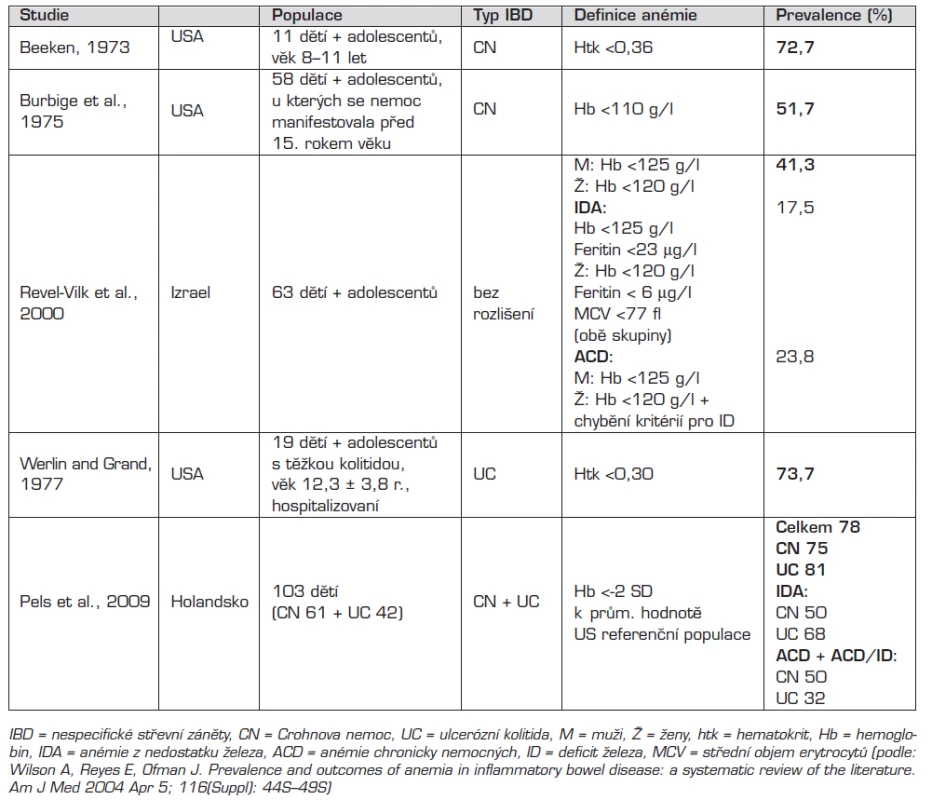
Námi zjištěná prevalence anémie 66,1 % v celém souboru a 77,5 % ve skupině s CN odpovídá literárním údajům o prevalenci anémie u dětí s NSZ, u nemocných s UC pak byla prevalence nižší (37,5 %) [2, 3, 25, 26]. Prevalence IDA, ACD/ID a ACD činila 24 %, 30 % a 46 % v tomto pořadí.
Pels et al. uvádějí prevalenci IDA u dětí v době manifestace NSZ 50 % u CN a v případě UC 68 % [26]. Autoři také prokázali, že s délkou onemocnění NSZ stoupá výskyt IDA a klesá ACD (s/bez ID). V našem souboru pacientů s NSZ jsme prokázali výrazně nižší prevalenci IDA (9 z 37 (24 %) anemických pacientů, u CN 10 % a v případě UC 37,5 %) v době manifestace onemocnění ve srovnání s touto prací (p = 0,0013). Na druhou stranu jsme v naší studii zachytili procentuálně vyšší zastoupení pacientů s ACD (s/bez ID) u nemocných s CN (90 %). Nižší prevalence IDA a vyšší prevalence ACD v souboru našich pacientů by mohla ukazovat na diagnostiku v časnějším stadiu onemocnění u našich pacientů s nižším zastoupením nemocných s UC, u kterých je uváděna vyšší prevalence IDA [1, 21]. Prevalenci IDA v době stanovení diagnózy NSZ mohou ovlivňovat i další faktory, jako je množství železa ve stravě a aktuální potřeba železa (zvýšená v období intenzivního vývoje a růstu).
Rozdíly v prevalenci anémie mezi studiemi mohou vysvětlit použitá kritéria, velikost a charakter souboru a doba trvání NSZ v době hodnocení anémie [3, 7, 9, 24, 28]. Intenzivnější a agresivnější terapie NSZ může vysvětlit snížení výskytu anémie, zejména ACD.
Diagnostika IDA není obtížná, problémy nastávají při současně probíhajícím zánětu (ACD/ID), kdy feritin jako reaktant akutní fáze může být normální nebo zvýšený [16, 19]. Zvýšením cutoff feritinu na <30 μg/l v naší studii stoupla jeho senzitivita na 100 %, specificita byla 94 %. Cutoff feritinu pro ACD/ID se ve studiích udává mezi 20–50 μg/l [9, 11, 12, 19, 27]. V naší studii byl ve skupině s ACD/ID feritin <20 μg/l u 5/11 a <30 μg/l u 4/11 nemocných. Interval 20–100 μg/l je tzv. šedá zóna, feritin >100 μg/l současný ID vylučuje [1, 4, 5, 6, 9, 23, 27]. V naší studii byly hodnoty feritinu v šedé zóně u 13/17 ACD a u 4/17 ACD byly >100 μg/l. Při probíhajícím zánětu je feritin málo spolehlivý parametr pro diagnostiku ID a je vhodné použít další biochemický parametr, sTfR.
Koncentrace sTfR v naší studii byly u nemocných s ACD a u nemocných bez anémie v referenčním intervalu laboratoře, u obou skupin s ID byly hodnoty zvýšené. Průměrné koncentrace sTfR u ACD/ID i IDA přesahovaly zjištěné cutoff 2,2 mg/l. Pozorovali jsme přesah hodnot sTfR: u 3/11 ACD/ID byly koncentrace <2,2 mg/l a u 3/9 s IDA byly dokonce v referenčním intervalu. Naopak u 2 nemocných bez anémie a známek ID a u 4/17 ACD byly koncentrace sTfR zvýšené. Přesah hodnot sTfR mezi zdravou a anemickou populací se v literatuře popisuje [19]. ROC analýza prokázala dobrou schopnost sTfR diskriminovat ID při zánětu, ale byla nižší ve srovnání s cutoff feritinu <20 μg/l. Hodnoty AUCROC pro sTfR byly s výjimkou diskriminace ACD/ID a ACD nižší než v relevantní studii [7]. Příčinou může být odlišná metodika stanovení sTfR (metodika vyšetření sTfR dosud není standardizována), závažnost ID v době diagnostiky NSZ, přesah hodnot sTfR mezi zdravou a ID populací. Lze spekulovat o negativním vlivu cytokinů na erytropoézu a následně na koncentraci sTfR i při ID [13] a vlivu věku [13–16, 22]. Vyšší koncentrace sTfR jsou u malých dětí (u novorozenců pro vysokou erytropoetickou aktivitu, u kojenců a malých dětí v souvislosti s častým deficitem železa). Hodnot dospělých dosahují děti od 16 let. Referenční intervaly pro věkové kategorie však dosud nebyly standardizovány. Dále některé studie uvádějí horší asociaci sTfR s ID i u jinak zdravé populace [13, 14]. Závislost na pohlaví byla popsána u dětí do 6 měsíců věku [16]. Kalkulací sTfR/F indexu jsme dosáhli výborné diskriminace mezi jednotlivými typy anémie (AUCROC = 1,00). Tyto výsledky odpovídají některým literárním údajům [7, 9, 11], jiné prameny takovéto výsledky nepotvrzují [12]. Diagnostika IDA tradičně užívanými testy byla ve shodě s diagnostikou pomocí sTfR/F, v případě ACD/ID nastala shoda při zvýšení cutoff feritinu na <30 μg/l, využití sTfR/F v diagnostice v tomto případě bylo nezbytné.
Závěr
Studie zjistila vysokou prevalenci anémie v době stanovení diagnózy, ale současně nižší prevalenci IDA ve srovnání s relevantní studií [26].
Pro diagnostiku ID u NSZ je nutné zvolit vyšší cutoff feritinu <30 μg/l. sTfR/F index <1 svědčí pro ACD, >2 pro IDA, cutoff >1,1 pro odlišení ACD/ID a ACD. sTfR v diagnostice ID nenahrazuje feritin, ale jako další biochemický parametr, který není ovlivněn zánětem, upřesňuje diagnostiku ID, eliminuje vliv zánětu a kalkulací sTfR/F indexu také eliminuje překrývání hodnot sTfR. sTfR/F index v kombinaci s CRP jako parametrem zánětu zvyšuje senzitivitu i specificitu diagnostiky ID u nemocných s NSZ. sTfR/F index považujeme za nezbytný parametr v diagnostice ID u chronických nemocí. Eliminuje chybnou interpretaci laboratorních hodnot a umožní správně vytypovat nemocné s rizikem přetrvávajícího ID a stanovit vhodnou dobu pro suplementační léčbu. Dostupnost metody umožňuje její širší využití i v gastroenterologické ambulantní praxi.
Došlo: 2. 5. 2011
Přijato: 31. 8. 2011
MUDr. Astrid Šuláková
KDL FN Ostrava
17. listopadu 1790
708 52 Ostrava-Poruba
e-mail: astrida.sulakova@fnspo.cz
Zdroje
1. Gasche C, Lomer MC, Cavill I, Weiss G. Iron, anaemia, and inflammatory bowel disease. Gut 2004; 53(8): 1190–1197.
2. Kulnigg S, Gasche C. Systemic review: managing in Crohn disease. Aliment Pharmacol Ther 2006; 24 : 1507–1523.
3. Wilson A, Reyes E, Ofman J. Prevalence and outcomes of anemia in inflammatory bowel disease: a systematic review of the literature. Am J Med 2004 Apr5;116(Suppl): 44S–49S.
4. Suominen P, Punnonen K, Rajamäki A, et al. Serum transferin receptor and transferin receptor-ferritin index identify healthy subject with subclinical iron deficits. Blood 1998; 92(8): 2934–2939.
5. Oldenburg B, et al. Review article: Iron and inflammatory bowel disease. Aliment Pharmacol Ther 2001; 15(4): 429–438.
6. Malope BI, et al. The ratio of serum transferin receptor and serum ferritin in the diagnosis of iron status. Br J Hematol 2001; 115 : 84–89.
7. Punnonen K, et al. Serum transferin receptor and its ratio to serum ferritin in the diagnosis of iron deficiency. Blood 1997; 89(3): 1052–1057.
8. Wells ChW, Lewis S, Barton, JR, et al. Effects of changes in haemoglobin level on quality of life and cognitive function in inflammatory bowel disease patients. Inflamm Bowel Dis 2006; 12(2): 123–130.
9. Revel-Vilk, S et al. Serum transferin receptor in children and adolescent with inflammatory bowel disease. Eur J Pediatr 2000; 159 : 585–589.
10. Punnonen K, Irjala K, Rajamäki A. Iron-deficiency anemia is associated with high concentrations of transferrin receptor in serum. Clin Chem 1994; 40(5): 774–776.
11. Wians FH, et al. Discriminating between iron deficiency anemia and anemia of chronic disease using traditional indices of iron status vs transferin receptor concentration. Am J Clin Pathol 2001; 115 : 112–118.
12. Markovič M, et al. Usefulness of soluble transferrin receptor and ferritin in iron deficiency and chronic disease. Scand J Clin Lab Invest 2005; 65 : 571–576.
13. Ooi Cara L, et al. Pediatric reference intervals for soluble transferrin receptor and transferrin receptore-ferritin index. World J Pediatr 2009; 5(2): 122–126.
14. Chouliarasa GL, et al. Serum transferrin receptors: distribution and diagnostic perforance in pre-school children. Blood Cells, Molecules, and Diseases 2009; 43(2): 163–168.
15. Virtanen MA, et al. Higher concentrations of serum transferrin receptor in children than in adults. Am J Clin Nutr 1999; 69 : 256–260.
16. Choi JW, et al. Change in transferin receptor concentrations with age. Clin Chem 1999; 45(9): 1562–1563.
17. Margetic S, et al. Soluble treansferin receptor and transferrin receptor-ferritin index in iron deficiency anemia and anemia in rheumatoid arthritis. Clin Chem Lab Med 2005; 43(3): 326–331.
18. Looker AC, Dallman PR, Carroll MD, et al. Prevalence of iron deficiency in the United States. JAMA 1997; 26(12): 973–976.
19. Mast AE, et al. Clinical utility of the soluble transferin receptor and comparison with the serum ferritin in several populations. Clin Chemist 1998; 44 : 45–51.
20. Malý J. Diagnostika a následná péče o děti s nespecifickými střevními záněty. Pediatrie pro Praxi 2004; 1 : 7–9.
21. Mamula P, et al. Total dose intravenous infusion of iron dextran for iron-deficiency anemia in children with inflammatory bowel disease. J Pediatr Gastroenterol Nutr 2002; 34(3): 286–290.
22. Dimitriou H, Stiakaki E, Markak EA, et al. Soluble transferrin receptor levels and soluble transferin/log ferritin index in the evaluation of erythropoietic status in childhood infections and malignancy. Acta Paediat 2000; 89 : 1169–1173.
23. Zhu A, Kaneshiro M, Kaunitz JD. Evaluation and treatment of iron deficiency anemia: a gastroenterological perspective. Dig Dis Sci 2010; 55 : 548–559.
24. Vijverman A, Piront P, Brlaiche J, Louis E. Evolution of the prevalence and characteristics of anemia in inflammatory bowel diseases between 1993 and 2003. Acta Gastroenterol Belg 2006; 69(1): 1–4.
25. Pels LPM, van de Vijver E, Waalkens HJ, et al. Slow hematological recovery in children with IBD-associated anemia in cases of „Expectant Management“. JPGN 2010; 51(6): 708–713.
26. Pels LPM, van de Vijver E, Waalkens H, et al. IBD-associates anemia in children: controlling intestinal inflammation is not enough to normalize hemoglobin. Abstract P083 in the congress book reports interim results. Paris: PIBD 2009.
27. Schilling RF. Anemia of chronic disease: A misnomer (editorials). Ann Inter Med 1991;115(7): 572–573.
28. Schreiber S, Howaldt S, Schnoor M, et al. Recombinant erythropoietin for the treatment of anemia in inflammatory bowel disease. N Engl J Med 1996; 334(7): 619–623.
29. Koulaouzidis A, Said E, Cottier R, Saeed AA. Soluble transferin receptors and iron deficiency, a step beyond ferritin. A systemic review. J Gastrointestin Liver Dis 2009; 18(3): 345–352.
30. Suominen P, Virtanen A, Lehtonen-Veromaa M, et al. Regression-based reference limits for serum transferin receptor in children 6 months to 16 years of age (technical briefs). Clin Chem 2001; 47(5): 935–937.
Štítky
Neonatológia Pediatria Praktické lekárstvo pre deti a dorast
Článek Parenterální výživa
Článok vyšiel v časopiseČesko-slovenská pediatrie
Najčítanejšie tento týždeň
2012 Číslo 1- fSCIG v reálnej klinickej praxi u pacientov s hematologickými malignitami
- Facilitovaná subkutánna imunoglobulínová terapia u seniorov s imunodeficitmi v reálnej praxi
- I „pouhé“ doporučení znamená velkou pomoc. Nasměrujte své pacienty pod křídla Dobrých andělů
- Rizikové období v léčbě růstovým hormonem: přechod mladých pacientů k lékařům pro dospělé
-
Všetky články tohto čísla
- Vliv matrixových metaloproteináz na hojení ran po operaci vrozeného rozštěpu rtu
- Koncentrácia olova v krvi a alergénová senzibilizácia detí predškolského veku v dvoch regiónoch Slovenska
- Thymidin kináza – vhodný marker pro diagnostiku a sledování leukémií dětského věku
- Nárast polinózy u školskej mládeže v meste a na vidieku za posledných 20 rokov (1988–2009)
- Prevalence a typ anémie v době stanovení diagnózy nespecifického střevního zánětu u dětí
- Mikrodeleční syndrom Xp21: Závažná příčina selhání nadledvin, svalové dystrofie, poruchy hladin krevních lipidů a vývojové retardace u dvouměsíčního neprospívajícího kojence
- Ostravský den preventivní pediatrie 16. března 2012, Ostrava (Clarion Congress Hotel)
- Ligneózna konjunktivitída, hydrocefalus a protrahované respiračné infekcie u pacienta s deficitom plazminogénu
- Cmúľanie prstov a jeho vplyv na vývoj tváre a dutiny ústnej v detskom veku
- Ovlivnění bolesti při stomatologickém ošetření dětí
- Parenterální výživa
- Kdy vyšetřovat vrozená trombofilní rizika u dětí?
- Perspektiva dětské lůžkové péče v České republice v roce 2011
- Zkušenosti s dlouhodobou neakutní péčí o dítě s postižením ve Strančicích
- Nedožitých 89 rokov profesora Birčáka
- XVII. Moravskoslezské pediatrické dny s mezinárodní účastí
- Česko-slovenská pediatrie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Parenterální výživa
- Kdy vyšetřovat vrozená trombofilní rizika u dětí?
- Ovlivnění bolesti při stomatologickém ošetření dětí
- Cmúľanie prstov a jeho vplyv na vývoj tváre a dutiny ústnej v detskom veku
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



