-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Thymidin kináza – vhodný marker pro diagnostiku a sledování leukémií dětského věku
Thymidin kinase – suitable marker for diagnostics and follow up in childhood leukemia
Background:
Diagnosis of leukemia may be complicated due to the polyvalent symptoms in childhood. In this study, our goal was to determine the potential for early diagnosis of leukemia or relapse using the proliferation marker thymidine kinase 1 (TK1).Methods:
In the group of 58 children diagnosed with leukemia, we monitored levels of TK1 at the time of diagnosis, during and after therapy using radioenzymatic assay. Control group included 109 children with benign diseases displaying clinical symptoms similar to leukemia.Results:
We demonstrated the difference in the levels of TK1 at the diagnosis of leukemia compared to patients with other benign diseases (p<0.0001). We also observed that after completing treatment of leukemia, each patient achieved certain basal level of TK1, and the future increase above this basal level (after exclusion of viral infection and hepatopathy) was significant for prediction of a relapse, which often followed 3 to 9 months after the elevation of TK1 (p<0.03).Conclusions:
Our study shows that TK1 is a suitable proliferation marker for diagnostics and follow up in pediatric patients with leukemia.Key words:
thymidin kinase, childhood leukemia, diagnostic marker
Autori: T. Votava 1; Z. Černá 1; L. Šašek 1; L. Doležalová 1; J. Kobr 1; O. Topolčan 2
Pôsobisko autorov: Dětská klinika, FN Plzeň a Univerzita Karlova v Praze, Lékařská fakulta v Plzni, přednosta doc. MUDr. J. Kobr, Ph. D., Oddělení nukleární medicíny Bory, FN Plzeň a Univerzita Karlova v Praze, Lékařská fakulta v Plzni , primář MUDr. D. Slípková 1
Vyšlo v časopise: Čes-slov Pediat 2012; 67 (1): 23.
Kategória: Původní práce
Súhrn
Úvod:
Diagnostika leukémie může být komplikovaná vzhledem k polyvalentním klinickým příznakům v dětském věku. V této práci jsme se snažili zjistit, zda lze pro včasnou diagnostiku leukémie nebo jejího relpasu využít proliferační marker thymidin kinázu 1 (TK1).Soubor a metody:
V souboru 58 dětí s diagnózou leukémie jsme monitorovali hodnoty TK1 při diagnóze, v průběhu léčby a po dokončení terapie pomocí radioenzymatické metody. Jako kontrolní skupinu jsme zvolili 109 dětí s nemaligními onemocněními s obdobnými klinickými příznaky jako při primární diagnóze leukémie.Výsledky:
Podařilo se nám v našem souboru pacientů prokázat rozdíl v hladinách TK1 při stanovení diagnózy leukémie oproti pacientům s jiným nemaligním onemocněním (p <0,0001). Zároveň jsme zjistili, že hladina TK1 po dokončené terapii leukémie dosáhla určité bazální hladiny u každého pacienta a že zvýšení nad tuto bazální hladinu (po vyloučení virové infekce a hepatopatie) v našem souboru predikovalo relaps, který nejčastěji následoval za 3 až 9 měsíců po elevaci hladiny TK1 (p <0,03).Závěr:
Naše studie prokazuje, že TK1 je klinicky použitelný proliferační marker při diagnostice a monitoraci dětských pacientů s leukémií.Klíčová slova:
thymidin kináza, dětská leukémie, diagnostický markerÚVOD
Jedním z atributů dětského věku je růst. Během dětského období několikrát dojde k prudkému zrychlení a zpomalení růstového tempa, což je dáno převážně hormonálními vlivy. Vlastní růst je charakterizován výraznou proliferační aktivitou buněk organismu. Kromě výše zmíněné, zcela fyziologické proliferační aktivity však může v organismu docházet k proliferacím patologickým, například při nádorovém bujení, zánětech nebo při reparačních procesech ve tkáních apod. Někdy je obtížné tyto proliferační procesy od sebe odlišit nebo je monitorovat za pomoci laboratorních markerů. Uvedené stavy lze v určitých případech monitorovat specifickými laboratorními markery, např. u bakteriálního zánětu se osvědčila hodnota C-reaktivního proteinu, interleukinu-6, interleukinu-8, prokalcitoninu apod., u některých typů nádorového bujení plní obdobnou funkci nádorové markery [1] a u růstu organismu jako celku například inzulinu podobný růstový faktor 1 [2, 3]. V dětské hematoonkologii je monitorace patologických proliferačních procesů komplikovanější pro možnou interferenci s fyziologickým růstem organismu. Jako vhodný marker u hematoonkologických onemocnění se jeví thymidin kináza (izoenzym TK1), která dobře koreluje s proliferační aktivitou onemocnění. Informace o TK1 u dětských pacientů s leukémií jsou v literatuře ojedinělé.
TK1 je enzym, který je přítomen v cytoplazmě dělících se buněk a jeho hladina je závislá na fázi buněčného cyklu [4]. Funkcí TK1 je katalyzovat reakci, při níž vzniká deoxythymidin-monofosfát (dTMP) takzvanou pyrimidinovou záchrannou cestou, která se aktivuje až v případě zahlcení nebo nefunkčnosti klasické cesty de novo syntézy dTMP z deoxyuridin-monofosfátu (dUMP) za přítomnosti kyseliny listové a vitaminu B12. dTMP vzniklý klasickou nebo záchrannou cestou je poté vmezeřen do nově syntetizované DNA [5].
V tomto sdělení předkládáme souhrn klinických dat a výsledků monitorace TK1 u 58 dětských pacientů s leukémií léčených na našem pracovišti.
SOUBOR PACIENTŮ A METODIKA
Soubor pacientů tvořilo 58 dětí s diagnózou leukémie (35 chlapců, 23 dívek; průměrný věk 7 let). V tomto souboru bylo zahrnuto 48 pacientů s akutní lymfoblastickou leukémií (ALL), čtyři pacienti s akutní myeloidní leukémií (AML), dva pacienti s chronickou myeloidní leukémií (CML), 2 pacienti s akutní hybridní leukémií (AHL), 1 pacient s juvenilní myelomonocytární leukémií (JMML) a 1 pacient s AML při Downově syndromu. Relaps onemocnění se vyskytl u 6 dětí, z toho u jedné pacientky 2krát, v souboru zemřelo 5 dětí (všechny v souvislosti s progresí základního onemocnění). Kontrolní soubor tvořilo 109 pacientů s nemaligním onemocněním vyšetřených a sledovaných na Dětské klinice FN Plzeň. Zastoupení jednotlivých diagnóz v kontrolním souboru uvádí tabulka 2. Průměrná doba sledování byla 5,8 roků. U žádného ze sledovaných dětí v kontrolním souboru pacientů se během sledování nevyvinulo žádné hematoonkologické ani onkologické onemocnění. Zařazení pacientů do studie bylo prováděno na základě informovaného souhlasu jejich zákonných zástupců. Studie byla schválena lokální etickou komisí FN Plzeň.
Enzymatická aktivita TK1 byla stanovena pomocí radioenzymatické metody využívající radiododeoxyuridin, u kterého byla methylová skupina thymidinu nahrazena radioaktivním 125I. Tento substrát je katalyzován TK1 a uvolněná radioaktivita odpovídá množství enzymu v séru (Immunotech Praha). Všichni pacienti v souboru měli proveden vstupní odběr hladiny TK1 při stanovení diagnózy leukémie a následně v průběhu léčby a po jejím dokončení každých 3–6 měsíců.
Porovnání dat ze sledovaných kohort pacientů bylo zpracováno statisticky metodikou neparametrické ANOVY.
Naším cílem bylo zjistit význam hladiny TK1 pro diagnostiku leukémie, dále zda koreluje TK1 s prognózou pacientů a zda lze TK1 využít jako marker pro časnou diagnostiku relapsu leukémie.
VÝSLEDKY
V souboru pacientů s leukémiemi jsme zjistili výrazné zvýšené hladiny TK1 v okamžiku stanovení diagnózy. Jednalo se o 40násobné zvýšení v porovnání s normou (do 8 IU/l) a při porovnání s kontrolní skupinou pacientů se jednalo o statisticky významnou elevaci TK1 (p <0,0001) (tab. 1).
Tab. 1. Hladiny TK1 u skupiny pacientů s leukémiemi. 
Kontrolní soubor vykazoval nejvyšší hladiny TK1 u pacientů s virovými infekcemi, kde byla elevace TK1 6krát vyšší než norma, u ostatních onemocnění v kontrolním souboru byly hladiny TK1 výrazně nižší (tab. 2).
Tab. 2. Hladiny TK1 u kontrolní skupiny pacientů s benigními onemocněními. 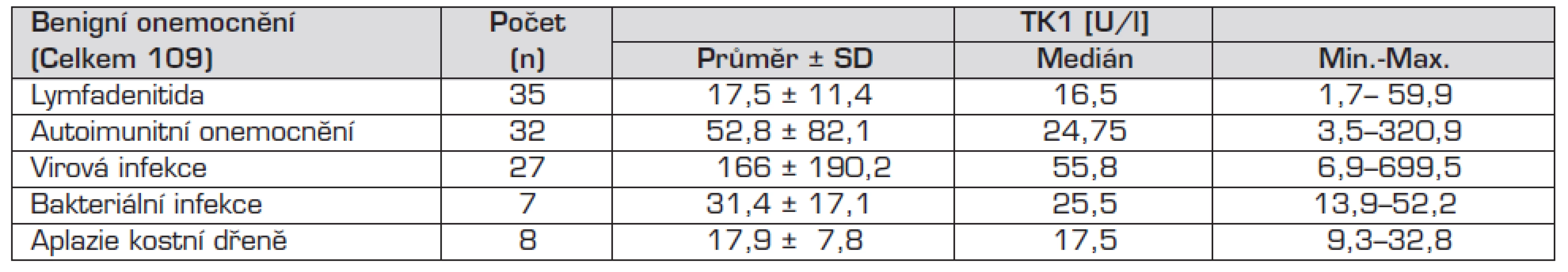
V průběhu sledování došlo k 7 relapsům leukémie u 6 dětí a k 5 úmrtím. V souboru bylo dosaženo 3letého přežití v 92,4 %, ale vzhledem k velmi málo událostem (relaps, úmrtí) nebylo možno hodnotit prognostický význam hladiny TK1 zjištěné v okamžiku diagnózy.
Při hodnocení významu hladiny TK1 pro období sledování po dokončené cytostatické terapii bylo zjištěno zvýšení TK1 předcházející o 3–9 měsíců relapsu onemocnění. Toto zvýšení TK1 bylo při porovnání s kontrolní skupinou hodnoceno jako statisticky významné (p <0,02535) (tab. 3).
Tab. 3. Hladiny TK1 u skupiny pacientů s relapsy onemocnění. 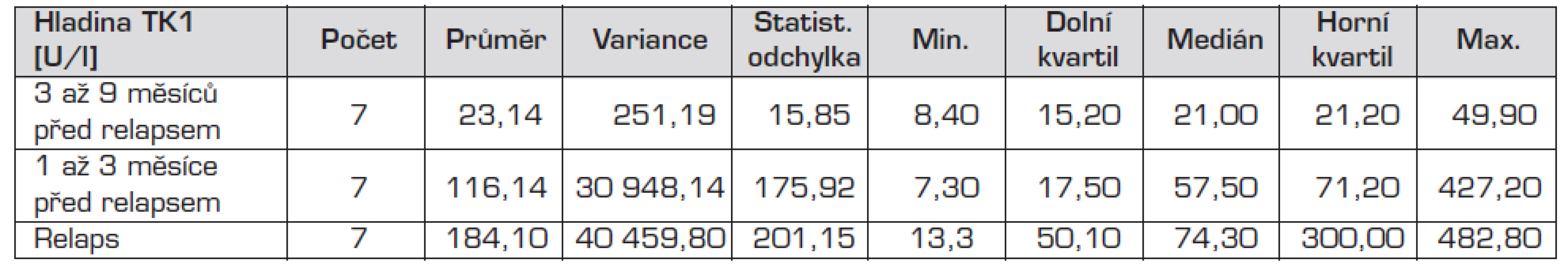
DISKUSE
Monitorace dětských pacientů s leukémiemi pomocí nehematologických proliferačních markerů není příliš rozšířená, ale z hlediska včasného záchytu diagnózy nebo relapsu je vhodná [6]. Prognóza pacientů s leukémií je významně závislá na vlastním typu a biologickém chování nádorového bujení, ale je zřejmé, že část pacientů je z různých příčin diagnostikována pozdě (několik týdnů až měsíců) od začátku klinických obtíží souvisejících s leukémií. Tito pacienti by mohli profitovat z včasnější diagnostiky onemocnění.
Význam markerů jako je TK1 lze využít při obtížích s diagnostikou leukémie, neboť ta se může projevovat v dětském věku velmi polyvalentními obtížemi, jako jsou bolesti kloubů a kostí, teplota, únava, bolesti břicha, respirační infekce apod., což může oddálit včasné stanovení správné diagnózy. Někdy se u dětí také setkáváme s tzv. doutnající formou leukémie, kdy hodnoty v běžně vyšetřovaných hematologických parametrech mohou vykazovat pouze minimální změny. Stanovení správné diagnózy se pak oddaluje až o několik týdnů do doby, kdy se onemocnění klinicky jednoznačně manifestuje, teprve poté je provedeno vyšetření kostní dřeně a stanovena správná diagnóza. V takovýchto případech další nehematologický marker může urychlit rozhodnutí o provedení vyšetření kostní dřeně a tím přispět k dřívějšímu stanovení diagnózy. Naše výsledky jsou obdobné jako u O’Neill et al., kde u 29 dospělých pacientů s ALL bylo zvýšení TK1 při diagnóze statisticky signifikantní [7]. V našem souboru pacientů byla senzitivita parametru TK1 pro diagnostiku leukémie 85 % při doporučené specificitě 95 %, což pro rozhodování o dalším invazivním vyšetřování pacienta považujeme za akceptovatelné.
Hodnocením prognostického významu TK1 u leukémií se zabývali pouze Sadamori et al., kteří se však zaměřili pouze na podskupinu ALL z T buněk, kde u 52 dospělých pacientů korelovala TK1 s délkou přežití [8].
V našem souboru nebylo možné provést porovnání hladin TK1 a molekulárně genetických cílů na leukemických buňkách, jejichž rutinní monitorace je až otázkou poslední doby. V literatuře rovněž nejsou publikována data porovnávající u leukémií monitoraci nádorových markerů s minimální zbytkovou nemocí. Význam molekulárně genetických cílů dominuje v časném období po stanovení diagnózy leukémie (cca první 3 měsíce), kdy napomáhají při stratifikaci pacientů do rizikových skupin. V následujícím období již tyto cíle nebývají rutinně monitorovány stejně jako v období po ukončení léčby. V tomto období se nám osvědčilo monitorování proliferační aktivity pomocí TK1 při znalosti omezení výpovědní hodnoty dané falešně pozitivním zvyšováním hladiny TK1 u virových infekcí a hepatopatií. Podařilo se nám prokázat, že zvýšení hladiny TK1 v tomto období může včas poukázat na následný rozvoj relapsu onemocnění, což jsou data dosud publikována pouze naší skupinou. Domníváme se, že naše pozorování podporuje význam použití proliferačního markeru jako je TK1 i v éře molekulárně genetického sledování minimální zbytkové nemoci u ALL. Největší význam spatřujeme v monitoraci po dokončení vlastní cytostatické léčby. Tento význam podporuje i výrazně nižší cena a menší pracnost provedení TK1 testu ve srovnání s molekulárně genetickými metodami, které se zatím rutinně v pediatrii používají pouze při follow up po transplantaci kmenových buněk, nikoliv však po konvenční léčbě leukémie [9].
ZÁVĚR
Ve skupině 58 dětí s leukémiemi se nám podařilo jednoznačně prokázat, že vyšetřením TK1 po vyloučení virové infekce lze v rámci diferenciální diagnostické rozvahy s velkou jistotou (p <0,0001) rozlišit pacienty s leukémií od pacientů s jinými onemocněními, které mohou mít podobné klinické příznaky jako leukémie (v našem případě to byly lymfadenitida, autoimunitní onemocnění, bakteriální infekce a aplazie kostní dřeně). Senzitivita hladiny TK1 byla 85 % při 95% specificitě. Vzhledem k malému počtu událostí (relaps, úmrtí) ve sledované skupině nebylo možné TK1 hodnotit z prognostického hlediska. Podařilo se nám prokázat, že TK1 je v období po skončení chemoterapie vhodným markerem pro monitoraci a časný záchyt relapsu onemocnění, a to v období 3–9 měsíců před jeho klinickou manifestací (p <0,02535).
Leukémie – diagnostický algoritmus užívaný na našem pracovišti
Při podezření na leukémii (klinickém nebo laboratorním) – je vhodné mimo jiné provést screeningové virologické vyšetření (EBV, CMV, parvovirus B19, HHV6, adenovirus), jaterní testy a vyšetření TK1. V případě průkazu aktivní virové infekce nebo elevace jaterních transamináz nad 5 µkat/l ztrácí vyšetření TK1 smysl vzhledem k vysoké pravděpodobnosti falešně pozitivního výsledku [10, 11, 12]. V případě negativní virologie a normálních jaterních testů je diagnóza leukémie pravděpodobná při hladině TK1 nad 200 IU/l, a to se senzitivitou 81 % a specificitou 96 %. Při hodnotách nad uvedené cut off a negativní virologii u dítěte bez hepatopatie je vhodné ihned provést cytologické vyšetření kostní dřeně k definitivnímu potvrzení diagnózy leukémie.
Leukémie – algoritmus používaný na našem pracovišti při sledování pacienta po dokončené léčbě
Po dokončení cytostatické léčby leukémie: ambulantní kontroly každé 3 měsíce s pravidelnou kontrolou klinického stavu a základních laboratorních parametrů včetně TK1. S ohledem na možný relaps je třeba hladiny TK1 u každého pacienta vyhodnocovat individuálně. Po určení individuálních remisních hodnot TK1 (nejčastěji se ustálí po půl roce od ukončení udržovací léčby, kdy odezní vliv cytostatik a upraví se toxická hepatopatie) je každý vzestup o více než 50 % (je-li pacient bez virového infektu a bez hepatopatie) podezřelý z počínajícího relapsu onemocnění a pacient by měl být (i v případě dobrého klinického stavu a normálních parametrů krevního obrazu) pozván na kontrolu v kratším intervalu – nejlépe do 1 měsíce. Při přetrvávání nebo progresi elevace hladiny TK1 i při kontrolním vyšetření by mělo být neprodleně provedeno vyšetření kostní dřeně k ověření nebo vyloučení relapsu akutní leukémie.
Tato studie byla podpořena výzkumným záměrem MSM 0021620819 Univerzita Karlova v Praze, Lékařská fakulta v Plzni a Fakultní nemocnice Plzeň.
Došlo: 23. 4. 2011
Přijato: 30. 10. 2011
MUDr. Ing. Tomáš Votava
Dětská klinika FN
Alej Svobody 80
304 00 Plzeň
e-mail: votavat@gmail.com
Zdroje
LITERATURA
1. Nekulová M, Šimíčková M, Valík D. Nádorové markery a epigenetické faktory. Klin Biochem Metab 2006; 14 : 152–156.
2. Ahmed SF, Farqueuharson C. The effect of GH and IGF1 on linear growth and skeletal development and their modulation by SOCS proteins. J End 2010; 206 : 249–259.
3. Sýkora J, Pomahačová R, Stožický F, et al. Hladiny inzulinu podobného růstového faktoru-1 (IGF-1) v séru zdravých dětí do 2 let věku. Čes-slov Pediat 2003; 8 : 497–499.
4. Ohrvik A, Lindh M, Einarsson R, et al. Sensitive nonradiometric method for determining thymidine kinase 1 activity. Clin Chem 2004; 50 : 1597–1606.
5. Welin M, Kosinska U, Mikkelsen NE, et al. Structures of thymidine kinase 1 of human and mycoplasmic origin. Proc Natl Acad Sci U.S.A. 2004; 101 : 17970–17975.
6. Fujiwara H, Arima N, Ohtsubo H, et al. Clinical significance of serum neuron-specific enolase in patients with adult T-cell leukemia. Am J Hematol 2002; 71 : 80–84.
7. O’Neil KL, Zhang F, Li H, Fuja DG, Murray BK. Thymidine kinase 1 a prognostic and diagnostic indicator in ALL and AML patients. Leukemia 2007; 21 : 560–563.
8. Sadamori N, Ichiba M, Mine M, Hakariya S, Hayashibara T, et al. Clinical significance of serum thymidine kinase in adult T-cell leukaemia and acute myeloid leukaemia. Br J Haematol 1995; 90 : 100–105.
9. Starý J. Padesát let úspěšné léčby akutní lymfoblastické leukémie. Čes-slov Pediat 2007; 9 : 540–545.
10. Topolcan O, Holubec L Jr. The role of thymidine kinase in cancer diseases. Expert Opin Med Diagn 2008; 2 : 129–141.
11. Topolcan O, Holubec L, Kausitz J, et al. Thymidine kinase monitoring importance in the routine clinical practice. Anticancer Res 2004; 24 : 3655–3656.
12. Topolcan O, Holubec L Jr, Svobodova S, et al. The diagnostic and prognostic significance of thymidinkinase in tumor diseases. J Clin Ligand Assay 2007; 29 : 190–193
Štítky
Neonatológia Pediatria Praktické lekárstvo pre deti a dorast
Článek Parenterální výživa
Článok vyšiel v časopiseČesko-slovenská pediatrie
Najčítanejšie tento týždeň
2012 Číslo 1- fSCIG v reálnej klinickej praxi u pacientov s hematologickými malignitami
- I „pouhé“ doporučení znamená velkou pomoc. Nasměrujte své pacienty pod křídla Dobrých andělů
- Facilitovaná subkutánna imunoglobulínová terapia u seniorov s imunodeficitmi v reálnej praxi
- Rizikové období v léčbě růstovým hormonem: přechod mladých pacientů k lékařům pro dospělé
-
Všetky články tohto čísla
- Vliv matrixových metaloproteináz na hojení ran po operaci vrozeného rozštěpu rtu
- Koncentrácia olova v krvi a alergénová senzibilizácia detí predškolského veku v dvoch regiónoch Slovenska
- Thymidin kináza – vhodný marker pro diagnostiku a sledování leukémií dětského věku
- Nárast polinózy u školskej mládeže v meste a na vidieku za posledných 20 rokov (1988–2009)
- Prevalence a typ anémie v době stanovení diagnózy nespecifického střevního zánětu u dětí
- Mikrodeleční syndrom Xp21: Závažná příčina selhání nadledvin, svalové dystrofie, poruchy hladin krevních lipidů a vývojové retardace u dvouměsíčního neprospívajícího kojence
- Ostravský den preventivní pediatrie 16. března 2012, Ostrava (Clarion Congress Hotel)
- Ligneózna konjunktivitída, hydrocefalus a protrahované respiračné infekcie u pacienta s deficitom plazminogénu
- Cmúľanie prstov a jeho vplyv na vývoj tváre a dutiny ústnej v detskom veku
- Ovlivnění bolesti při stomatologickém ošetření dětí
- Parenterální výživa
- Kdy vyšetřovat vrozená trombofilní rizika u dětí?
- Perspektiva dětské lůžkové péče v České republice v roce 2011
- Zkušenosti s dlouhodobou neakutní péčí o dítě s postižením ve Strančicích
- Nedožitých 89 rokov profesora Birčáka
- XVII. Moravskoslezské pediatrické dny s mezinárodní účastí
- Česko-slovenská pediatrie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Parenterální výživa
- Kdy vyšetřovat vrozená trombofilní rizika u dětí?
- Ovlivnění bolesti při stomatologickém ošetření dětí
- Cmúľanie prstov a jeho vplyv na vývoj tváre a dutiny ústnej v detskom veku
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



