-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Protilátkami zprostředkovaná rejekce u dětských pacientů po transplantaci ledviny
Antibody-mediated rejection in children after kidney transplantation
Kidney transplantation is the best therapeutic choice for children with end stage kidney disease. Antibody mediated rejection (AMR) has been recognized as the leading immunological cause of decline of graft function and graft loss in the long run. AMR is caused by antibodies specific to mismatched donor antigens, i.e. donor specific antibodies (DSA). According to the Banff classification of renal allograft pathology there are three criteria that need to be met for the diagnosis of AMR – detection of DSA in patient’s serum, morphologic features of graft lesion and proof of endothelium-antibody interaction, including the presence of C4d deposits in the peritubular capillaries in graft biopsy. The treatment of AMR remains challenging and requires combination of different modalities. The most commonly used protocols include series of plasmapheresis, intravenous immunoglobulins and rituximab application.
Keywords:
AMR – ABMR – humorální rejekce – Nephrology – pediatric nephrology – kidney transplantation – kidney transplantation in children – donor specific antibodies – DSA – plasma-exchange – IVIG – rituximab
Autoři: J. Láchová 1; A. Slavčev 2; T. Seeman 1,3
Působiště autorů: Pediatrická klinika 2. LF UK a Fakultní nemocnice Motol, Praha 1; Oddělení imunogenetiky, Pracoviště laboratorních metod, Institut klinické a experimentální medicíny, Praha 2; Biomedicínské centrum, Lékařská fakulta v Plzni, Univerzita Karlova, Plzeň 3
Vyšlo v časopise: Čes-slov Pediat 2019; 74 (6): 371-376.
Kategorie: Přehledový článek
Souhrn
Transplantace ledviny je pro nesporné výhody, které má oproti chronickému dialyzačnímu programu, léčbou volby chronického selhání ledvin u dětí. V dlouhodobém pohledu je za hlavní imunologickou příčinu poklesu a ztráty funkce štěpu považována protilátkami zprostředkovaná rejekce (AMR). AMR je způsobena protilátkami příjemce namířenými proti neshodným antigenům štěpu, takzvanými donor specifickými protilátkami (DSA z angl. donor specific antibodies). Banffská klasifikace patologie vyžaduje pro stanovení diagnózy AMR současné splnění tří kritérií – přítomnost DSA v séru pacienta, průkaz morfologického poškození a příznaky interakce mezi protilátkou a endotelem, včetně přítomnosti C4d depozit v peritubulárních kapilárách v biopsii štěpu. AMR je terapeuticky obtížně zvládnutelná. V praxi se uplatňuje kombinace léčebných modalit, nejčastěji protokoly s plazmaferézou, aplikací intravenózních imunoglobulinů a rituximabu.
Klíčová slova:
AMR – ABMR – humorální rejekce – nefrologie – dětská nefrologie – transplantace ledviny – transplantace ledviny v pediatrii – dárcovsky specifické protilátky – DSA – plazmaferéza – IVIG – rituximab
ÚVOD
Transplantace ledviny je léčbou volby chronického selhání ledvin. Pacienti po transplantaci ledviny mají v porovnání s pacienty na dialýze nižší úmrtnost a lepší kvalitu života a péče o ně je také méně ekonomicky náročná. Nejčastější imunologickou příčinou poklesu a selhání funkce štěpu je akutní a chronická protilátkami zprostředkovaná rejekce (AMR, z anglického antibody-mediated rejection) [1]. Proto je jí v posledním desetiletí věnována velká pozornost. AMR je způsobena protilátkami namířenými proti neshodným antigenům štěpu.
Termín protilátkami zprostředkovaná rejekce se poprvé objevil v Banffské klasifikaci patologie ledvinných štěpů v roce 1997, tehdy se však jednalo o zastřešující termín pro rejekci hyperakutní a takzvanou akcelerovanou akutní. V roce 2003 se v Banffské klasifikaci objevuje skupina akutní protilátkami zprostředkovaná rejekce a v roce 2005 pak chronická aktivní protilátkami zprostředkovaná rejekce [2]. V obnovené Banffské klasifikaci z roku 2015 je celá druhá kategorie věnována protilátkami zprostředkovaným změnám. Je rozdělena na další tři podskupiny – akutní/aktivní AMR, chronickou aktivní AMR a C4d pozitivitu bez známek rejekce. Jak akutní AMR, tak chronická AMR musí splňovat současně tři podmínky, a to přítomnost histologických změn v biopsii, průkaz interakce mezi protilátkou a endotelem v biopsii a sérologický průkaz donor specifických protilátek [3].
PATOFYZIOLOGIE
Za AMR stojí protilátky dárce namířené proti neshodným antigenům příjemce (v převážné většině se jedná o HLA antigeny), tzv. donor specifické protilátky (DSA) [4]. Studie ukazují, že pacienti s přetrvávajícími DSA mají rychlejší pokles funkce štěpu a větší riziko ztráty štěpu oproti pacientům, kteří DSA nevyvinou [5]. DSA mohou být v séru pacienta přítomny již v době před transplantací (preformované DSA), nebo se mohou začít tvořit de novo po transplantaci [6, 7]. S preformovanými DSA se můžeme setkat zejména u pacientů, kteří měli opakované transfuze, strávili dlouhou dobu na dialýze, u žen po opakovaných těhotenstvích a u pacientů po předchozích transplantacích. Jako rizikové faktory pro tvorbu de novo DSA u pacientů se uvádějí především neadekvátní imunosuprese, neshody v HLA systému a epizody T-buňkami zprostředkované rejekce [8]. Za neadekvátní imunosupresí může stát nonadherence pacienta k léčbě nebo iatrogenní příčina (snížení dávkování či změna imunosupresiva lékařem) [9].
Různé vlastnosti protilátek (např. specificita, schopnost aktivovat komplement) mohou mít významný vliv na jejich patogenicitu a tím i na riziko rozvoje poškození štěpu a rozvoje AMR [10]. Kromě vlastností protilátek se na míře jejich patogenicity podílí také jejich hladina, která se semikvantitativně vyjadřuje pomocí hodnoty střední intenzity flourescence (mean fluorescence intensity, MFI).
Specificita
DSA mohou být namířeny jak proti HLA antigenům I. a II. třídy [11], tak zřídka i proti non-HLA antigenům (např. endoteliálním antigenům, receptoru typu 1. pro angiotenzin II, vimentinu atd.). Velmi často u pacientů, čekajících na retransplantaci, jsou protilátky namířeny proti HLA II. třídy, a to zejména proti antigenům DQ (45–85 % DSA u dětských pacientů po transplantaci) [5, 12]. Ve studiích je většina protilátek namířena proti DQ (ale někdy proti DR a DP antigenům), a to i přes snahu zajistit lepší shodu mezi dárcem a příjemcem v HLA antigenech II. třídy než v HLA I. třídy, výsledky jsou bezpochyby ale ovlivněny alokačními algoritmy v různých transplantačních programech. V rámci HLA II. třídy jsou výrazně častější protilátky proti DQ než proti DR, i když je míra neshody často srovnatelná, a to kvůli vazebné nerovnováze mezi oběma lokusy.
IgG podtřídy a fixace komplementu
Specifické protilátky schopné vázat komplement jsou kromě třídy IgM také IgG. Zejména se jedná o podtřídy IgG1 a IgG3, jejichž přítomnost v séru pacienta je spojena s výskytem akutní humorální rejekce. Doposud nejsou známé publikace o IgG podtřídách DSA u dětských pacientů po orgánové transplantaci. Podle nedávno publikovaných studií s dospělými pacienty po transplantaci mohou mít DSA různou patogenicitu v závislosti na podtřídě IgG. Jak je uvedeno výše, podtřídy IgG se liší ve své schopnosti aktivovat komplement a vázat Fc receptor. V nedávno publikované práci [10] byly DSA v jednom roce po transplantaci nejčastěji podtypu IgG1, dále IgG2 , IgG3 a IgG4. V této studii byly DSA podtřídy IgG3 a IgG4 nejvíce určující pro identifikaci fenotypu AMR. IgG3 DSA byly spojeny s plně vyjádřenou akutní AMR, zatímco IgG4 DSA se subklinickou AMR. IgG3 DSA byly asociovány s kratším mediánem doby od transplantace k diagnóze AMR, nižší hodnotou odhadnuté GFR (eGFR) při diagnóze a kratším mediánem času k selhání štěpu. Detekce IgG4 iDSA byla spojena s pozdějším nástupem protilátkového poškození štěpu v čase od transplantace a s vyšší hodnotou eGFR při diagnóze. Tato studie však nebyla zatím nezávisle potvrzena jinými studiemi.
Schopnost protilátek vázat komplement lze vyšetřit pomocí vazby na C1q složku komplementu a přítomnosti C3d složky, což je produkt aktivace komplementové kaskády [13, 14]. Ve francouzské multicentrické studii s dospělými pacienty byla vyšetřena séra pacientů, kteří prodělali akutní AMR. Ve vzorcích byla stanovena schopnost DSA protilátek vázat C1q složku komplementu. Přítomnost a přetrvávání C1q vážících anti HLA DSA po prodělané AMR byla nepříznivým ukazatelem, vedoucím k rozvoji transplantační glomerulopatie a ztrátě štěpu [15].
Studie u dětských pacientů ukázala asociaci C3d pozitivních protilátek s přítomností C4d v biopsii a signifikantně horší dlouhodobou funkcí štěpu. Autoři studie poukazují na možné použití vyšetření C3d fixace v budoucnu ke stratifikaci pacientů ve vyšším riziku dysfunkce štěpu [16]. Další studie ukazuje, že C1q vážící de novo DSA jsou asociovány s časnou ztrátou štěpu, ale v dlouhodobém horizontu se tato asociace se selháním štěpu projevuje i u de novo DSA, které C1q neváží [17]. Klinická relevance C1q a C3d testu, stejně jako distribuce podtříd DSA, vyžaduje další zkoumání.
HISTOLOGIE
Typickým znakem aktivace komplementu v důsledku interakce mezi protilátkou a endotelem je v biopsii lineární pozitivita C4d depozit vyskytující se na peritubulárních kapilárách (obr. 1). C4d vzniká při aktivaci klasické cesty komplementu, je terminálním štěpným produktem složky C4 a váže se na cílové struktury kovalentní vazbou. Tato vazba pak vysvětluje možnost imunofluorescenční detekce C4d v biopsii. Klasická cesta aktivace komplementové kaskády je spuštěna na površích, kde jsou navázány protilátky. Detekce jejího štěpného produktu je tedy důkazem o poškození zprostředkovaném protilátkami. Poprvé byla detekce depozit C4d v biopsii štěpu popsána v roce 1991. Feucht et al. v té době upozornili, že i přes negativní crossmatch před transplantací a nepatrnou detekci imunoglobulinů v biopsii by protilátky namířené proti antigenům endotelu měly být zváženy jako příčina aktivace komplementu a poškození [18]. Dva roky poté stejný autor popsal souvislost mezi nálezem C4d a ztrátou funkce štěpu [19]. Absence nálezu C4d depozit však humorální rejekci s jistotou nevylučuje [20]. Depozita C4d jsou produktem štěpení komplementu, nejsou tedy přítomna, pokud v procesu hrají roli protilátky, které komplement neaktivují. Podle současné Banffské klasifikace je možno za důkaz poškození endotelu považovat i mikrovaskulární zánětlivé změny v glomerulech, anebo průkaz zvýšené transkripce genů svědčících pro endotelové poškození v biopsii [3].
Obr. 1. Pozitivita peritubulárních kapilár v imunofluorescenčním průkazu C4d složky komplementu (400x), z archivu MUDr. J. Háčka.
Fig. 1. Immunoflourescence detection of the complement split product C4d deposition in peritubular capillaries (magnification x 400), J. Háček archive.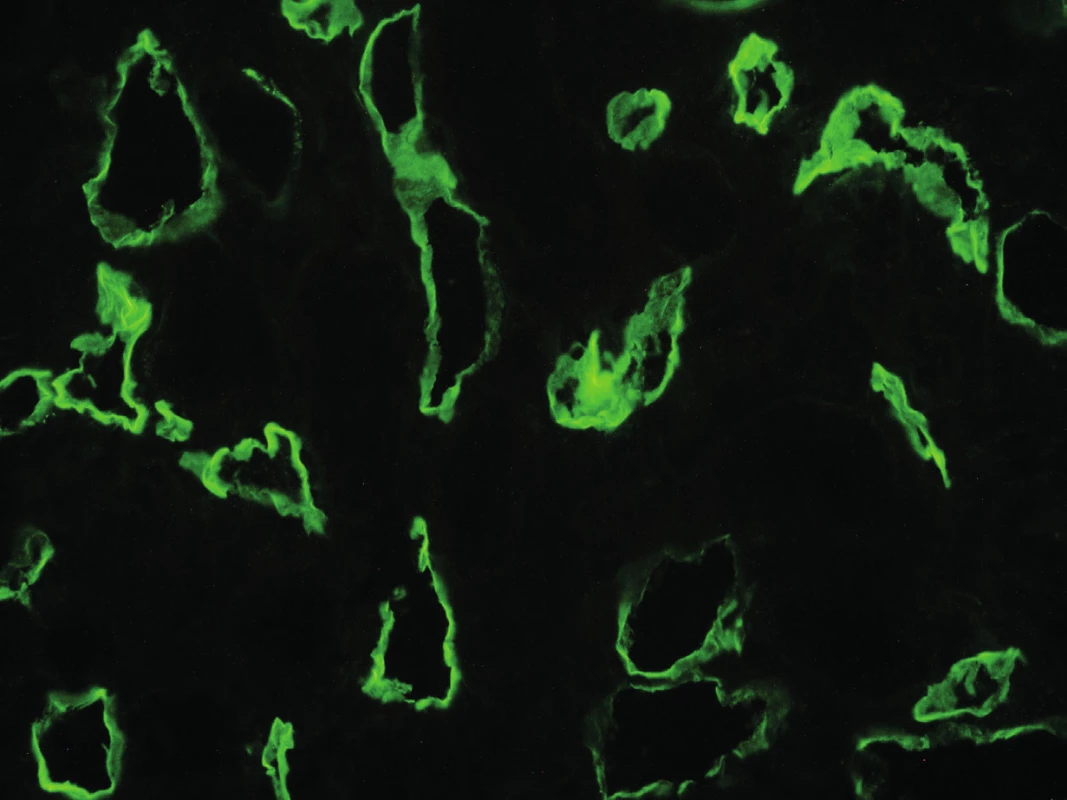
Cílovou strukturou humorální rejekce je endotel. Charakteristické je poškození peritubulárních kapilár a glomerulů [21] (obr. 2). V morfologickém obraze bývá často přítomna i zánětlivá celulizace (glomerulitida), i když hlavní patogenetickou úlohu hrají protilátky, efektorem jsou někdy NK (natural killer) buňky, např. mechanismem ADCC (antibody-dependent cytotoxicity). Navíc je nutno podotknout, že velmi často protilátkami-zprostředkovaná rejekce probíhá současně s rejekcí celulární. Vzhledem k tomu, že ledvina v mikrocirkulaci postrádá kolaterály, stenóza nebo uzávěr vedou nejen k ischemii a až vzniku nekrózy, ale při poruše cirkulace sem také hůře pronikají imunosupresiva a i tento mechanismus pak přispívá k chronickým patologickým změnám.
Obr. 2. Kapilaritida peritubulárních kapilár. Peritubulární kapiláry jsou dilatované se stázou monocytů a polymorfonukleárů (AB-PAS, 400 x), z archivu MUDr. J. Háčka.
Fig. 2. Arrows showing peritubular capillaritis with dilatation and polymorphonuclear leukocytes stasis (AB-PAS, magnification x 400), J. Háček archive.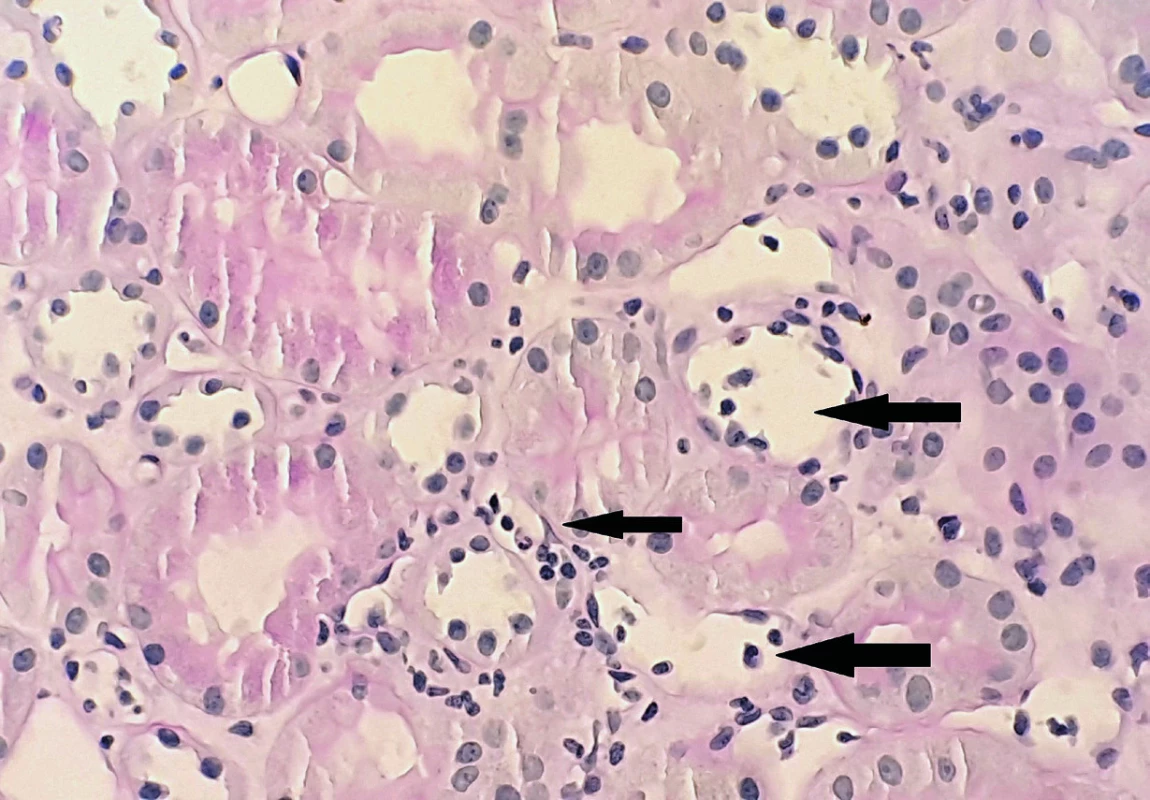
TERAPIE
Terapie protilátkami zprostředkované rejekce zůstává výzvou. Léčba AMR by měla být cílena jak na eliminaci či supresi cirkulujících protilátek, tak na depleci prekurzorů plazmatických buněk, B lymfocitů, či přímo plazmatických buňek [22, 23]. Uplatňují se také postupy suprimující T lymfocyty, jež jsou efektory poškození i u protilátkové odpovědi, a také léčba inhibující komplement.
Plazmaferéza
Plazmaferéza je efektivním způsobem eliminace cirkulujících protilátek. Opakované plazmaferézy jsou nejčastější iniciální léčbou u akutní AMR. Provádění plazmaferézy vyžaduje zavedení centrálního žilního katétru s možností velkého průtoku. V průběhu procesu dochází k výměně 1–1,5násobku objemu cirkulující plazmy za roztok 5% albuminu (častěji) nebo mraženou plazmu. Zejména u malých pacientů se v průběhu plazmaferézy z důvodu volumové deplece může rozvinout hypotenze. Dalším nežádoucím účinkem může být hypokalcémie při použití citrátového antikoagulancia. S použitím preventivních opatření je však metoda dobře tolerována i u pacientů s hmotností pod 20 kg [24]. Při použití této eliminační metody však nedochází pouze k odstraňování DSA, ale i jiných, protektivních protilátek a proteinů, včetně srážlivých faktorů, může tedy dojít k rozvoji krvácivých komplikací. Vzhledem k tomu, že plazmaferéza neovlivňuje produkci protilátek, je nutné ji používat v kombinaci s dalšími postupy.
Intravenózní imunoglobuliny (IVIG)
IVIG jsou další často používanou modalitou, která snižuje hladinu cirkulujících protilátek. Není zcela přesně známo, jaké mechanismy se na jejich účinku podílejí. Jejich působení zahrnuje neutralizaci komplement fixujících protilátek, vychytávání komplementu a alteraci jeho aktivity, modulaci aktivace Fc receptoru a regulaci T lymfocytů, B lymfocytů a buněk epitelu [25]. IVIG mohou být použity ve vysokém dávkování (1–2 g/kg), nebo v nízkém dávkování (0,1–0,4 g/kg). Většinou je podávání IVIG tolerováno dobře. Mohou se vyskytnout nežádoucí účinky jako trombotické komplikace (při vysokém dávkování), aseptická meningitida či volumové přetížení. Starší studie používající samotné IVIG k léčbě rejekce a jako desenzitizaci u pacientů před transplantací ukázaly jejich účinnost. Použití IVIG v kombinaci s plazmaferézou a rituximabem zlepšuje přežití štěpu výrazně.
Imunoadsorbce
Imunoadsorbce je eliminační metoda, která je oproti plazmaferéze selektivnější a je při ní možno vyměnit větší objem plazmy (3 - a vícenásobek). Zatímco při plazmaferéze dochází k odstraňování jak IgG, tak IgM protilátek, v průběhu imunoadsorbce jsou odstraněny pouze IgG protilátky. Při imunoadsorbci je použit filtr, který izoluje anti-ABO protilátky, čehož je využíváno při ABO inkompatibilních transplantacích. Vyšší selektivita této metody se také odráží v tom, že při ní nedochází ke ztrátám jiných důležitých plazmatických bílkovin, včetně koagulačních faktorů, díky čemuž má nižší výskyt krvácivých komplikací [26]. Velkou nevýhodou této metody je však velká ekonomická náročnost.
Rituximab
Rituximab je chimerická monoklonální protilátka proti molekule CD20, kterou na svém povrchu exprimují B lymfocyty. Původně byla tato protilátka vyvinuta k léčbě hematologických malignit. nejdříve byla používána v léčbě B buněčných non-Hodgkinových lymfomů rezistentních k chemoterapii, poté se její použití rozšířilo i na další hematologické malignity, autoimunitní choroby a transplantační medicínu. Standardní dávkování je 375 mg/m2. Rituximab rychle navozuje hlubokou depleci B lymfocytů na několik měsíců jak v cirkulující krvi, tak ve tkáních. Nová populace B lymfocytů se v periferní krvi objeví asi za 6 měsíců po podání. Účinnost rituximabu v léčbě AMR byla prokázána v několika studiích. Studie u dospělých pacientů prokázala lepší přežívání štěpů u pacientů s AMR léčených kombinací Rituximabu, plazmaferéz a IVIG než u pacientů, kteří byli léčeni pouze IVIG [27]. Jiná studie porovnávala přežití štěpů u pacientů léčených Rituximabem, PP a IVIG oproti historickým kontrolám, kde byla použita kombinace PP a IVIG. Tato studie rovněž ukázala signifikantně vyšší přežití štěpů ve skupině s Rituximabem [28]. Rituximab byl k léčbě AMR v kombinaci použit s úspěchem i ve studiích u dětských pacientů [29, 30]. Deplece B lymfocytů může vést k reaktivaci latentních virů, zejména hepatitidy B, ale také CMV a EBV. V jednotlivých případech pacientů léčených rituximabem (pro systémový lupus) bylo popsáno úmrtí v důsledku progresivní multifokální encefalopatie, která je způsobena aktivací JC polyomaviru.
Bortezomib
Působí depleci plazmatických buněk, na rozdíl od Rituximabu, který je cílen na molekulu CD20, jejíž expresi B lymfocyty ztrácí při své terminální diferenciaci. Bortezomib je inhibitor proteasomu. Proteasomy jsou komplexy proteinů, které se nacházejí v cytoplazmě i jádře buněk. Jejich hlavní úlohou je proteolytická degradace ubiquitinovaných proteinů. Bortezomib je prvním terapeutickým inhibitorem proteazomu, který byl testován u člověka. Jeho použití bylo nejdříve schváleno u relapsů mnohočetného myelomu, zanedlouho pro jeho velmi dobrou účinnost i pro primoléčbu a lymfom z plášťových buněk. Bortezomib dobře působí na plazmatické buňky, neboť v nich je vysoký obrat protilátek a vysoce aktivní endoplazmatické retikulum, tyto pochody látka inhibuje a navozuje apoptózu. Používá se dávkování jako u myelomu, kdy je v jednom cyklu trvajícím 2 týdny celkem čtyřikrát aplikována dávka 1,3 mg/m2. Studie provedená u dospělých pacientů s AMR, porovnávající použití jednoho cyklu Bortezomibu spolu se standardní terapií (PP, a IVIG) a historické kontroly, u kterých byla použita jedna dávka Rituximabu spolu se standardní terapií, ukazuje signifikantně vyšší přežití štěpů a lepší renální funkci v Bortezomibové skupině [31]. Novější studie stejného autora porovnává použití kombinace Bortezomib, Rituximab, PP a IVIG s historickými kontrolami, kdy byli pacienti léčeni stejnou kombinací, avšak bez Rituximabu. Přidání Rituximabu zde nevedlo ke zlepšení přežití štěpů a navíc vedlo k vyššímu výskytu nežádoucích účinků. Autoři tedy nabádají k obezřetnosti u kombinovaných režimů [32]. U dětských pacientů bylo s použitím Bortezomibu publikováno jen několik menších studií a kazuistik, které však také svědčí pro jeho efektivitu [33]. Léčbu Bortezomibem mohou provázet závažné nežádoucí účinky, jedním z nejčastějších je periferní neuropatie (vyskytuje se až u 30 % pacientů), podávání může vést k myelosupresi a způsobit tak trombocytopenii či neutropenii, může také způsobit hyperhydrataci a velmi často gastrointestinální obtíže. Další nevýhodou je velká ekonomická náročnost léčby.
Eculizumab
Eculizumab je humanizovaná monoklonální protilátka, která působí inhibici závěrečné fáze komplementové kaskády. Váže se na složku C5, působí tak na klasickou cestu a inhibuje membránu atakující komplex (MAC), čímž zabraňuje poškození buňky. Jeho použití je schváleno pro léčbu atypického hemolyticko-uremického syndromu (aHUS) a paroxyzmální noční hemoglobinurie. V obou případech je určen k dlouhodobému podávání. Eculizumab je u pacientů s aHUS používán i po transplantaci ledviny k prevenci rekurence onemocnění ve štěpu. V několika malých studiích a kazuistikách jak u dospělých, tak u dětských pacientů byl Eculizumab efektivní i v léčbě refrakterní AMR [34–38]. Jiné studie jeho účinnost neprokázaly [39]. Velmi významným rizikem léčby Eculizumabem je náchylnost k infekcím obalenými organismy. Byly popsány závažné i fatální meningokokové infekce. Před zahájením léčby je doporučeno pacienty očkovat jak konjugovanou vakcínou proti sérotypům A, C, W a Y, tak vakcínou proti sérotypu B. Meningokokové infekce však byly hlášeny i v několika případech, kdy byli pacienti řádně očkováni. Velkou nevýhodou je také vysoká cena.
Splenektomie
Použití splenektomie bylo popssáno jako záchranná léčba u refrakterní AMR u dospělých pacientů [40]. Mezi běžné postupy se však pro svou invazivitu a rizika nedostala. O použití u dětských pacientů v této indikaci nejsou dostupné zdroje.
ZÁVĚR
Protilátkami zprostředkovaná rejekce je nejčastější příčinou pozdního imunologického selhání transplantované ledviny. Léčba vyžaduje kombinaci více terapeutických přístupů ke snížení hladiny donor specifických protilátek a potlačení jejich další tvorby. Efekty léčby AMR jsou v současnosti horší než u léčby buněčné rejekce.
Poděkování: Děkujeme MUDr. Jaromíru Háčkovi z Ústavu patologie a molekulární medicíny 2. LF UK a FN Motol za poskytnutí obrazové dokumentace.
Došlo: 18. 11. 2018
Přijato: 7. 8. 2019
MUDr. Jitka Láchová
Pediatrická klinika 2. LF UK
FN Motol
V Úvalu 84
150 06 Praha 5
e-mail: jitka.lachova@fnmotol.cz
Zdroje
1. Sellarés J, de Freitas DG, Halloran PF. Understanding the causes of kidney transplant failure: the dominant role of antibody-mediated rejection and nonadherence. Am J Transplant 2012 Feb; 12 (2): 388–399. doi: 10.1111/j.1600-6143.2011.03840.x. PubMed PMID: 22081892.
2. Bhowmik DM, Dinda AK, Mahanta P, Agarwal SK. The evolution of the Banff classification schema for diagnosing renal allograft rejection and its implications for clinicians. Indian J Nephrol 2010 Jan; 20 (1): 2–8. doi:10.4103/0971-4065.62086. PubMed PMID: 20535263; PubMed Central PMCID: PMC2878403.
3. Loupy A, Haas M, Mengel M. The Banff 2015 Kidney Meeting Report: Current challenges in rejection classification and prospects for adopting molecular pathology. Am J Transplant 2017 Jan; 17 (1): 28–41. doi: 10.1111//ajt.14107. PubMed PMID: 27862883.
4. Smith RN, Kawai T, Boskovic S, et al. Four stages and lack of stable accommodation in chronic alloantibody-mediated renal allograft rejection in Cynomolgus monkeys. Am J Transplant 2008 Aug; 8 (8): 1662–-1672. doi: 10.1111/j.1600-6143.2008.02303.x. Epub 2008 Jun 28. PubMed PMID: 18557724; PubMed Central PMCID: PMC2796366.
5. Kim JJ, Balasubramanian R, Marks SD. The clinical spectrum of de novo donor-specific antibodies in pediatric renal transplant recipients. Am J Transplant 2014 Oct; 14 (10): 2350–2358. doi: 10.1111/ajt.12859. PubMed PMID: 25167892.
6. Loupy A, Suberbielle-Boissel C, Nochy D. Outcome of subclinical antibody-mediated rejection in kidney transplant recipients with preformed donor-specific antibodies. Am J Transplant 2009 Nov; 9 (11): 2561–2570. doi: 10.1111/j.1600-6143.2009.02813.x. PubMed PMID: 19775320.
7. Loupy A, Vernerey D, Lefaucheur C. Subclinical rejection phenotypes at 1 year post-transplant and outcome of kidney allografts. J Am Soc Nephrol 2015 Jul; 26 (7): 1721–1731. doi: 10.1681/ASN.2014040399. PubMed PMID: 25556173; PubMed Central PMCID: PMC4483584.
8. Wiebe C, Gibson IW, Nickerson PW. Evolution and clinical pathologic correlations of de novo donor-specific HLA antibody post kidney transplant. Am J Transplant 2012 May; 12 (5): 1157–1167. doi: 10.1111/j.1600-6143.2012.04013.x. PubMed PMID: 22429309.
9. Arias M, Rush DN, Schwaiger E. Antibody-mediated rejection: analyzing the risk, proposing solutions. Transplantation 2014 Aug 15; 98 (Suppl 3): S3–21. doi: 10.1097/TP.0000000000000218. PubMed PMID: 25093441.
10. Lefaucheur C, Viglietti D, Zeevi A. IgG donor-specific anti-human HLA antibody subclasses and kidney allograft antibody-mediated injury. J Am Soc Nephrol 2016 Jan; 27 (1): 293–304. doi: 10.1681/ASN.2014111120. PubMed PMID: 26293822; PubMed Central PMCID: PMC4696574.
11. Otten HG, Verhaar MC, Borst HP, et al. Pretransplant donor-specific HLA class-I and -II antibodies are associated with an increased risk for kidney graft failure. Am J Transplant 2012 Jun; 12 (6): 1618–1623. doi:10.1111/j.1600-6143.2011.03985.x. Epub 2012 Mar 8. PubMed PMID: 22404993.
12. Rusai K, Dworak J, Müller-Sacherer T. Donor-specific HLA antibodies and graft function in kidney-transplanted children – the Vienna cohort. Pediatr Transplant 2016 Jun; 20 (4): 507–514. doi: 10.1111/petr.12707. PubMed PMID: 27089840.
13. Yell M, Muth BL, Ellis TM. C1q Binding activity of de novo donor-specific HLA antibodies in renal transplant recipients with and without antibody-mediated rejection. Transplantation 2015 Jun; 99 (6): 1151–1155. doi: 10.1097/TP.0000000000000699. PubMed PMID: 25839705
14. Sicard A, Ducreux S, Thaunat O. Detection of C3d-binding donor-specific anti-HLA antibodies at diagnosis of humoral rejection predicts renal graft loss. J Am Soc Nephrol 2015 Feb; 26 (2): 457–467. doi: 10.1681//ASN.2013101144. PubMed PMID: 25125383; PubMed Central PMCID: PMC4310653.
15. Bailly E, et al. Prognostic value of the persistence of C1q-binding anti-HLA antibodies in acute antibody-mediated rejection in kidney transplantation. Transplantation 2018 Apr; 102 (4): 688–698. doi: 10.1097/TP.0000000000002002. PubMed PMID: 29135832.
16. Kim JJ, et al. Clinical risk stratification of paediatric renal transplant recipients using C1q and C3d fixing of de novo donor-specific antibodies. Pediatr Nephrol 2018 Jan; 33 (1): 167–174. doi: 10.1007/s00467-017-3772-7. Epub 2017 Sep 16. PubMed PMID: 28918487; PubMed Central PMCID: PMC5700253.
17. Guidicelli G, Guerville F, Lepreux S, et al. Non-complement-binding de novo donor-specific anti-HLA antibodies and kidney allograft survival. J Am Soc Nephrol 2016 Feb; 27 (2): 615–625. doi: 10.1681//ASN.2014040326. Epub 2015 Jun 5. PubMed PMID: 26047793; PubMed Central PMCID: PMC4731103.
18. Feucht HE, Felber E, Albert E. Vascular deposition of complement-split products in kidney allografts with cell-mediated rejection. Clin Exp Immunol 1991 Dec; 86 (3): 464–470. PubMed PMID: 1747954; PubMed Central PMCID: PMC1554190.
19. Feucht HE, Schneeberger H, Albert E. Capillary deposition of C4D complement fragment and early renal graft loss. Kidney Int 1993 Jun; 43 (6): 1333–1338. PubMed PMID: 8315947.
20. Honsová E. Antibody-mediated rejection of renal allograft and the update Banff classification 2013. Cesk Patol 2015; 51 (3): 116–119. Czech PubMed PMID: 26421951.
21. Gibson IW, Gwinner W, Bröcker V, et al. Peritubular capillaritis in renal allografts: prevalence, scoring system, reproducibility and clinicopathological correlates. Am J Transplant 2008 Apr; 8 (4): 819–825. doi: 10.1111/j.1600-6143.2007.02137.x. Epub 2008 Feb 5. PubMed PMID: 18261174.
22. Slatinská J, Viklický O. Protilátkami zprostředkovaná rejekce: současné pohledy na patofyziologii a terapii. Aktuality v nefrologii (AVN) 2014; 20 (1): 20–30. Dostupné na World Wide Web: http://www.tigis.cz/images/stories/Aktuality_nefro/2014/01/04_slatinska_avn_1-14.pdf
23. Pape L, Becker JU, Immenschuh S, Ahlenstiel T. Acute and chronic antibody-mediated rejection in pediatric kidney transplantation. Pediatr Nephrol 2015 Mar; 30 (3): 417–424. doi: 10.1007/s00467-014-2851-2. Epub 2014 May 28. Review. PubMed PMID: 24865478.
24. Ng YW, Singh M, Sarwal MM. Antibody-mediated rejection in pediatric kidney transplantation: pathophysiology, diagnosis, and management. Drugs 2015 Apr; 75 (5): 455–472. doi: 10.1007/s40265-015-0369-y. Review. PubMed PMID: 25813498.
25. Puttarajappa C, Shapiro R, Tan HP. Antibody-mediated rejection in kidney transplantation: a review. J Transplant 2012; 2012 : 193724. doi: 10.1155/2012/193724. PubMed PMID: 22577514; PubMed Central PMCID: PMC3337620.
26. Bartel G, Schwaiger E, Böhmig GA. Prevention and treatment of alloantibody-mediated kidney transplant rejection. Transpl Int 2011 Dec; 24 (12): 1142–1155. doi: 10.1111/j.1432-2277.2011.01309.x. Epub 2011 Aug 10. Review. PubMed PMID: 21831227.
27. Lefaucheur C, Nochy D, Suberbielle-Boissel C. Comparison of combination Plasmapheresis/IVIg/anti-CD20 versus high-dose IVIg in the treatment of antibody-mediated rejection. Am J Transplant 2009 May; 9 (5): 1099–1107. doi: 10.1111/j.1600-6143.2009.02591.x. PubMed PMID: 19422335.
28. Kaposztas Z, Podder H, Kahan BD. Impact of rituximab therapy for treatment of acute humoral rejection. Clin Transplant 2009 Jan-Feb; 23 (1): 63–73. doi: 10.1111/j.1399-0012.2008.00902.x. PubMed PMID: 19200217.
29. Billing H, Rieger S, Tönshoff B. Successful treatment of chronic antibody-mediated rejection with IVIG and rituximab in pediatric renal transplant recipients. Transplantation 2008 Nov 15; 86 (9): 1214–1221. doi: 10.1097/TP.0b013e3181880b35. PubMed PMID: 19005402.
30. Gulleroglu K, Baskin E, Haberal M. Antibody-mediated rejection and treatment in pediatric patients: one center‘s experience. Exp Clin Transplant 2013 Oct; 11 (5): 404–407. PubMed PMID: 24128133.
31. Waiser J, Budde K, Lachmann N. Comparison between bortezomib and rituximab in the treatment of antibody-mediated renal allograft rejection. Nephrol Dial Transplant 2012 Mar; 27 (3): 1246–1251. doi: 10.1093/ndt//gfr465. PubMed PMID: 21852274.
32. Waiser J, Duerr M, Lachmann N. Rituximab in combination with bortezomib, plasmapheresis, and high-dose IVIG to treat antibody-mediated renal allograft rejection. Transplant Direct 2016 Jul 1; 2 (8): e91. PubMed PMID: 27819032; PubMed Central PMCID: PMC5083001.
33. Pearl MH, Nayak AB, Tsai EW. Bortezomib may stabilize pediatric renal transplant recipients with antibody-mediated rejection. Pediatr Nephrol 2016 Aug; 31 (8): 1341–1348. doi: 10.1007/s00467-016-3319-3. PubMed PMID: 27048228.
34. Locke JE, et al. The use of antibody to complement protein C5 for salvage treatment of severe antibody-mediated rejection. Am J Transplant 2009 Jan; 9 (1): 231–235. doi: 10.1111/j.1600-6143.2008.02451.x. Epub 2008 Oct 31. PubMed PMID: 18976298.
35. Stegall MD, Diwan T, Gloor JM. Terminal complement inhibition decreases antibody-mediated rejection in sensitized renal transplant recipients. Am J Transplant. 2011 Nov; 11 (11): 2405–2413. doi: 10.1111/j.1600-6143.2011.03757.x. Erratum in: Am J Transplant 2013 Jan; 13 (1): 241. PubMed PMID: 21942930.
36. Chehade H, Rotman S, Pascual M. Eculizumab to treat antibody-mediated rejection in a 7-year-old kidney transplant recipient. Pediatrics 2015 Feb; 135 (2): e551–555. doi: 10.1542/peds.2014-2275. PubMed PMID: 25624380.
37. Ghirardo G, Benetti E, Murer L. Plasmapheresis-resistant acute humoral rejection successfully treated with anti-C5 antibody. Pediatr Transplant 2014 Feb; 18 (1): E1–5. doi: 10.1111/petr.12187. PubMed PMID: 24266980.
38. Barnett AN, Asgari E, Chowdhury P, et al. The use of eculizumab in renal transplantation. Clin Transplant 2013 May-Jun; 27 (3): E216–229. doi: 10.1111/ctr.12102. Epub 2013 Mar 21. Review. PubMed PMID: 23516966.
39. Burbach M, Suberbielle C, Hertig A. Report of the inefficacy of eculizumab in two cases of severe antibody-mediated rejection of renal grafts. Transplantation 2014 Nov 27; 98 (10): 1056–1059. doi: 10.1097//TP.0000000000000184. PubMed PMID: 24839895.
40. Locke JE, et al. The utility of splenectomy as rescue treatment for severe acute antibody mediated rejection. Am J Transplant 2007 Apr; 7 (4): 842–846. PubMed PMID:17391127.
Štítky
Neonatológia Pediatria Praktické lekárstvo pre deti a dorast
Článok vyšiel v časopiseČesko-slovenská pediatrie
Najčítanejšie tento týždeň
2019 Číslo 6- Facilitovaná subkutánna imunoglobulínová terapia u seniorov s imunodeficienciami v reálnej praxi
- fSCIG v reálnej klinickej praxi u pacientov s hematologickými malignitami
- Rizikové období v léčbě růstovým hormonem: přechod mladých pacientů k lékařům pro dospělé
- Gastroezofageální reflux a gastroezofageální refluxní onemocnění u kojenců a batolat
- I „pouhé“ doporučení znamená velkou pomoc. Nasměrujte své pacienty pod křídla Dobrých andělů
-
Všetky články tohto čísla
- Funkční výsledky pacientů s rozštěpem patra v letech 1993–2006 na Moravě I – Epidemiologie a chirurgické výsledky
- Funkční výsledky pacientů s rozštěpem patra v letech 1993–2006 na Moravě II – Vývoj řeči
- Funkční výsledky pacientů s rozštěpem patra v letech 1993–2006 na Moravě III – ORL výsledky
- Jaké jsou možnosti podpory kojení po časné plastice rozštěpu rtu v porodnici se statutem Baby-Friendly Hospital?
- Falešná pozitivita v novorozeneckém screeningu deficitu 21-hydroxylázy
- Vplyv etnicity a miery integrácie/segregácie rómskeho etnika na antropometrické parametre u ich novorodencov, narodených v oblasti severovýchodu Slovenska
- Problematika časné diagnostiky neuroinfekcí
- 14. česko-slovenský kongres dětské anestezie, intenzivní péče a urgentní medicíny Praha, 8.–9. listopad 2019
- Protilátkami zprostředkovaná rejekce u dětských pacientů po transplantaci ledviny
- Česko-slovenská pediatrie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Problematika časné diagnostiky neuroinfekcí
- Funkční výsledky pacientů s rozštěpem patra v letech 1993–2006 na Moravě I – Epidemiologie a chirurgické výsledky
- Falešná pozitivita v novorozeneckém screeningu deficitu 21-hydroxylázy
- Protilátkami zprostředkovaná rejekce u dětských pacientů po transplantaci ledviny
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



