-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Přínos magnetické rezonance pro diagnostiku kardiomyopatií a myokarditidy (1. část)
The benefit of magnetic resonance for diagnosing cardiomyopathy and myocarditis
Magnetic resonance is becoming an increasingly used examination in cardiology, since it greatly improves the accuracy of diagnosing of many heart diseases. At present magnetic resonance is the gold standard in assessing the volumes of the heart chambers and the systolic function of both ventricles. The possibility of detecting tissue characteristics to refine the diagnostics of different types of myocardial pathology is of essential importance. The authors summarize in the article the present knowledge about the use of magnetic resonance of the heart in the field of myocardial disease, i.e. cardiomyopathy and myocarditis. The first part of the review gives a general introduction into the topic of magnetic resonance examination of myocardial diseases, which is followed by a detailed description of the benefits of this imaging method in dilated cardiomyopathy and myocarditis,in hypertrophic cardiomyopathy, and arrhythmogenic right ventricular cardiomyopathy.
Key words:
fibrosis – cardiomyopathy – magnetic resonance – myocarditis – late contrast agent saturation
Autoři: Michal Fikrle 1,2; Petr Kuchynka 2; Martin Mašek 3; Jana Podzimková 2; Jan Kuchař 2; Aleš Linhart 2; Tomáš Paleček 2
Působiště autorů: Kardiologické oddělení Nemocnice Jihlava 1; II. interní klinika – klinika kardiologie a angiologie 1. LF UK a VFN v Praze 2; Radiodiagnostická klinika 1. LF UK a VFN v Praze 3
Vyšlo v časopise: Vnitř Lék 2016; 62(10): 795-803
Kategorie: Přehledné referáty
Souhrn
Magnetická rezonance se v kardiologii stává stále více využívaným vyšetřením, neboť nabízí zásadní zpřesnění diagnostiky mnoha srdečních onemocnění. Magnetická rezonance v současnosti představuje zlatý standard pro hodnocení objemů srdečních oddílů a systolické funkce obou komor. Zcela zásadní je možnost tkáňové charakteristiky zpřesňující diagnostiku řady myokardiálních patologií. V tomto článku autoři předkládají souhrn současných poznatků o využití magnetické rezonance srdce na poli onemocnění myokardu, tj. kardiomyopatií a myokarditidy. Prvá část sdělení přináší obecný úvod do problematiky vyšetření myokardiálních chorob pomocí magnetické rezonance, na který navazuje podrobný rozbor přínosu této zobrazovací metody u dilatační kardiomyopatie a myokarditidy, u hypertrofické kardiomyopatie a arytmogenní kardiomyopatie pravé komory.
Klíčová slova:
fibróza – kardiomyopatie – magnetická rezonance – myokarditida – pozdní sycení kontrastní látkouÚvod
Magnetická rezonance srdce (cardiac magnetic resonance – CMR) je zobrazovací metodou založenou na zcela jiných fyzikálních principech než ostatní v medicíně používané zobrazovací metody, a nabízí tak zcela jedinečné vlastnosti pro zobrazování tkání. Již od počátku byla s úspěchem používána při zobrazování nepohybujících se, „stacionárních“ orgánů. Její využití v kardiologii pro zobrazování pracujícího, pohybujícího se srdce pak bylo umožněno EKG hradlováním (tzv. gating) a použitím dalších metod potlačujících artefakty způsobené dechovými pohyby. Díky unikátním možnostem, především v oblasti tkáňové charakterizace, a narůstající dostupnosti je CMR v běžné kardiologické praxi stále více využívána.
Ke komplexnímu vyšetření srdce CMR se používá řada snímkovacích sekvencí prováděných v různých zobrazovacích rovinách řezu. Základní součást CMR protokolu sloužící k vyhodnocení morfologie a funkce jednotlivých srdečních oddílů představují tzv. steady state free precesion (SSFP) sekvence, neboť vykazují vysokou prostorovou rozlišitelnost, a poskytují tak velmi dobrou vizualizaci tkáňového rozhraní myokard-krev; navíc je snímkování umožněno v (nekonečně) mnoha rovinách, a tím bez nutnosti geometrických asumpcí, což poskytuje podstatně přesnější a reproducibilnější výsledky při volumetrické analýze velikosti srdečních oddílů a hodnocení hmotnosti srdečních komor než např. echokardiografické vyšetření. Vyšetření CMR je proto v současnosti považováno za zlatý standard pro vyhodnocování globální i regionální funkce srdečních komor i posouzení síly jejich stěn, resp. hmotnosti. Pro tkáňovou CMR charakteristiku je pak zásadní různá protonová denzita jednotlivých tkání. V T1 vážených obrazech nacházíme především hypersignální (tj. v podobě bílé barvy) zobrazení tukové tkáně. T2 vážené obrazy využíváme v diagnostice edému myokardu, neboť tkáně s vyšším obsahem volných molekul vody jsou zde hypersignální (mají tedy v CMR obraze bílou barvu) [1]. Speciální T2* sekvence je specifická pro zobrazení tkání s významnou depozicí železa, jak bude zmíněno později. T1 vážené obrazy mají význam v detekci tukové tkáně, která má v této sekvenci vysoký signál; při použití sekvencí s potlačením signálu tukové tkáně (tzv. SPIR) je tuková tkáň naopak hyposignální, tmavé barvy. Velmi významné je pro tkáňovou CMR charakteristiku zobrazení myokardu po intravenózním podání kontrastní látky na bázi sloučenin gadolinia, a to jak ihned po její aplikaci, tak především odloženě. V prvých cyklech následujících po podání kontrastní látky je možné hodnotit klidovou, ev. i zátěžovou perfuzi myokardu. Gadoliniová kontrastní látka se pak následně ze zdravého myokardu rychle vyplavuje. Naopak z oblastí, v nichž je přítomna expanze intersticiálního prostoru myokardu, u akutního poškození nekrózou a u chronického typicky fibrózou, se kontrastní látka ze srdečního svalu vyplavuje daleko pomaleji, čímž dochází ke zkrácení T1 relaxačního času v daném okrsku myokardu. Klasicky je využíváno toto odložené postkontrastní zobrazení s odstupem 10–20 min po podání kontrastní látky, kdy je hodnoceno tzv. pozdní sycení gadoliniem, označované nejčastěji zkratkami LGE či DGE (late či delayed gadolinium enhancement). Přítomnost LGE a jeho lokalizace umožňují nejen odlišení ischemického srdečního postižení od neischemických kardiomyopatií, ale jak bude popsáno níže, je často využíváno i v diferenciální diagnostice mezi různými typy neischemických kardiomyopatií. Zatímco LGE u neischemických kardiomyopatií nabývá dle jejich typu různých podob, pro ischemické postižení je typické LGE v místech odpovídajících svou lokalizací povodí infarktové tepny a počínající vždy od ischemií nejvíce postižené subendokardiální vrstvy myokardu; v případě transmurální jizvy po infarktu myokardu je pak i LGE přítomen transmurálně [2].
V současnosti je též studován přínos kvantitativního T1 a T2 mapování. Tyto technologie dále výrazně zlepšují tkáňovou charakteristiku CMR vyšetření [3,4], neboť se jedná o kvantitativní vyšetření, při kterém je každému pixelu přímo přisouzena hodnota místně příslušného relaxačního času T1 nebo T2. Nativní T1 mapování, tj. bez užití kontrastních gadoliniových látek, které využívá snímkování v tzv. MOLLI (modified Look-Locker inversion recovery) či ShMOLLI (shortened-MOLLI) sekvencích, nabízí další informace o struktuře myokardu v případech, v nichž LGE selhává [5]. T1 relaxační čas narůstá v akutních situacích při edému tkáně, u chronických patologií pak typicky při difuzní intersticiální fibróze či infiltraci amyloidem, naopak se výrazně snižuje v místech akumulace lipidů, glykosfingolipidů, a depozice železa. Měření poměru změn T1 relaxačního času při nativním CMR vyšetření a po podání gadolinia pak umožňuje přesněji kvantifikovat velikost extracelulárního prostoru [6]. Kvantitativní T2 mapování by mohlo být přínosné především v CMR diagnostice akutní myokarditidy, jak o tom bude pojednáno detailněji v následujícím textu, a také v hodnocení srdeční hemochromatózy [7].
Magnetická rezonance tak dokáže významným způsobem zpřesnit diagnostiku řady myokardiálních patologií včetně myokarditidy a celé řady kardiomyopatií, což je tématem tohoto přehledného sdělení, v němž budou postupně probrány jednotlivá myokardiální postižení, v jejichž diagnostice se CMR uplatňuje.
Dilatační kardiomyopatie
Dilatační kardiomyopatie (DKMP) je primárně charakterizována dilatací a systolickou dysfunkcí levé komory. Dilatována je velmi často i levá síň jakožto odraz diastolické dysfunkce levé komory či významné mitrální regurgitace; vyjádřena může být i dilatace pravostranných srdečních oddílů. Dilatační kardiomyopatie je frekventní příčinou srdečního selhání a v současnosti představuje nejčastější indikaci k srdeční transplantaci. Etiologie DKMP je různorodá. U získaných forem DKMP se může jednat o následek postižení myokardu infekcí (blíže rozebráno v popisu myokarditidy), autoimunitním procesem, nadměrným užíváním alkoholu, podáváním kardiotoxické (většinou cytostatické) léčby, dlouhodobou nekorigovanou tachyarytmií, vzácněji pak nutričním deficitem v rámci endokrinních poruch aj. Familiární, geneticky podmíněné formy DKMP se mohou vyskytovat jednak jako izolované postižení srdce či v rámci různých muskuloskeletálních onemocnění (Duchenneova choroba apod). Magnetická rezonance dokáže ze všech zobrazovacích metod nejpřesněji kvantifikovat anatomické i funkční abnormality srdečních oddílů vyskytující se u DKMP, a je tak považována za zlatý standard hodnocení velikosti a funkce komor i síní u této kardiomyopatie [8]. Magnetická rezonance u DKMP typicky nachází dilataci levé komory se zvětšením jejích enddiastolických i endsystolických objemů s různou mírou systolické dysfunkce, resp. snížené ejekční frakce podmíněné většinou difuzní hypokinezí nezesílených stěn; u nemocných s blokádou levého raménka Tawarova je často vyjádřena dyssynchronie stahu levé komory v důsledku abnormálního pohybu septa komor (tzv. septal flash). Stupeň systolické dysfunkce levé komory je u DKMP výrazným negativním prognostickým markerem [9]. Velmi častý je nález dilatace levé síně, dilatovány mohou být i pravostranné oddíly a vyjádřena systolická dysfunkce, tj. snížená ejekční frakce pravé komory. Vzácně dochází k rozvoji intrakavitárního trombu, nejčastěji v hrotu levé komory, který je pomocí CMR velmi dobře diferencovatelný. T2 mapování je u chronické DKMP typicky negativní, tj. neprokazuje edém myokardu, který by odrážel jeho akutní postižení. Samozřejmou a významnou součástí vyšetřovacího protokolu je hodnocení LGE, tj. fibrózy myokardu, které je primárně prováděno k odlišení ischemické a neischemické etiologie systolické dysfunkce levé komory. Jak bylo již zmíněno výše, u ischemického postižení nacházíme většinou přítomnost LGE v lokalizaci odpovídající infarktové tepně a vždy je postižena subendokardiální oblast. Dle závažnosti postižení, velikosti fibrózy, zasahuje LGE hlouběji do myokardu směrem k epikardu, při postižení celé tloušťky stěny komory fibrózou nabývá transmurálního rozsahu. Nepřítomnost typického LGE obrazu ischemického postižení má velmi vysokou negativní prediktivní hodnotu (94 %) k vyloučení ischemické etiologie systolické dysfunkce levé komory, resp. srdečního selhání [10]. Je nutno zdůraznit, že negativní nález při koronarografickém vyšetření nemusí vzhledem k možné předchozí časné rekanalizaci trombem uzavřené infarktové tepny zcela vylučovat ischemickou etiologii kardiálního postižení, to samé platí i pro ev. prolongovaný vazospastický uzávěr koronární arterie vedoucí k infarzaci myokardu. Lze shrnout, že kombinace normálního koronarografického nálezu s výsledkem CMR neprokazujícím ischemický typ LGE s velmi vysokou pravděpodobností odliší ischemickou a neischemickou etiologii kardiálního postižení [11]. Prevalencí neischemického typu LGE u DKMP se zabývala celá řada studií [12–16]. Asi u 60 % pacientů s DKMP nelze LGE, resp. fibrózu myokardu současnými CMR technikami detekovat. U zbývajících jedinců je LGE přítomen nejčastěji midmyokardiálně, typicky bazálně či midventrikuláně v septu komor (obr. 1); možná je též lokalizace subepikardiální v oblastech volných stěn levé komory [4,6,7]. Důležitou skutečností je, že průkaz LGE odrážející přítomnost intramyokardiální fibrózy se zdá být u pacientů s DKMP nezávislým rizikovým faktorem. Narůstající počet studií totiž ukazuje, že přítomnost LGE implikuje větší náchylnost k maligním komorovým arytmiím i opakovaným hospitalizacím pro srdeční selhání [17,18]. Přítomnost, ev. i kvantita LGE tak potenciálně může být dalším rizikovým faktorem ve stratifikaci pacientů s DKMP k primárně preventivní implantaci ICD, v tomto smyslu je ale nutné vyčkat výsledků velkých multicentrických studií. Je nutné ovšem zdůraznit, že hodnocení LGE je v rutinní praxi založeno na kvalitativním hodnocení rozdílů mezi zdravou hypointenzní tkání a patologickými hyperintenzními ložisky akumulovaného gadolinia. Během přirozeného vývoje DKMP se však u většiny případů předpokládá spíše difuzní fibrotizace myokardu. Tento fenomén může být zodpovědný za nedostatek kvalitativně „zdravé“ tkáně při CMR vyšetření, jež neumožňuje správně diagnostikovat přítomnost LGE. To je pravděpodobně podkladem negativního výsledku pro hodnocení fibrózy pomocí LGE u výše zmíněných 60 % nemocných s DKMP. Zdá se, že přímé kvantitativní hodnocení fibrotizace myokardu pomocí nativního T1 relaxačního času, tzv. nativní T1 mapování, by mohlo být objektivnějším měřítkem depozice kolagenu v myokardu, neboť tento parametr dle publikovaných prací velmi pravděpodobně inverzně koreluje s intersticiálním obsahem kolagenu v myokardu [19]. V práci Puntmannové et al bylo u nemocných s DKMP popsáno signifikantní prodloužení nativního T1 relaxačního času oproti zdravým kontrolám se 100% senzitivitou a 96% specificitou [20]. V jiné práci byla demonstrována silná pozitivní asociace mezi narůstajícím T1 relaxačním časem, tj. difuzní fibrózou myokardu, a pokročilostí DKMP [5].
Obr. 1. Midmyokardiální pruhovitá ložiska pozdního sycení kontrastní látkou (LGE) v septu komor i volné stěně levé komory (žluté šipky) u nemocného s dilatační kardiomyopatií; projekce na krátkou osu levé komory 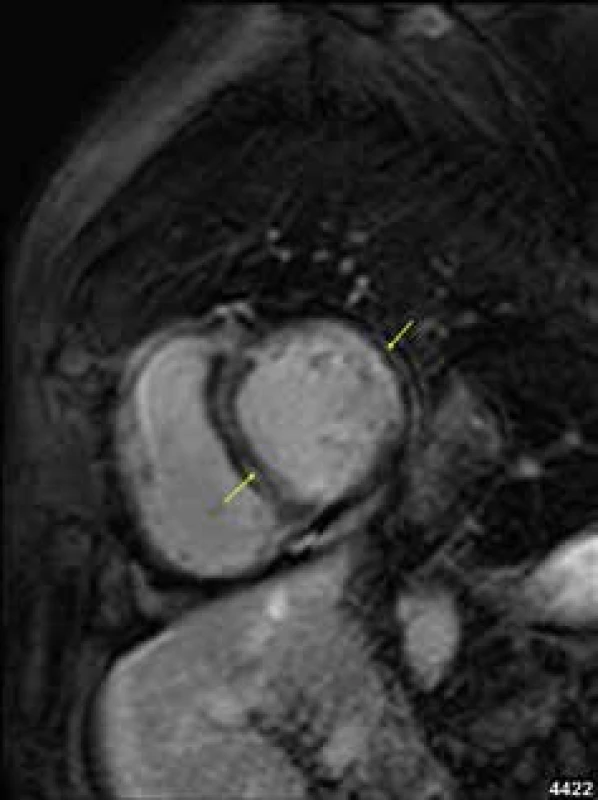
U minima pacientů s morfologicko-funkčním obrazem DKMP a normálním koronarogramem je LGE lokalizovaný subendokardiálně, tento nález může působit diagnostické rozpaky při snaze o diferenciální diagnózu mezi ischemickým postižením a DKMP [7]. Ischemický typ LGE je u těchto jedinců pravděpodobně podmíněn časnou rezolucí trombu v infarktové tepně nebo přechodným spazmem koronární tepny, jak bylo uvedeno výše.
Myokarditida
Myokarditida je zánětlivé onemocnění srdečního svalu infekční či neinfekční etiologie. Klinicky může myokarditida probíhat zcela asymptomaticky, nebo se může projevovat bolestmi na hrudi, akutním srdečním selháním či arytmickými projevy včetně náhlé smrti zapříčiněné maligní komorovou arytmií [21]. Patogeneticky se popisují 3 stadia vývoje onemocnění, pozorovaná ovšem dosud jen na myším modelu virové myokarditidy. V první fázi se jedná o přímé poškození myokardu cytotoxickým působením viru. Na tuto fázi navazuje období aktivace imunitní odpovědi, která se snaží virus v myokardu eliminovat, ale sama též může vést k další akcentaci nemocnění autoimunitními mechanizmy. Při nedostatečnosti této imunitní odpovědi dochází k virové perzistenci, jež dále také negativně působí na srdeční sval. Pokud trvá negativní působení autoimunitní reakce nebo virové perzistence, nastává posléze třetí fáze onemocnění, v níž v důsledku pokračující ztráty myocytů a postupného vývoje fibrózy myokardu dochází postupně k rozvoji obrazu DKMP [22].
Zlatým standardem v diagnostice myokarditidy zůstává i dle recentních doporučení endomyokardiální biopsie nutná k odhalení přesné příčiny myokardiálního zánětu, což pak případně umožňuje nasazení specifické terapie. Endomyokardiální biopsie je však invazivní metodou, navíc s poměrně nízkou senzitivitou a možností tzv. sampling-error [23], tedy nezachycení patologického místa biopsií.
Magnetická rezonance se díky svým vlastnostem (neinvazivnost, bezpečnost, přesnost anatomického i funkčního zobrazení), a především díky možnosti tkáňové charakteristiky stala v posledních letech základní zobrazovací metodou v diagnostickém souboru u pacientů se suspektní myokarditidou. Z morfologicko-funkčního hlediska samozřejmě nejpřesněji ze zobrazovacích metod vyhodnocuje globální i regionální kinetiku myokardu, a dobře tak kvantifikuje případnou dysfunkci jedné nebo obou komor. Dokáže zobrazit i přechodné zesílení myokardu dané edémem tkáně, které může být stejně jako přítomnost perikardiálního výpotku nepřímým markerem aktivního zánětu srdečního svalu [24–28].
Zásadním přínosem je ovšem tkáňová charakteristika myokardu. Zánětlivé postižení myokardu je spojeno se 3 typickými jevy: edémem myokardu, jeho hyperemií se zvýšenou permeabilitou kapilár a rozvojem nekrotických ložisek o rozličné velikosti s následným možným vznikem reparační jizvy.
T2 vážené sekvence, prováděné optimálně v řezech na krátkou osu levé komory, velmi citlivě detekují edém myokardu. Ten může být patrný i kvalitativně jako ohraničené ložisko či ložiska v myokardu s vyšší intenzitou signálu, charakteristicky lokalizované subepikardiálně či midmyokardiálně (obr. 2) [29–33]. Absence lokalizovaných ložisek edému ovšem nevylučuje jeho globální přítomnost, a proto je doporučováno provádět i hodnocení kvantitativní, při němž jsou srovnávány intenzity signálu myokardu a příčně pruhovaného svalstva v T2 váženém obraze získaném v jedné snímkovací sekvenci. Za signifikantní zvýšení poměru signálu myokardu ke kosternímu svalu svědčícímu pro edém myokardu je považována hodnota ≥ 1,9 [26,34]. Kvantitativní hodnocení edému myokardu má však některé limitace. V klinické praxi je zásadní výrazná náchylnost T2 váženého zobrazení k artefaktům nejrůznější etiologie, což výrazně snižuje specificitu vyšetření. Další limitací tohoto přístupu je logicky konkomitantní zánětlivé postižení kosterního svalstva [16].
Obr. 2. Midmyokardiálně lokalizované ložisko edému myokardu (žlutá šipka) u akutní myokarditidy v T2 váženém zobrazení; projekce na krátkou osu levé komory 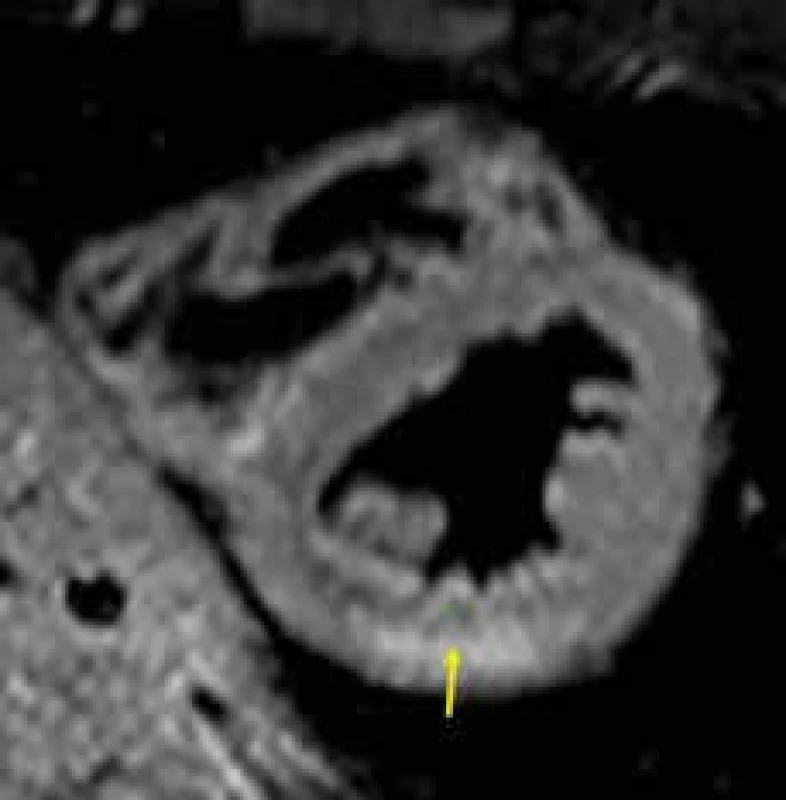
K zobrazení další tkáňové charakteristiky, hyperemie se zvýšenou kapilární propustností, je využívána technika kvantitativního hodnocení časného sycení kontrastní látkou na bázi gadolinia (early gadolinium enhancement – EGE) během několika prvních minut po jejím podání v T1 váženém obraze, opět optimálně v řezech na krátkou osu levé komory [35,36]. Podobně jako při kvantitativním posuzování přítomnosti edému myokardu je při hodnocení EGE využíváno srovnání signálové intenzity myokardu a kosterního svalstva. Za pozitivní pro přítomnost hyperemie je považován nález alespoň 4krát vyšší intenzity signálu myokardu, či absolutní nárůst intenzity myokardu prekontrastně a postkontrastně o více než 45 % [25].
Na rozdíl od edému a hyperemie myokardu představuje nekróza, resp. fibróza prokazovaná metodou LGE většinou ireverzibilní důsledek myokarditidy. Ložiska LGE jsou u akutní myokarditidy typicky lokalizována subepikardiálně v oblasti volných stěn levé komory (nejčastěji laterální), případně midmyokardiálně, a v různém rozsahu se šíří tloušťkou stěny (obr. 3). Relativně častý je jejich multifokální výskyt. Zásadním pravidlem je, že není přítomno izolované postižení subendokardiálně, čímž se nález odlišuje od ischemicky navozené nekrózy, resp. jizvy [37]. Využití LGE v diagnostice akutní myokarditidy bylo v porovnání s ostatními technikami tkáňové charakteristiky – edém a EGE – dokumentováno doposud největší řadou studií [38–40]. V řadě případů dochází po odeznění akutní fáze myokarditidy k postupnému vymizení ložisek LGE. To se vysvětluje retrakcí jizvy při jejím pokračujícím hojení, během něhož se oblasti fibrózy zmenšují až pod úroveň zachytitelnou pomocí techniky LGE [2]. Perzistující ložiska LGE jsou typická u nemocných s trvající dilatací a dysfunkcí levé komory. V roce 2009 byla skupinou odborníků publikována tzv. Lake Louise kritéria CMR diagnostiky myokarditidy (tab. 1). Autoři doporučují hodnocení všech 3 hlavních tkáňových kritérií myokardiálního zánětu, tj. edému, EGE a LGE, a dále vedlejších, podpůrných morfologicko-funkčních známek možné myokarditidy v podobě dysfunkce levé komory a perikardiálního výpotku. Pokud jsou přítomna aspoň 2 ze 3 tkáňových kritérií myokarditidy, činí senzitivita vyšetření 67 %, specificita 97 % a diagnostická přesnost 78 %. Jelikož využití EGE je limitováno řadou faktorů, především výraznou náchylností k artefaktům způsobeným arytmiemi či pohyby vyšetřovaného, je v rutinní klinické praxi nejčastěji při CMR studii suspektní myokarditidy kvalitativně posuzována přítomnost LGE a edému myokardu. Recentně byla publikována též z klinického pohledu důležitá práce italských autorů ukazující, že největší senzitivitu má CMR vyšetření pro myokarditidu projevující se bolestmi na hrudi, naopak u manifestace srdečním selháním a dysfunkcí levé komory či arytmickými projevy je citlivost nízká [41]. Prognostický význam CMR vyšetření u klinicky suspektní akutní myokarditidy ukázala práce Vermese et al, ve které byla pozitivita edému myokardu významně asociována s následným zlepšením ejekční frakce levé komory [42].
Obr. 3. Subepikardiální splývavá ložiska pozdního sycení kontrastní látkou (LGE) na boční stěně levé komory (žlutá šipka) u nemocného s akutní myokarditidou; čtyřdutinová projekce 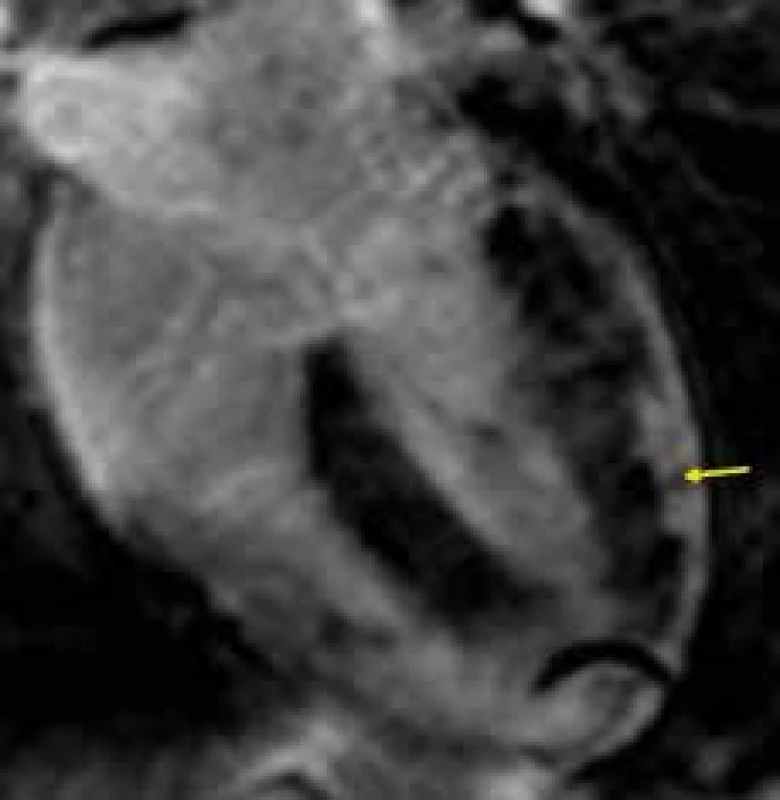
Tab. 1. Lake Louise kritéria pro CMR diagnostiku akutní myokarditidy. Upraveno podle [31] ![Lake Louise kritéria pro CMR diagnostiku akutní myokarditidy. Upraveno podle [31]](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/e1cc4013cdcf6b398a27ade5ea5f219e.jpg)
CMR – srdeční magnetická rezonance (cardiac magnetic resonance) EGE – časné sycení kontrastní látkou (early gadolinium enhancement) LGE – pozdní sycení kontrastní látkou (late gadolinium enhancement) V současnosti je též zkoumáno využití nativního T1 a T2 mapování v diagnostice myokarditidy. Dle práce Bohnena et al byl u endomyokardiální biopsií verifikované aktivní myokarditidy globální T2 relaxační čas signifikantně zvýšen (cut-off hodnota T2 > 60 ms) oproti pacientům bez bioptických známek aktivní myokarditidy [4]. Hodnota globálního T2 relaxačního času byla v diagnostice akutní myokarditidy dokonce superiorní vůči výše uvedeným Lake Louise kritériím. Vzhledem k přítomnosti fokálního či globálního edému myokardu, tj. zvětšení intersticiálního prostoru, je u myokarditidy kromě T2 relaxačního času přítomen i nárůst nativního T1 relaxačního času, resp. též poměrný nárůst objemu extracelulárního objemu definovaný srovnáním předkontrastního a postkontrastního T1 relaxačního času [3,4,43].
Hypertrofická kardiomyopatie
Hypertrofická kardiomyopatie (HKMP) je v naprosté většině případů autozomálně dominantně dědičné onemocnění podmíněné mutacemi v genech kódující sarkomerické proteiny; v 5–10 % se pak jedná o tzv. nesarkomerickou formu či fenokopii HKMP, asociovanou s vrozenou poruchou metabolizmu (např. Fabryho choroba), mitochondriopatií, neuromuskulárním onemocněním (např. Friedreichova ataxie) či infiltrativní chorobou (např. amyloidóza) [44]. Prevalence HKMP v obecné populaci dosahuje asi 0,2 %, což z ní činí nejčastěji se vyskytující geneticky podmíněnou kardiomyopatii [45,46]. Hypertrofická kardiomyopatie je u dospělých definována přítomností zesílené stěny levé komory v kterémkoli jejím segmentu ≥ 15 mm. Toto zbytnění není primárně důsledkem abnormálního zatížení komorového myokardu (např. arteriální hypertenzí, chlopenní vadou atd) [36]. Nález srdeční hypertrofie bez nálezu hemodynamické příčiny způsobující srdeční hypertrofii by tak měl vést k bližšímu pátrání po její etiologii, sarkomerické či nesarkomerické. Hypertrofickou kardiomyopatií v užším smyslu rozumíme nejčastější formu HKMP způsobenou mutacemi sarkomerických proteinů; některými vybranými fenokopiemi – Fabryho chorobou či srdeční amyloidózou – se zabýváme v samostatných částech tohoto textu dále.
Hypertrofická kardiomyopatie může probíhat zcela bez klinických projevů, nebo se projevovat symptomy jako je dušnost, bolest na hrudi, presynkopy až synkopy; prvním příznakem onemocnění může ale být i náhlá srdeční smrt. U mladých sportujících jedinců (do 35–40 let) je HKMP považována za hlavní příčinu náhlé srdeční smrti [47]. Diagnóza HKMP se primárně opírá o klinické známky a echokardiografické vyšetření, které se soustředí nejen na posouzení síly stěn jednotlivých segmentů, ale současně i na průkaz případně přítomné obstrukce levé komory, která je nejčastěji vyjádřena v oblasti výtokového traktu, může se však vyskytnout i midventrikulárně či apikálně. Využití morfologicko-funkčního zobrazení CMR je u nemocných s HKMP doporučováno v případě horší echokardiografické vyšetřitelnosti či při přítomnosti nebo podezření na izolovanou apikální hypertrofii a apikální aneuryzma (obr. 4) [48,49]. Magnetická rezonance logicky poskytuje vyšší přesnost v oblasti zhodnocení síly stěn jednotlivých segmentů levé komory než echokardiografie. Dle práce Rickerse et al by u 6 % pacientů s HKMP nebylo toto onemocnění diagnostikováno, pokud by síla stěn levé komory byla hodnocena jen echokardiograficky [50]. Navíc u 50 % pacientů s HKMP jsou oblasti hypertrofie lokalizovány do méně než poloviny srdečních segmentů, včetně asi 10 % pacientů, u nichž je hypertrofie lokalizována výlučně jen ložiskově do jednoho či dvou srdečních segmentů [51]. Zde je nutno uvést, že celková hmotnost levé komory, která je velmi dobře pomocí CMR kvantifikovatelná, nemusí být u HKMP zvýšena, pokud je hypertrofie lokalizována jen do několika málo segmentů [52]. Magnetická rezonance též precizně zobrazuje anatomii mitrální chlopně i subvalvulárního aparátu s papilárními svaly a dokáže zachytit systolický dopředný pohyb předního cípu mitrální chlopně (SAM), který je podkladem nejčastější obstruktivní formy HKMP dynamické obstrukce ve výtokovém traktu levé komory. Zatímco však sílu stěn popisuje CMR přesněji než echokardiografické vyšetření, při stanovování tíže obstrukce výtokového traktu levé komory dosahuje echokardiografie, konkrétně dopplerovské vyšetření daleko větší přesnosti a pro její kvantifikaci zůstává zlatým neinvazivním standardem [53].
Obr. 4. Izolované zesílení svaloviny hrotu levé komory u apikální hypertrofické kardiomyopatie (žlutá šipka); dvoudutinová projekce 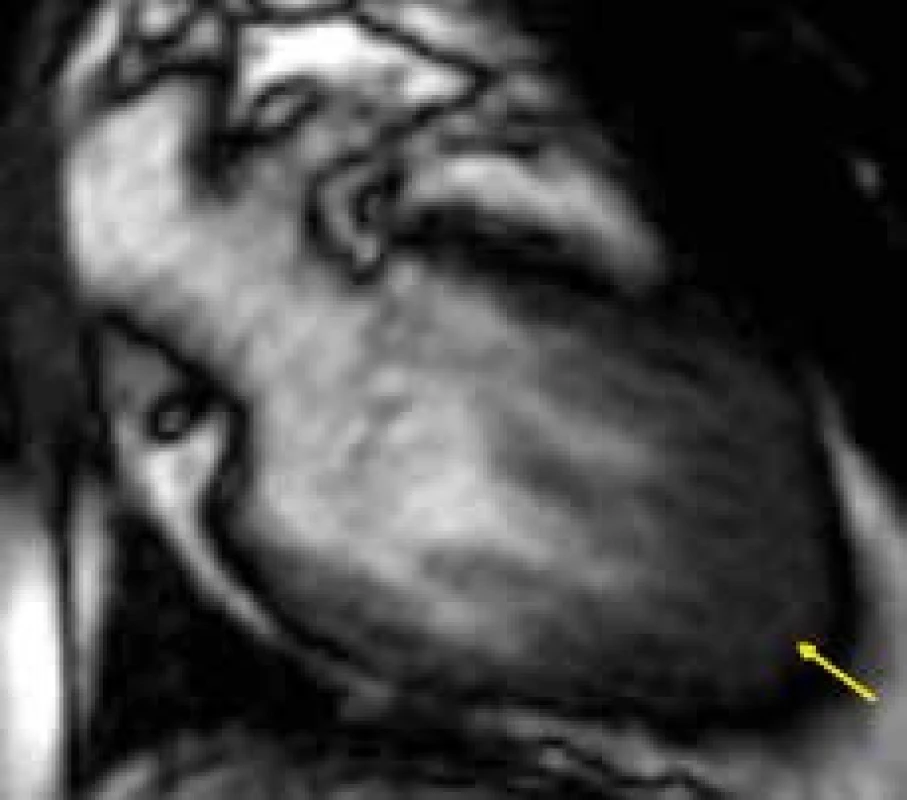
Vyšetření CMR by mohlo mít svou úlohu i v detekci jedinců, kteří jsou nositeli kauzální sarkomerické mutace pro HKMP, ale není u nich (zatím) vyjádřena hypertrofie levé komory (tzv. genotype positive-phenotype negative jedinci). Pozornost je v tomto směru věnována především nálezu tzv. myokardiálních krypt detekovaných převážně v inferoseptální oblasti. V pionýrské práci Germanse et al byly tyto krypty zjištěny u 81 % nositelů mutace pro sarkomerickou HKMP bez vyjádřené hypertrofie myokardu [54]. Asociace myokardiálních krypt s preklinickou formou HKMP byla následně dokumentována i ve studii anglických autorů [55]. Recentně se ovšem objevily také práce, které jasný kauzální vztah mezi myokardiálními kryptami a HKMP zpochybňují, neboť přítomnost krypt popisují i u normální populace i u nemocných s hypertenzní hypertrofií levé komory atd [56–58]. Význam detekce myokardiálních krypt v preklinické diagnostice HKMP tedy není v současnosti zcela jasný.
V komplexním hodnocení pacientů s HKMP hraje významnou roli stratifikace rizika náhlé smrti. V současné době je identifikováno několik rizikových faktorů, které jsou dávány do souvislosti s vyšším rizikem náhlého úmrtí [36]. Myokardiální fibróza detekovatelná pomocí LGE bývá nacházena u HKMP u pacientů v poměrně širokém rozmezí 33–86 % a její výskyt je dle některých autorů možné považovat za další rizikový faktor náhlé smrti [59,60]. Nejčastěji je fibróza u jedinců s HKMP vyjádřena v podobě midmyokardiálních ložisek LGE různé velikosti, lokalizovaných či splývajících, typicky, byť ne výhradně, v oblasti hypertrofického septa komor, a to predilekčně v místech jeho největšího zesílení, a také v tzv. inzerčních bodech, tedy v napojení svaloviny pravé komory do oblasti komorového septa (obr. 5) [62,63]. V konečné fázi onemocnění, která se vyvíjí asi u 5 % nemocných, dochází ke ztenčování stěny dilatující levé komory, jejíž systolická funkce progresivně deterioruje. U těchto jedinců pak bývá LGE vyjádřen globálně v rozsahu celé síly stěny, jakožto odraz těžké difuzní fibrotizace [64,65]. Přítomnost, resp. rozsah LGE patrně představuje jeden z markerů progresivní dilatace levé komory u jedinců s HKMP [56]. Bylo ukázáno, že rozsah LGE nepřímo úměrně odpovídá hodnotě ejekční frakce levé komory [66] a současně poměrně dobře koreluje se známými rizikovými faktory náhlé srdeční smrti [56]. Několik studií prokázalo asociaci mezi přítomností LGE a výskytem komorových tachykardií při holterovském EKG monitorování [67–69] či výskytem adekvátních výbojů ICD [70,71]. Dle metaanalýzy studií hodnotících přítomnost LGE a prognózu nemocných s HKMP [72] je patrný vztah mezi přítomností LGE a kardiovaskulární mortalitou, úmrtím na srdeční selhání a celkovou mortalitou, nicméně prokázán byl jen určitý trend ke zvýšení rizika náhlé srdeční smrti. Současná doporučení Evropské kardiologické společnosti proto, na rozdíl od amerických, zatím nepodporují využití LGE v rámci stratifikačního schématu primární prevence náhlého úmrtí u HKMP, a to ani jako pomocného faktoru [36].
Obr. 5. Řada splývajících ložisek pozdního sycení kontrastní látkou (LGE) (žluté šipky) v komorovém septu a přilehlé oblasti přední stěny u nemocného s hypertrofickou kardiomyopatií; projekce na krátkou osu levé komory 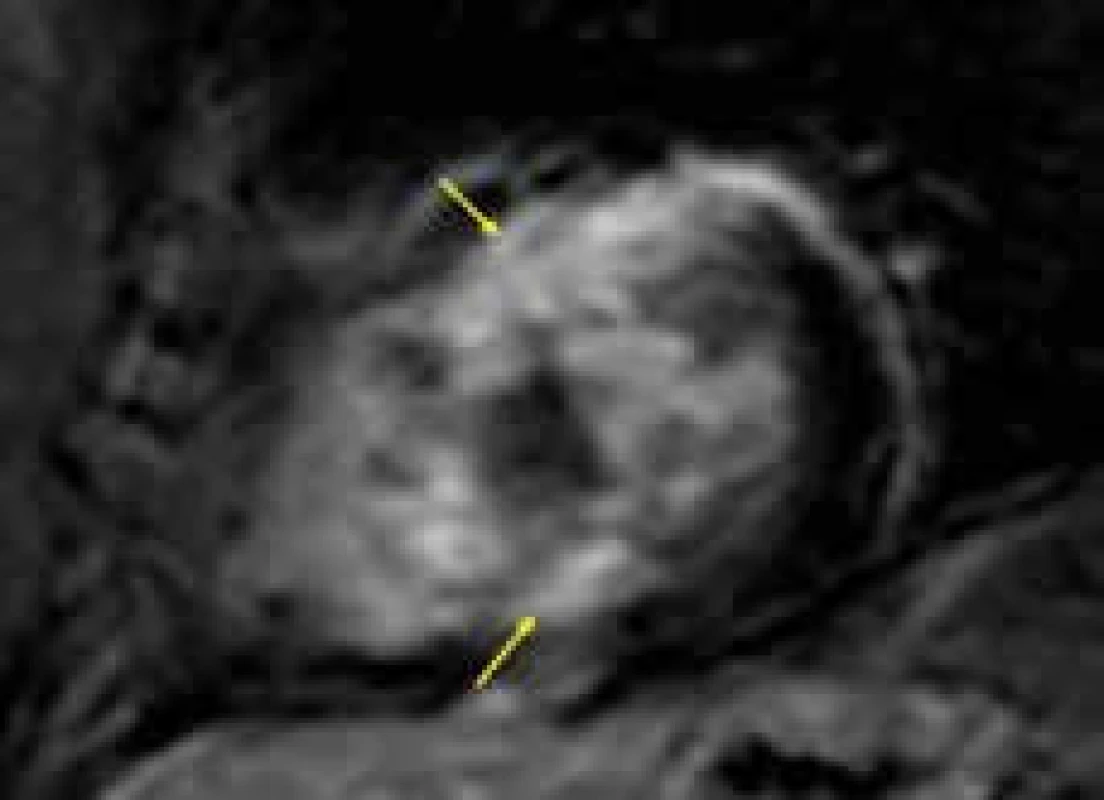
Zobrazení CMR u pacientů s HKMP nachází své uplatnění i v rámci vyšetření před případnou septální redukční terapií, tj. chirurgickou myektomií či katetrizační septální alkoholovou ablací. Smyslem zobrazovacího vyšetření u symptomatických pacientů s obstrukcí je co nejlépe charakterizovat mechanizmus obstrukce výtokového traktu levé komory a proveditelnost jednotlivých terapeutických postupů. K této co možná nejpřesnější orientaci je výhodné využití unikátních zobrazovacích vlastností CMR, neboť toto vyšetření umožňuje velmi přesně zobrazit morfologii interventrikulárního septa a přesněji naplánovat rozsah plánované myektomie či detailně popsat změněnou morfologii papilárních svalů a závěsného aparátu mitrální chlopně, a tak lépe naplánovat chirurgickou plastiku těchto struktur [73–75]. Magnetická rezonance je využívána i ve sledování nemocných po těchto zmiňovaných intervencích ke kvantifikaci alkoholem vyvolané nekrózy, k hodnocení přetrvávající obstrukce výtokového traktu a ke sledování průběhu remodelace levé komory [76–78].
Využitím T1 mapování se u HKMP se zabývala již celá řada prací. Z klinického hlediska je významná studie Hinojara et al, která ukázala, že jak nativní T1 relaxační čas, tak i objem extracelulárního prostoru získaný srovnáním nativního a postkontrastního T1 mapování jsou signifikantně zvýšeny u pacientů s HKMP ve srovnání s jedinci s hypertrofií levé komory v důsledku arteriální hypertenze [79]. Signifikantní rozdíl oproti nemocným s hypertenzní hypertrofií byl prokázán i u pacientů s HKMP bez přítomnosti LGE. V této studii bylo též zjištěno, že i jedinci s pozitivním genotypem pro HKMP, ale dosud bez fenotypicky vyjádřené HKMP, vykazují vyšší hodnoty nativního T1 relaxačního času než zdraví kontrolní jedinci. T1 mapování tak může výrazně pomoci jak v diferenciální diagnostice HKMP vůči hypertrofii levé komory navozené arteriální hypertenzí, tak i v detekci příbuzných nemocných s HKMP, kteří jsou v riziku budoucího rozvoje kardiomyopatie.
Arytmogenní kardiomyopatie pravé komory
I v etiopatogenezi arytmogenní kardiomyopatie pravé komory (AKMP) se patrně u naprosté většiny případů uplatňuje dědičnost, typicky v důsledku mutací v genech kódujících proteiny mezibuněčných spojení, tzv. desmosomů. Prevalence onemocnění je odhadována na 1 : 5 000 [80]. Arytmogenní kardiomyopatie pravé komory je zodpovědná za asi 4 % náhlých úmrtí mladých sportovců [81], endemicky se více vyskytuje v Itálii, kde je hlavní příčinou (asi 20 %) náhlých úmrtí mladých sportujících jedinců. Patofyziologie AKMP spočívá v progredující náhradě kardiomyocytů vazivovou či vazivově-tukovou tkání, ve většině případů iniciálně v oblasti volné stěny pravé komory. Tento proces vede k regionálnímu ztenčování stěny komory a poruchám kinetiky dosahujícím až obrazu aneuryzmatu, zároveň dochází k dilataci a následně celkové dysfunkci pravé komory. S postupem choroby dochází velmi často i k současnému postižení komory levé. Recentně byly ovšem popsány i případy zcela či téměř izolovaného postižení levé komory [82]. Proto se v současnosti začíná hovořit o AKMP s postižením pravé, levé nebo obou komor.
Onemocnění se nejčastěji manifestuje na počátku dospělosti arytmicky podmíněnými symptomy v podobě palpitací, (pre)synkop, ale jeho prvým projevem může být i náhlá smrt, jak bylo již zmíněno výše. Selhávání pravé či levé komory se obvykle objevuje až v pokročilých stadiích AKMP. Diagnostika AKMP je obecně poměrně složitá a je založena na splnění skupinou expertů navržených velkých a malých diagnostických kritérií, jež byla naposled revidována v roce 2010 [83]. Je nutné zdůraznit, že se jedná o kritéria určená pro diagnostiku pouze pravokomorové formy AKMP.
Magnetická rezonance je v klinické praxi považována za zobrazovací metodu volby při suspekci na AKMP [84]. Lépe než např. echokardiografie posuzuje regionální i celkovou systolickou dysfunkci pravé komory a její dilataci. Regionální akineza či aneuryzma stěny pravé komory představují dle současných názorů nejspecifičtější CMR známky onemocnění při postižení pravé komory, i když jejich vyhodnocení může být obtížné vzhledem k velké variabilitě nálezů morfologie pravé komory i u zdravých jedinců. Dle výše citovaných doporučení pro diagnostiku pravokomorové AKMP patří mezi hlavní kritéria CMR nález regionální akinezy, dyskinezy či dyssynchronního pohybu pravé komory v kombinaci s přítomností její dilatace či systolické dysfunkce s EF ≤ 40 % (obr. 6) [74]. Pro časnou diagnostiku AKMP pravé komory byla americkými autory navržena přítomnost tzv. známky akordeonu, jakési regionální zprohýbání stěny pravé komory v predilekčních lokalizacích subtrikuspidálního regionu a výtokového traktu pravé komory [85].
Obr. 6. Lokalizované aneuryzma báze spodní stěny pravé komory v subtrikuspidální oblasti (žlutá šipka) u nemocného s arytmogenní kardiomyopatií pravé komory; projekce na vtok pravé komory 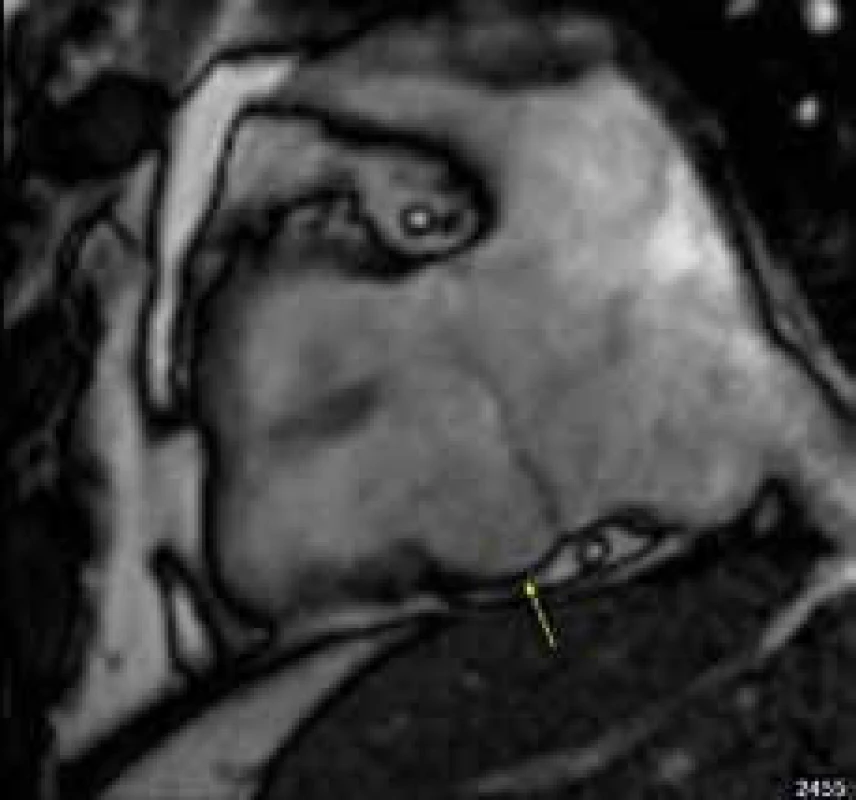
Pomocí T1 vážených sekvencí dokáže CMR detekovat přítomnost tukové tkáně v myokardu. V tuto CMR tkáňovou charakteristiku byla koncem 20. století vkládána velká naděje. Nález tukové přestavby stěny pravé komory však může být falešně pozitivní v důsledku zkreslení přítomností tukové tkáně v naléhajícím epikardu a především ani přítomnost tukové tkáně přímo v myokardu není jasnou známkou onemocnění, neboť se někdy nachází i u zdravých jedinců [86]. Nález tukové přestavby je tak součástí diagnostických kritérií AKMP pravé komory pouze pokud je zjištěn endomyokardiální biopsií, její zjištění při CMR je v současnosti bráno jen jako pomocný ukazatel. Naopak jako velice slibné se v oblasti neinvazivní tkáňové charakteristiky ukazuje hodnocení jizvení stěny pravé komory pomocí techniky LGE [87]. Jednak s relativně uspokojivou mírou přesnosti konfirmuje přítomnost fibrotické přestavby stěny komory, a dále se ukazuje, že přítomnost LGE je spojeno s vyšším rizikem inducibility komorové tachykardie při elektrofyziologickém vyšetření (obr. 7) [78,88]. Detekce LGE by tak i u AKMP mohla přispívat ke stratifikaci rizika náhlé smrti, k přesnému posouzení prognostické hodnoty LGE u AKMP je ovšem třeba opět vyčkat výsledků větších multicentrických studií. Přestože současná publikovaná diagnostická kritéria pravokomorové AKMP v sobě nezahrnují hodnocení fibrotické přestavby myokardu pomocí CMR, lze odůvodněně přepokládat, že v jejich budoucí inovované verzi bude přítomno i její posouzení LGE technikou.
Obr. 7. Difuzní transmurální pozdní sycení kontrastní látkou (LGE) celé volné stěny pravé komory (žluté šipky) u pokročilého stadia arytmogenní kardiomyopatie pravé komory; projekce na krátkou osu levé komory 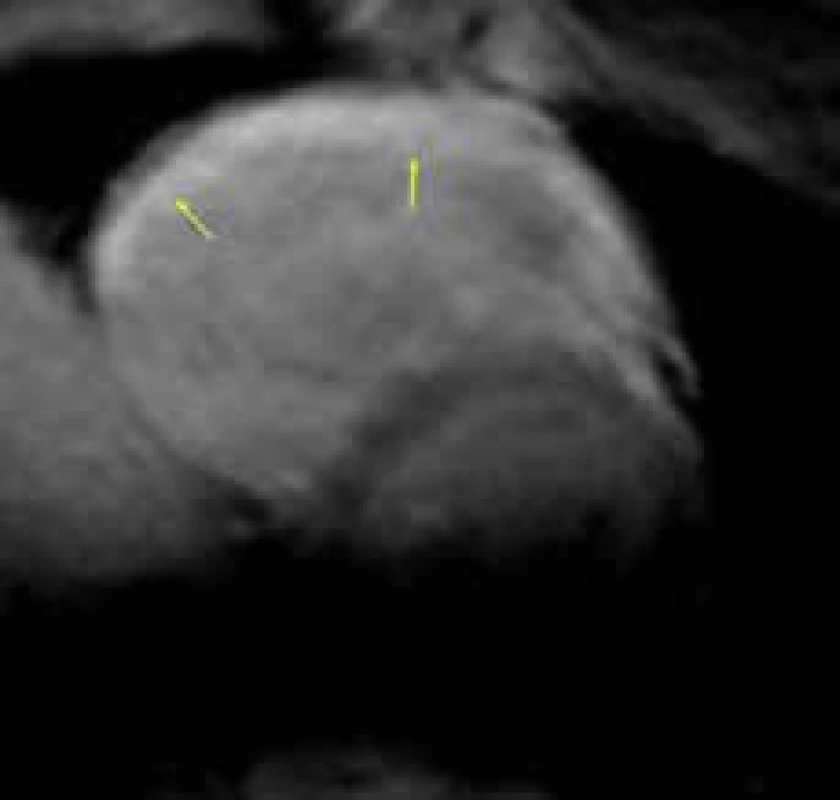
Jak bylo již uvedeno, recentně byly popsány i formy AKMP s izolovaným postižením myokardu levé komory. Typicky se jedná o nemocné s mírnou systolickou dysfunkcí nezvětšené či lehce dilatované levé komory, kteří se manifestují arytmickými projevy v důsledku běhů nesetrvalých či setrvalých komorových arytmií [89]. V těchto případech je nutné vždy v diferenciální diagnóze na AKMP myslet, podobně jako na sarkoidózu a jiné dominantně arytmicky se projevující kardiomyopatie. Magnetická rezonance dokáže podpořit suspekci na AKMP levé komory na základě tkáňové charakteristiky LGE, která prokazuje subepikardiální až midmyokardiální fibrózu myokardu, spíše v podobě pruhu LGE než jeho menších ložisek.
Práce byla podpořena projektem PRVOUK P35/LF1/5.
prof. MUDr. Tomáš Paleček, Ph.D.
tpalec@lf1.cuni.cz
II. interní klinika – klinika kardiologie a angiologie 1. LF UK a VFN v Praze
www.vfn.cz
Doručeno do redakce 19. 6. 2016
Přijato po recenzi 1. 8. 2016
Zdroje
Seznam literatury obsahuje pouze výběr recentních literárních odkazů. Úplný seznam literatury naleznete na www.vnitrnilekarstvi.eu.
1. Kim YJ, Kim RJ. The Role of Cardiac MR in New-Onset Heart Failure. Curr Cardiol Rep 2011; 13(3): 185–193.
2. Mahrholdt H, Wagner A, Judd RM et al. Delayed enhancement cardiovascular magnetic resonance assessment of non-ischaemic cardiomyopathies. Eur Heart J 2005; 26(15): 1461–1474.
3. Maestrini V, Treibel TA, White SK et al. T1 Mapping for Characterization of Intracellular and Extracellular Myocardial Diseases in Heart Failure. Curr Cardiovasc Imaging Rep 2014; 7 : 9287. Dostupné z DOI: <http://dx.doi.org/10.1007/s12410–014–9287–8>.
4. Bohnen S, Radunski UK, Lund GK et al. Performance of T1 and T2 Mapping Cardiovascular Magnetic Resonance to Detect Active Myocarditis in Patients With Recent-Onset Heart Failure. Circ Cardiovasc Imaging 2015; 8(6): pii: e003073. Dostupné z DOI: <http://dx.doi.org/10.1161/CIRCIMAGING.114.003073>.
8. Strohm O, Schulz-Menger J, Pilz B et al. Measurement of left ventricular dimensions and function in patients with dilated cardiomyopathy. J Magn Reson Imaging 2001; 13(3): 367–371.
11. Karamitsos TD, Francis JM, Neubauer S. The Current and Emerging Role of Cardiovascular Magnetic Resonance in the Diagnosis of Nonischemic Cardiomyopathies. Prog Cardiovasc Dis 2011; 54(3): 253–265.
20. Puntmann VO, Voigt T, Chen Z et al. Native T1 Mapping in Differentiation of Normal Myocardium from Diffuse Disease in Hypertrophic and Dilated Cardiomyopathy. JACC Cardiovasc Imaging 2013; 6(4): 475–484.
21. Caforio AL, Pankuweit S, Arbustini E et al. Current state of knowledge on aetiology, diagnosis, management, and therapy of myocarditis: a position statement of the European Society of Cardiology Working Group on Myocardial and Pericardial Diseases. Eur Herat J. 2013; 34(33): 2636–2648.
32. Friedrich MG, Sechtem U, Schulz-Menger J et al. Cardiovascular Magnetic Resonance in Myocarditis: A JACC White Paper. JACC 2009; 53(17): 1475–1487.
41. Francone M, Chimenti C, Galea N et al. CMR Sensitivity Varies With Clinical Presentation and Extent of Cell Necrosis in Biopsy-Proven Acute Myocarditis. JACC Cardiovasc Imaging 2014; 7(3): 254–263.
42. Vermes E, Childs H, Faris P et al. Predictive value of CMR criteria for LV functional improvement in patients with acute myocarditis. Eur Heart J Cardiovasc Imaging 2014; 15(10): 1140–1144.
44. Elliot PM, Anastasakis A, Borger MA et al. 2014 ESC Guidelines on diagnosis and management of hypertrophic cardiomyopathy: the Task Force for the Diagnosis and Management of Hypertrophic Cardiomyopathy of the European Society of Cardiology (ESC). Eur Heart J 2014; 35(39): 2733–2779.
47. Shehata ML, Turkbey EB, Vogel-Claussen J et al. Role of Cardiac Magnetic Resonance Imaging in Assessment of Nonischemic Cardiomyopathies. Top Magn Reson Imag 2008; 19(1): 43–57.
54. Germans T, Wilde AA, Dijkmans PA et al. Structural abnormalities of the inferoseptal left ventricular wall detected by cardiac magnetic resonance imaging in carriers of hypertrophic cardiomyopathy mutations. J Am Coll Cardiol 2006; 48(12): 2518–2523.
55. Moon JC, Mogensen J, Elliott PM et al. Myocardial late gadolinium enhancement cardiovascular magnetic resonance in hypertrophic cardiomyopathy caused by mutations in troponin I. Heart 2005; 91(8): 1036–1040.
64. Moon JC, McKenna WJ, McCrohon JA et al. Toward clinical risk assessment in hypertrophic cardiomyopathy with gadolinium cardiovascular magnetic resonance. J Am Coll Cardiol 2003; 41(9): 1561.
72. Green JJ, Berger JS, Kramer CM et al. Prognostic value of late gadolinium enhancement in clinical outcomes for hypertrophic cardiomyopathy. JACC Cardiovasc Imaging 2012; 5(4): 370–377.
79. Hinojar R, Varma N, Child N et al. T1 Mapping in Discrimination of Hypertrophic Phenotypes: Hypertensive Heart Disease and Hypertrophic Cardiomyopathy. Circ Cardiovasc Imaging 2015; 8(12). pii: e003285. Dostupné z DOI: <http://dx.doi.org/10.1161/CIRCIMAGING.115.003285>.
80. McNally E, MacLeold H, Dellefave-Castillo L. Arrhythmogenic Right Ventricular Dysplasia/Cardiomyopathy. In: Pagon RA, Adam MP, Ardinge HH et al. GeneReviews [Internet]. University of Washington: 1993–2016. 2005 [updated 2014]. Dostupné z WWW: https://www.ncbi.nlm.nih.gov/books/NBK1131/
82. Sen-Chowdhry S, Syrris P, Prasat SK et al. Left-Dominant Arrhythmogenic Cardiomyopathy. J Am Coll Cardiol 2008; 52(25): 2175–2187.
83. Marcus FI, McKenna WJ, Sherrill D et al. Diagnosis of Arrhythmogenic Right Ventricular Cardiomyopathy/Dysplasia. Circulation 2010; 121(13): 1533–1541.
89. Sen-Chowdhry S, Morgan RD, Chambers JC et al. Arrhythmogenic cardiomyopathy: etiology, diagnosis, and treatment. Annu Rev Med 2010; 61 : 233–253. Dostupné z DOI: <http://dx.doi.org/10.1146/annurev.med.052208.130419>.
Štítky
Diabetológia Endokrinológia Interné lekárstvo
Článok vyšiel v časopiseVnitřní lékařství
Najčítanejšie tento týždeň
2016 Číslo 10- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
- Intermitentní hladovění v prevenci a léčbě chorob
- Rizikové období v léčbě růstovým hormonem: přechod mladých pacientů k lékařům pro dospělé
- Statinová intolerance
- Monoklonální protilátky v léčbě hyperlipidemií
-
Všetky články tohto čísla
- Prevence osteoporózy – popelka (nejen) české medicíny – editorial
- Magnetická rezonance u kardiomyopatií – editorial
- Hemosuccus pancreaticus – editorial
- Péče o nemocné se symptomatickou a asymptomatickou primární hyperparatyreózou v ambulantní praxi dnes
- Raloxifen – nevyužitá možnost prevence a léčby postmenopauzální osteoporózy
- Prístup k liečbe dyslipidémií – je tu ešte miesto pre CETP-inhibítory?
- Přínos magnetické rezonance pro diagnostiku kardiomyopatií a myokarditidy (1. část)
- Nová – přímá perorální antikoagulancia: aktuální přehled
-
Použití rivaroxabanu v prevenci cévní mozkové příhody u nevalvulární fibrilace síní v praxi
Výsledky observačních studií a naše zkušenosti - Hodnocení pětileté léčby Erdheimovy-Chesterovy nemoci anakinrou – kazuistika a přehled literatury
- Hemosuccus pancreaticus – raritná komplikácia chronickej pankreatitídy
- Arterin® – doplněk stravy v léčbě dyslipidemie: výsledky krátkodobého klinického sledování
- Európsky kardiologický kongres – 1. časť
- XXIII. kongres České internistické společnosti České lékařské společnosti J. E. Purkyně
- 52. kongres Európskej asociácie pre štúdium diabetu
-
Josef Zadražil, Pavel Horák, David Karásek.
Moderní farmakoterapie autoimunitních chorob
- Vnitřní lékařství
- Archív čísel
- Aktuálne číslo
- Iba online
- Informácie o časopise
Najčítanejšie v tomto čísle- Nová – přímá perorální antikoagulancia: aktuální přehled
- Raloxifen – nevyužitá možnost prevence a léčby postmenopauzální osteoporózy
- Přínos magnetické rezonance pro diagnostiku kardiomyopatií a myokarditidy (1. část)
- Hemosuccus pancreaticus – raritná komplikácia chronickej pankreatitídy
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



