-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Prístup k liečbe dyslipidémií – je tu ešte miesto pre CETP-inhibítory?
Treatment of dyslipidemia – is here still place for CETP-inhibitors?
In the treatment of dyslipidemias about 5–6 years back a new class of drugs emerged, CETP (cholesteryl ester transfer protein)-inhibitors. Their benefit was due to an increase of HDL-cholesterol (HDL-C) serum levels. This treatment mode was supported by epidemiological and clinical studies, as people with high serum HDL-C levels suffered less from cardiovascular (CV) events. Three studies with CETP inhibitors (ILLUMINATE with torcetrapib, dal-OUTCOMES with dalcetrapib and ACCELERATE with evacetrapib) were unfortunately negative, and torcetrapib was even harmful to patients due to an increase of aldosterone serum levels. Treatment with dalcetrapib was safe, but without benefit. Similar it was with evacetrapib. There is still running also a study with anacetrapib (REVEAL), but a benefit is here not expected. Evacetrapib and anacetrapib in comparison to dalcetrapib can reduce serum LDL-cholesterol (LDL-C) much more, and similar results were found also in another CETP-inhibitor TA-8995 (TULIP study). Authors try to explain why there is no benefit with CETP-inhibitors (dysfunctional HDL particle, another effective mechanism than reverse cholesterol transport). A genetic analysis in dalcetrapib studies (dal-OUTCOMES and dal-PLAQUE-2) showed, that a cardiovascular benefit from this treatment is concentrated only to a subgroup of patients with a genotype AA in the gene ADCY9 on 16th chromosome. In the population there are about 20% of people with this AA genotype. A clinical study DAL-301 will test this data in a near future. Framingham Offspring study showed that the association of“ HDL-C serum level – CV risk in the future” is greatly influenced by serum levels of LDL-C and triglycerides (if these are increased, than the CV future prediction with HDL-C levels is lost). HDL particles are complex and we do not know which subtype of HDL particles is for cardiovascular prognosis important. The research here continues.
Key words:
acute coronary syndrome – CETP-inhibitors – dalcetrapib – dysfunctional HDL particles – dyslipidemia – HDL-cholesterol – pharmacogenomics of ADCY9 gene
Autoři: Ján Murín; Miroslav Pernický; Soňa Kiňová
Působiště autorů: I. interná klinika LF UK a UN Bratislava, Slovenská republika
Vyšlo v časopise: Vnitř Lék 2016; 62(10): 789-794
Kategorie: Přehledné referáty
Souhrn
V oblasti liečebného prístupu k dyslipidémiám sa asi pred 5–6 rokmi objavili inhibítory CETP (cholesteryl ester transfer protein). Ich benefit spočíval v zvyšovaní sérových hladín HDL-cholesterolu (HDL-C). Tento prístup podporovali epidemiologické a klinické sledovania, nakoľko osoby s vyššími sérovými hladinami HDL-C mávali nižší výskyt kardiovaskulárnych (KV) príhod. Tri štúdie s inhibítormi CETP (ILLUMINATE s torcetrapibom, dal-OUTCOMES s dalcetrapibom a ACCELERATE s evacetrapibom) však neboli úspešné, a v prvom prípade s torcetrapibom boli pacienti dokonca poškodení zvýšenou hladinou sérového aldosterónu u aktívne liečených. Dalcetrapib bol bezpečným liekom, ale benefit nepreukázal. Podobné je to s evacetrapibom. Ešte prebieha štúdia s anacetrapibom (REVEAL), ale efekt sa tu neočakáva. Evacetrapib a anacetrapib oproti dalcetrapibu výraznejšie redukujú sérový LDL-cholesterol (LDL-C), a podobné sú výsledky s redukciou LDL-C pomocou ďalšieho CETP-inhibítoru TA-8995 (štúdia TULIP). Autori rozoberajú možné vysvetlenia neúčinnosti CETP-inhibítorov (dysfunkčný HDL-C, iný mechanizmus účinku ako reverzný cholesterolový transport). Genetická analýza v štúdiách s dalcetrapibom (dal-OUTCOMES a dal-PLAQUE-2) preukázala, že z liečby profitujú len chorí s genotypom (homozygoti) AA v géne ADCY9 na 16. chromozóme, a takých je asi len 20 % chorých. Klinická štúdia DAL-301 túto skutočnosť bude potvrdzovať. Framinghamská štúdia v Offspring kohorte sledovaných preukazuje, že asociáciu „hladina HDL-C – budúce KV riziko“ významne ovplyvňujú sérové hladiny LDL-C a triacylglycerolov (ak sú zvýšené, predikcia pomocou HDL-C zaniká). HDL častice sú zložité a nevieme, ktorý jej podtyp je pre KV prognózu dôležitý. V tejto oblasti výskum pokračuje.
Kľúčové slová:
akútny koronárny syndróm – CETP-inhibítory – dalcetrapib – dysfunkcia HDL častice – dyslipidémia – farmakogenomika u ADCY9 génu – HDL-cholesterolÚvod
V oblasti liečby dyslipidémií máme historicky viaceré liečebné prístupy. Keďže zvýšený sérový LDL-cholesterol (LDL-C) je hlavným činiteľom pri vzniku a progresii aterosklerózy, tak najväčší záujem je riešiť, t.j. redukovať, sérovú hladinu LDL-C. Najlepšie sú tu etablované statíny, niekedy, t.j. u ťažšie chorých, podávané v kombinácii s ezetimibom. U diabetikov a u osôb s metabolickým syndrómom siahame aj ku kombinovanej liečbe s pomocou statínu a fibrátu. Ide tu o liečbu aterogénnej či diabetickej dyslipidémie, pri ktorej sa rieši (okrem redukcie aterogénnych malých denzných LDL častíc) hlavne problém zvýšených sérových triacylglycerolov, ktoré sú obvykle sprevádzané nízkou sérovou hladinou HDL-cholesterolu (HDL-C) [1]. U osôb len s hypertriacylglycerolémiou podávame postihnutému obvykle fibrát a informujeme chorého o potrebe prísnej diéty. Tieto liečebné prístupy majú svoje jasné „pravidlá hry“ v podobe odporúčaní [2].
Zvýšenie sérového HDL-cholesterolu – stále možná nová cesta v liečbe kardiovaskulárnych ochorení u niektorých chorých?
Asi pred 5–6 rokmi vznikol vedecký i klinický záujem o riešenie nízkej sérovej hladiny HDL-C u postihnutých. Do popredia vtedy prišli tzv. inhibítory CETP (cholesteryl ester transfer protein) -inhibítory. Hypotézou doby bolo, že osoby s nízkou sérovou hladinou HDL-C mávajú obvykle vysoké kardiovaskulárne (KV) riziko, a ak zvýšime u týchto chorých ich sérovú hladinu HDL - cholesterolu, tak by sme mali u nich priaznivo ovplyvniť (t.j. redukovať) spomínané KV riziko. Cholesterol-ester-transfer-protein (CETP) zabezpečuje transfer esterov cholesterolu z HDL častice na lipidické častice obsahujúce apolipoprotein B (teda aj na LDL častice) [3], čo sú ale proaterogénne častice. A tomuto procesu bránia inhibítory CETP.
Torcetrapib
Torcetrapib (prvý CETP-inhibítor) bol prešetrovaný vo veľkej klinickej štúdii ILLUMINATE, ale ukázalo sa, že viedol k nárastu morbidity a mortality, hoci zvýšil sérovú hladinu HDL-C, a to až o 70 %. Následné analýzy po skončení klinickej štúdie preukázali negatívny vplyv torcetrapibu na sérové hladiny aldosterónu. Nastalo ich zvýšenie a súbežne bol pochopiteľne prítomný i vzostup hodnôt krvného tlaku u liečených torcetrapibom [4]. Teda samotný vplyv molekuly tohto inhibítora CETP bol nepriaznivý a liečených pacientov poškodil.
Dalcetrapib
Následne sa objavil ďalší CETP-inhibítor, dalcetrapib, ktorý zvyšoval sérovú hladinu HDL-C asi o 30 % a bol bez ovplyvnenia sérových hladín neurohormónov, teda aj aldosterónu [5]. Cieľom štúdie s dalcetrapibom (štúdia dal-OUTCOMES) bolo preukázať, či u chorých s nedávnym akútnym koronárnym syndrómom (AKS) tento liek bude modifikovať (t.j. redukovať) následné KV riziko chorých [6]. V tejto štúdii (15 871 chorých s AKS) však dalcetrapib neovplyvnil v priebehu asi 2 rokov KV riziko liečených, a preto štúdiu sponzor ukončil. Tiež v žiadnej podskupine chorých, t.j. podľa klinických parametrov, biochemických parametrov či iných charakteristík, sa benefit liečby nepreukázal [6]. Liečba bola síce bezpečná, ale aj kardiovaskulárne neúčinná.
Evacetrapib
Evacetrapib (ďalší inhibítor CETP) sa testoval v klinickej štúdii ACCELERATE (Assessment of Clinical Effects of Cholesteryl Ester Transfer Protein Inhibition with Evacetrapib in Patients at a High-Risk for Vascular Outcomes) - randomizovanej a dvojito zaslepenej klinickej štúdii III. fázy. Bolo do nej zaradených 12 095 pacientov s anamnézou AKS, cerebrovaskulárneho či periférne vaskulárneho ochorenia, s diabetom 2. typu, s anamnézou dyslipidémie rezistentnej k liečbe statínom alebo s ďalšími vysokorizikovými KV prejavmi. Sledoval sa výskyt kompozitného endpointu (doby do prvého výskytu) „KV mortality/infarktu myokardu/cievnej mozgovej príhody/revaskularizácie/hospitalizácie pre nestabilnú anginu pectoris“. Na odporúčanie telesa DSMB (Data Safety Monitoring Board) bola štúdia predčasne ukončená v októbri roku 2015 pre nedostatočnú účinnosť liečby (endpointy: evacetrapib – 12,8% výskyt vs placebo – 12,7% výskyt s HR 1,01 a s p = 0,85), pričom bezpečnosť liečby zachovaná bola [7,8].
Anacetrapib
Anacetrapib (CETP-inhibítor) sa pridával v štúdii REALIZE (Randomized Evaluation of the Effects of Anacetrapib through Lipid-modification) u osôb s heterozygotnou familiárnou hypercholesterolémiou k liečbe vysokoúčinnými statínmi a ezetimibom. Významne redukoval sérový LDL-C a zvyšoval sérový HDL-C. Liečba bola dobre tolerovaná, nedošlo k ovplyvneniu krvného tlaku. Táto štúdia nemala počtom len 204 chorých silu preukázať vplyv na výskyt KV príhod (ale u 4 pacientov boli prítomné KV príhody ako cievna mozgová, infarkt myokardu či nestabilná angina pectoris v ramene aktívnej liečby versus žiadna príhoda v placebovom ramene) [9]. Klinická štúdia REVEAL ešte nebola ukončená. Má ambíciu preukázať, či modifikácia lipidov liečbou anacetrapibom bude redukovať výskyt „koronárnej mortality/infarktu myokardu/koronárnej revaskularizácie“ u pacientov vo veku nad 50 rokov a aspoň s jedným nasledujúcim ochorením – prekonaný infarkt myokardu – cievnej mozgovej príhody – karotickej revaskularizácie, prítomným periférnym artériovým ochorením alebo diabetom 2. typu so symptomatickou ischemickou chorobou srdca [10]. Aj pri tejto štúdii sa predpokladá jej skoršie ukončenie po plánovanej priebežnej analýze výskytu KV príhod.
Zmeny sérových lipidov a následne i kardiovaskulárnych príhod v štúdiách s CETP-inhibítormi uvádza tab. 1.
Tab. 1. Štúdie s CETP-inhibítormi: zmeny sérových lipidov a KV príhod 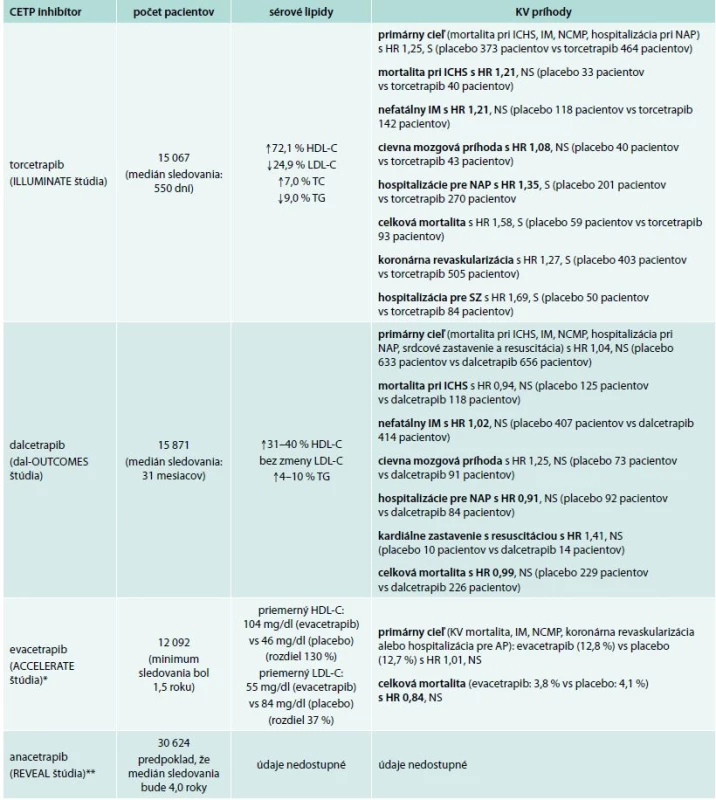
HR – pomer rizík (hazard ratio) ICHS – ischemická choroba srdca IM – infarkt myokardu KV – kardiovaskulárny NAP – nestabilná angina pectoris NCMP – náhla cievna mozgová príhoda NS – štatisticky nevýznamné TC – celkový cholesterol (total cholesterol) TAG – triacylglyceroly S – štatisticky významné SZ – srdcové zlyhávanie *ACCELERATE – zatiaľ nepublikované (News z Amer Coll Cardiol kongresu, 3. April 2016, Chicago) **nepublikovaná štúdia REVEAL – ukončená 13. novembra 2015 (oznámené sponzorom: Merck Sharp & Dohme – MSD) Inhibítory CETP v zrkadle štúdií
Rozdiely v činnosti dalcetrapibu vs evacetrapibu a anacetrapibu sú evidentné: oba posledné „trapiby“ oproti dalcetrapibu významnejšie redukujú sérový LDL-C a významnejšie dvíhajú sérový HDL-C. V štúdii DEFINE sa preukázalo, že anacetrapib redukuje sérový LDL-C o 36 % a zvyšuje sérový HDL-C o 138 % u osôb s ischemickou chorobou srdca liečených statínom. U evacetrapibu je to s redukciou LDL-C o 52 % a s nárastom HDL-C o 129 % [11].
Teda 3 štúdie (ILUMINATE, dal-OUTCOMES, ACCELERATE) nepreukázali benefit zvýšenia sérovej hladiny HDL-C. Jestvuje predpoklad, že podobne dopadne aj štúdia REVEAL. Hoci benefit liečby inhibítormi CETP sa predpokladal podľa mnohých epidemiologických a klinických sledovaní, či podľa genetických i animálnych štúdií venovaných problematike patofyziológie HDL-C u aterosklerózy.
Najnovší CETP-inhibítor TA-8995 bol preverený v štúdii TULIP (TA-8995 in Patients with Mild Dyslipidemia), čo bola štúdia vo fáze II s randomizáciou chorých, dvojito zaslepená a s paralelnými skupinami pacientov (spolu 364 chorých): sérový LDL-C bol redukovaný o 27–45 % podľa dávky liečiva: 1, 2,5, 5 či 10 mg denne vs placebo, trvanie liečby bolo 12 týždňov. Pridanie k statínu viedlo k ešte väčšej redukcii LDL-C (o 63 % po pridaní k 10 mg rosuvastatínu a o 68 % k 20 mg atorvastatínu vs placebová liečba). Zaznamenaný bol vzostup HDL-C o 76–179 % [12]. Nebolo ovplyvnenie krvného tlaku, sérovej hladiny aldosterónu ani kortizolu.
Treba nám preto opustiť hypotézu o benefite zvýšenia sérového HDL-C v prevencii či liečbe kardiovaskulárnych ochorení?
Prečo sa neprejavuje klinický benefit, teda pokles KV príhod, zvyšovania sérového HDL-C pomocou liečby inhibítormi CETP, ale ani pomocou liečby fibrátmi a niacínom? Vyjadrila sa k tomu nedávna metaanalýza Keene et al (2014) [13]. V nej bolo zahrnutých 39 štúdií s 117 411 pacientmi. Priaznivý efekt na redukciu celkovej mortality i KV mortality sa najprv nepreukázal u niacínu a fibrátu, a o niečo neskôr ani u CETP-inhibítorov. Nepreukázala sa ani redukcia rizika pre cievne mozgové príhody. U chorých neliečených statínmi redukujú fibráty aj niacín výskyt infarktu myokardu asi o 20–30 %, čo nie je nezanedbateľné. Avšak väčšina týchto chorých užíva, podľa Odporúčaní, statíny, a vtedy je niacín v redukcii KV príhod neúčinný (štúdie AIM-HIGH a HPS2-THRIVE). Nie je jasné, či kombinácia statin s fibrátom prináša benefit v redukcii KV príhod (jednak je prídavný pokles KV príhod malý a možno je podporovaný prídavnou redukciou sérového LDL-C, a nie vzostupom sérového HDL-C). Aj v štúdiách s inhibítormi CETP sa javí podobná skutočnosť, ak boli pacienti liečení aj statínmi, tak sa benefit v redukcii KV príhod neuplatňuje.
Aké sa núkajú vysvetlenia, že zvýšenie sérového HDL-C benefit neprináša?
Je ich niekoľko, a iste sa nám nepodarí pripomenúť všetky možnosti.
Genetická mutácia P376L
Jestvujú ľudia so vzácnou genetickou mutáciou, ktorí majú zvýšenú hladinu HDL-C (očakávali by sme, že je to kardioprotektívne), ale súčasne majú vzostup rizika pre ischemickú chorobu srdca [14]. Je to genetická varianta „P376L“, ktorá porušuje funkciu tzv. „scavenger“ receptora BI (SR-BI, čo je významným receptorom pre HDL-C), a táto mutácia bola zistená a potvrdená viacerými analýzami (prvou u 328 pacientov, druhou u 1 282 pacientov a ďalšou u asi 300 000 indivíduí v metaanalýze 16 populačno-genetických štúdií). Zanoni et at (2016) preukázali, že u osôb s veľmi vysokou hladinou HDL-C jestvujú osoby homozygotné pre SR-BI (je to tzv. neúčinná forma receptora, t.j. „loss of function variant“), a je to už spomínaná varianta „P375L“, v ktorej je prolín nahradený leucínom [14], a práve v metaanalýze sa preukázalo, že nositelia génovej mutácie „P376L“ majú o 79 % vyššie riziko pre ischemickú chorobu srdca ako osoby bez tejto mutácie. Zdá sa, že problémom nie je zvýšenie hladiny HDL-C, ale strata SR-BI receptorovej funkcie a z hľadiska klinického by preto vysoká sérová hladina HDL-C nemala byť dôvodom pacientovi nedať (pre vysokú sérovú hladinu HDL-C) liečbu statínom, teda dôležitejšie než je sérová hladina HDL-C je funkcia HDL častice, teda prijatie cholesterolu z cievnych a ďalších tkanivových štruktúr a jeho prenos do pečene (reverzný transportný cholesterolový proces).
Dysfunkcia HDL častice
Iným dôvodom neprítomnosti benefitu vysokej sérovej hladiny HDL-C je dysfunkcia HDL častice:
- Môže súvisieť napr. s jej zložením. Mutácie génu pre ApoAI (býva deficit HDL častice) idú s akceleráciou aterogenézy, a naopak „over-expressia“ génu pre ApoAI (myšací model) chráni zviera pred experimentálne indukovanou aterogenézou [15]
- Protekcia pred aterosklerózou môže ísť aj inou cestou u zvýšenej sérovej hladiny HDL-C než je pôsobenie prostredníctvom reverzného cholesterolového transportu, môže ísť o protizápalový (cievny) vplyv, o antikoagulačný vplyv, o antioxidačný vplyv, antiagregačný či profibrinolytický vplyv [16]
Analýza genetického profilu pacientov – štúdie dal-OUTCOMES a dal-PLAQUE-2
Pozoruhodnú analýzu vykonali Tardif et al (2015) v klinickej štúdii dal-OUTCOMES [17]. Predpokladali, že efekt (vlastne benefit) dalcetrapibu u pacientov s AKS je závislý aj od genetického profilu, t.j. stavu, chorých. A tak vykonali farmako-genomickú analýzu (s použitím širokej analýzy genómu chorých, t.j. spravili tzv. „genome-wide approach“) pacientov jednak v štúdii dal-OUTCOMES, ale aj v jednej z podštúdií s dalcetrapibom – v „zobrazovacej štúdii“ dal-PLAQUE-2. V nej hľadali asociáciu medzi genetickými parametrami chorého s AKS a KV príhodami i vaskulárnymi zmenami po liečive dalcetrapibom v porovnaní s liečbou placebom. V štúdii dal-OUTCOMES podávali 600 mg dalcetrapibu vs placebo denne, pričom všetci chorí mali aj štandardnú (guidelinami odporúčanú) liečbu AKS. Do farmako-genomickej podštúdie zaradili 6 338 pacientov (v období od apríla roku 2008 až júl roku 2010, v 461 centrách v 14 krajinách), ale len u 5 749 z nich vykonali analýzu genómu. V štúdii dal-PLAQUE-2 zaradili menej pacientov, len 931 pacientov, u ktorých bolo prítomné koronárne ochorenie a súčasne intimo-mediálne zhrubnutie spoločnej karotickej artérie ≥ 0,65 mm (hodnotené podľa karotickej ultrasonografie) a z nich 411 pacientov súhlasilo aj so zaradením do genetickej podštúdie a 386 pacientov malo 3 následné ultrasonografické vyšetrenia karotickej artérie (vstupne, po 6 a po 12 mesiacoch).
Genetická analýza bola náročná a jej metodológia je podrobne popísaná v práci Tardif et al [17]. Proporcia pacientov randomizovaných k liečbe dalcetrapibom bola vo farmako-genomickej podštúdii podobná ako v hlavnej štúdii dal-OUTCOMES. Aj výskyt KV príhod (13,9 % v podštúdii a 13,68 % v hlavnej štúdii) a výskyt mortality (2,32 % v podštúdii a 2,95 % v hlavnej štúdii) boli proporčne podobné. Charakteristiky chorých vo farmako-genomickej štúdii sú uvedené v tab. 2.1 a 2.2.
Tab. 2.1. Charakteristiky pacientov vo farmako-genomickej podštúdii dal-OUTCOMES s výskytom KV ochorení a súbežnou medikáciou 
BMI – body mass index CABG – aortokoronárny bypass DM2T – diabetes mellitus 2. typu HT – hypertenzia ICHS – ischemická choroba srdca IM – infarkt myokardu NCMP – náhla cievna mozgová príhoda NYHA – klasifikácia intenzity SZ PAO – periférne arteriálne ochorenie PKI – perkutánna koronárna intervencia SZ – srdcové zlyhávanie TC – celkový cholesterol v sére, n - počet Tab. 2.2. Charakteristiky pacientov vo farmako-genomickej podštúdii dal-OUTCOMES s výskytom KV ochorení a súbežnou medikáciou 
ACE – angiotenzín konvertujúci enzým ARB – sartan eGF – odhadovaná glomerulárna filtrácia KV – kardiovaskulárne NAP – nestabilná angina pectoris NCMP – náhla cievna mozgová príhoda V genetickej analýze objavili gén ADCY9 na 16. chromozóme ako dôležitý a asociovaný s KV príhodami pacientov. Našli tu 3 možnosti genotypov: AA homozygoti mali pri liečbe dalcetrapibom (vs placebom) o 39 % nižší a významný pokles výskytu KV príhod; chorí s GG genotypom (homozygoti) mali v dalcetrapibovom ramene liečby o 27 % nárast výskytu KV príhod oproti placebovému ramenu liečby (teda priaznivý efekt liečby dalcetrapibom tu prítomný nebol) a chorí s genotypom AG mali intermediárny efekt liečby so 6 % nevýznamným poklesom výskytu KV príhod v ramene liečby dalcetrapibom. A podobne sa správali i zmeny sérových lipidov a redukcia intimo-mediálneho zhrubnutia na karotide (benefit len u genotypu AA, zistiteľný už po 6mesačnej liečbe dalcetrapibom). Štúdia súčasne preukázala, že len asi 20 % zaradených chorých (teda len ich pätina) mala AA genotyp, no a práve tieto osoby a len tieto osoby významne profitovali z liečby dalcetrapibom.
Aký je odkaz genetickej analýzy štúdií dal-OUTCOMES a dal-PLAQUE-2 v tomto prípade pre klinickú prax?
Je možné predpokladať, že u chorých s ischemickou chorobou srdca a s AKS bude z liečby dalcetrapibom 600 mg denne profitovať len chorý s genotypom AA v géne ADCY9. Takých je asi 20 % pacientov v našej populácii, teda asi 1 z 5. Ale či vskutku títo pacienti budú z liečby dalcetrapibom profitovať, bude teraz analyzovať klinická štúdia DAL-301 (oproti placebu), ale len u chorých s AKS a s genotypom AA. Takže cesta ku KV benefitu prostredníctvom inhibície CETP (a následného zvýšenia HDL-C v sére) je stále otvorená. Ukazuje sa tu tiež, že vstup genetických analýz priamo do klinickej praxe je výhodný a potrebný.
Záver
Dlhodobé nálezy z klinickej štúdie Framingham Heart Study (3 590 účastníkov v tzv. Offspring kohorte, iniciálne bez KV ochorenia, obdobie sledovania roky 1987–2011) preukázali, že nízky HDL-C v sére nevie predikovať KV riziko osoby nezávisle od ostatných lipidových sérových hladín [18]. Ukázali, že asociáciu „hladina HDL-C – budúce KV riziko“ významne ovplyvňujú sérový LDL-C a sérové triacylglyceroly. Predikcia pomocou HDL-C v sére zaniká, ak sú hladiny LDL-C a triacylglycerolov v sére vysoké.
Uvažuje sa, že HDL častica pozostáva z viacerých podtypov a možno nemeriame ten podtyp, ktorý asociuje s KV rizikom chorého. Skúma sa, elevácia ktorého podtypu prináša klinický benefit. Ale táto otázka zatiaľ (ani vo výskume) nie je vyriešená. Banach et al (roku 2014) riešia túto úlohu v štúdii DYS-HDL (Dysfunctional HDL) s pacientmi s rôznym KV rizikom a výsledky sa dajú očakávať asi v roku 2017 [19].
CETP-inhibítory teda zatiaľ nepreukázali KV benefit, viazaný k elevácii sérového HDL-C. Klinická štúdia DAL-301 s dalcetrapibom (začínajúca v tomto roku) prešetrí u chorých s AKS a s genotypom AA v géne ADCY9 benefit tejto liečby.
Práca bola podporená grantmi VEGA 1/0939/14 a VEGA 1/0886/14.
prof. MUDr. Ján Murín, CSc.
jan.murin@gmail.com
I. interná klinika LF UK a UN Bratislava, Slovenská republika
www.unb.sk
Doručeno do redakce 9. 4. 2016
Přijato po recenzi 18. 7. 2016
Zdroje
1. Murín J, Kiňová S. Komentár k Odporúčaniam Európskej kardiologickej spoločnosti a Európskej diabetologickej spoločnosti o prístupe k diabetikovi s kardiovaskulárnym ochorením. Cardiol Lett 2014; 23(4): 253–258.
2. Aguiar C, Alegria E, Bonadonna RC et al. A review of the evidence on reducing macrovascular risk in patients with atherogenic dyslipidaemia: A report from an expert consensus meeting on the role of fenofibrate – statin combination therapy. Atherosclerosis Supplements 2015; 19 : 1–12. Dostupné z DOI: <http://dx.doi.org/10.1016/S1567–5688(15)30001–5>.
3. Arsenault BJ, Boekholdt SM, Tardif JC et al. De-risking the clinical development of cholesteryl ester transfer protein inhibitors: how much is good enough ? Eur Heart J 2012; 33(13): 1548–1550. Dostupné z DOI: <http://dx.doi.org/10.1093/eurheartj/ehr408>.
4. Barter PJ, Caulfield M, Eriksson M et al. ILLUMINATE Investigators. Effects of torcetrapib in patients at high risk for coronary events. N Engl J Med 2007; 357(21): 2109–2122.
5. Rhainds D, Arsenault BJ, Brodeur MR et al. An update on the clinical development of dalcetrapib (RO4607381), a cholesteryl ester transfer protein modulator that increases HDL cholesterol levels. Future Cardiol 2012; 8(4): 513–531. Dostupné z DOI: <http://dx.doi.org/10.2217/fca.12.25>.
6. Schwartz GG, Olsson AG, Abt M et al. dal-OUTCOMES Investigators. Effects of dalcetrapib in patients with a recent acute coronary syndrome. N Engl J Med 2012; 367(22): 2089–2099. Dostupné z DOI: <http://dx.doi.org/10.1056/NEJMoa1206797>.
7. Stiles S. Lilly Pulls Plug on its CETP Inhibitor Evacetrapib. Medscape 2015 October 12. Dostupné z WWW: Dostupné z WWW: http://www.medscape.com/viewarticle/852516.
8. Nicholls SJ, Lincoff A, Barter P et al. [Late-Breaking Clinical Trials II]. The ACCELERATE trial: impact of the CETP inhibitor evacetrapib on cardiovascular outcome. Presented at the 65th Annual Scientific Session and Expo of the ACC. April 2–4, 2016. Chicago.
9. Kastelein JJ, Besseling J, Shah S et al. Anacetrapib as lipid-modifying therapy in patients with heterozygous familial hypercholesterolemia (REALIZE): A randomized, double-blind, placebo-controlled phase 3 study. Lancet 2015; 385(9983): 2153–2161. Dostupné z DOI: <http://dx.doi.org/10.1016/S0140–6736(14)62115–2>. Abstract.
10. ClinicalTrials. gov Identifier: NCT01252953. REVEAL: Randomized EValuation of the Effects of Anacetrapib Through Lipid-modification (REVEAL). Dostupné z WWW: https://clinicaltrials.gov/ct2/show/NCT01252953
11. dal-OUTCOMES: Wrestling with why the CETP Inhibitor Failed to Reduce Outcomes. Medscape 2012 November 05. Dostupné z WWW: http://www.medscape.com/viewarticle/773974.
12. Hovingh GK, Kastelein JJP, van Deventer SJH et al. Cholesterol ester transfer protein inhibition by TA-8995 in patients with mild dyslipidemia (TULIP): A randomized, double-blind, placebo-controlled phase 2 trial. Lancet 2015; 386(9992): 452–460. Dostupné z DOI: <http://dx.doi.org/10.1016/S0140–6736(15)60158–1>.
13. Keene D, Price C, Shun-Shin MJ et al. Effect on cardiovascular risk of high-density lipoprotein targeted treatments niacin, fibrates, and CETP inhibitors: meta-analysis of randomized, controlled trials including 117 411 patients. BMJ 2014; 349: g4379. Dostupné z DOI: <http://dx.doi.org/10.1136/bmj.g4379>.
14. Zanoni P, Khetarpal SA, Larach DB et al. Rare variabl in scavenger receptor VI raises HDL cholesterol and increases risk of coronary heart disease. Science 2016; 351(6278): 1166–1171. Dostupné z DOI: <http://dx.doi.org/10.1126/science.aad3517>.
15. Brunton L, Chabner B, Knollman BC (eds). Goodman and Gilman´s the Pharmacological Basis of Therapeutics. 12th ed. McGraw-Hill: New York 2011. ISBN 978–0071624428.
16. deGoma EM, deGoma RL, Rader DJ. Beyond high-density lipoprotein cholesterol levels evaluating high-density lipoprotein function as influenced by novel therapeutic approaches. J Am Coll Cardiol 2008; 51(23): 2199–2211. Dostupné z DOI: <http://dx.doi.org/10.1016/j.jacc.2008.03.016>.
17. Tardif JC, Rhéaume E, Perreault LP et al. Pharmacogenomic determinants of the cardiovascular effects of dalcetrapib. Circ Cardiovasc Genet 2015; 8(2): 372–382. Dostupné z DOI: <http://dx.doi.org/10.1161/CIRCGENETICS.114.000663>.
18. Bartlett J, Predazzi IM, Williams SM et al. Is isolated low high-density lipoprotein cholesterol a cardiovascular disease risk factor? New insights from the Framingham Offspring Study. Circ Cardiovasc Qual Outcomes 2016; 9(3): 206–212. Dostupné z DOI: <http://dx.doi.org/10.1161/CIRCOUTCOMES.115.002436>.
19. Banach M, Rysz J, Rizzo M et al. Investigating dysfunctional HDL in selected groups of patients at high risk of cardiovascular events (DYS-HDL study): Protocol and organization. Atherosclerosis 2014; 235: e171-e172.
Štítky
Diabetológia Endokrinológia Interné lekárstvo
Článok vyšiel v časopiseVnitřní lékařství
Najčítanejšie tento týždeň
2016 Číslo 10- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
- Intermitentní hladovění v prevenci a léčbě chorob
- Rizikové období v léčbě růstovým hormonem: přechod mladých pacientů k lékařům pro dospělé
- Statinová intolerance
- Monoklonální protilátky v léčbě hyperlipidemií
-
Všetky články tohto čísla
- Prevence osteoporózy – popelka (nejen) české medicíny – editorial
- Magnetická rezonance u kardiomyopatií – editorial
- Hemosuccus pancreaticus – editorial
- Péče o nemocné se symptomatickou a asymptomatickou primární hyperparatyreózou v ambulantní praxi dnes
- Raloxifen – nevyužitá možnost prevence a léčby postmenopauzální osteoporózy
- Prístup k liečbe dyslipidémií – je tu ešte miesto pre CETP-inhibítory?
- Přínos magnetické rezonance pro diagnostiku kardiomyopatií a myokarditidy (1. část)
- Nová – přímá perorální antikoagulancia: aktuální přehled
-
Použití rivaroxabanu v prevenci cévní mozkové příhody u nevalvulární fibrilace síní v praxi
Výsledky observačních studií a naše zkušenosti - Hodnocení pětileté léčby Erdheimovy-Chesterovy nemoci anakinrou – kazuistika a přehled literatury
- Hemosuccus pancreaticus – raritná komplikácia chronickej pankreatitídy
- Arterin® – doplněk stravy v léčbě dyslipidemie: výsledky krátkodobého klinického sledování
- Európsky kardiologický kongres – 1. časť
- XXIII. kongres České internistické společnosti České lékařské společnosti J. E. Purkyně
- 52. kongres Európskej asociácie pre štúdium diabetu
-
Josef Zadražil, Pavel Horák, David Karásek.
Moderní farmakoterapie autoimunitních chorob
- Vnitřní lékařství
- Archív čísel
- Aktuálne číslo
- Iba online
- Informácie o časopise
Najčítanejšie v tomto čísle- Nová – přímá perorální antikoagulancia: aktuální přehled
- Raloxifen – nevyužitá možnost prevence a léčby postmenopauzální osteoporózy
- Přínos magnetické rezonance pro diagnostiku kardiomyopatií a myokarditidy (1. část)
- Hemosuccus pancreaticus – raritná komplikácia chronickej pankreatitídy
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



