-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Léčba 14 případů Castlemanovy nemoci: zkušenosti jednoho centra a přehled literatury
Treatment of 14 cases of Castleman’s disease: the experience of one centre and an overview of literature
Castleman’s disease is the term for reactive lymphocytary and plasmocytary proliferation which occurs in the unicentric (localized) form, usually without systemic symptoms, or in the generalized/multicentric form, typically with systemic symptoms (www.vzacne-diagnozy.cz). Over the past 25 years we diagnosed, treated and followed 14 histologically proven cases of Castleman’s diseases. Seven patients had the localised form of the disease. In 5 of 7 cases the pathological lesion was located intrathoracically or intraabdominally and in only 2 cases it was on the surface of the body. No clinical symptoms were present in any of the patients with the unicentric form of the disease and surgical treatment led to the total removing of the disease in all of them. As opposed to that, all 7 patients with the multicentric form of Castleman’s disease experienced febrile or subfebrile temperatures. Three of the 7 patients complained of severe troubling night sweats. Clinical expressions of vasculitis which was the cause of stroke, were present in 1 of 7 patients. Osteosclerotic changes on the skeleton were detected in 1 patient, who also suffered from fluid retention likely associated with this disease. Polyclonal propagation of immunoglobulins, predominantly immunoglobulin IgG type, was present in 5 of 7 patients with the multicentric form. In one case there was one complete molecule of monoclonal imunoglobuline present and in one case loose light chains κ were increased More than 1 sampling of material for histological examination of enlarged lymph nodes were needed in 6 of 7 patients for diagnosing the multicentric form of the disease. It has turned out beneficial with respect to diagnosing the disease to carry out surgical removal and histological examination of the nodes which accumulated the most fluorodeoxyglucose within PET-CT examination. The text describes experience of the treatment. In recent years the basis for the treatment has been the monoclonal antibody antiCD20 rituximab, or thalidomide and lenalidomide, or possibly their combination. The new medicine for these patients is interleukin-6 antibody called siltuximab (Sylvant), of which we have no own experience so far. Five of our seven patients with the multicentric form received treatment, 1 patient refused treatment and in one patient the signs of the disease activity are not expressed to such extent that would require treatment. The therapy containing rituximab reached complete remission in 2 patients and the therapy containing thalidomide and lenalidomide achieved the complete remission of the disease in 3 patients. In one of the above described cases the disease did not respond to the initial treatment with rituximab and remission was reached by thalidomide and lenalidomide and in one case the disease did not respond to the initial treatment with thalidomide and complete remission was reached with rituximab. Following the treatment, no patient with the multicentric form of Castleman’s disease has had a relapse until now.
Key words:
anemia of chronic diseases – Castleman’s disease – hyperproteinemia – lenalidomide – polyclonal hypergammaglobulinemia – rituximab – siltuximab – thalidomide
Autoři: Zdeněk Adam 1; Petr Szturz 1; Marta Krejčí 1; Renata Koukalová 2; Eva Michalková 1; Zdeněk Řehák 2; Eva Pourová 3; Luděk Pour 1; Pavlína Volfová 1; Viera Sandecká 1; Zdeňka Čermáková 4,9; Leoš Křen 5; Filip Sokol 5; Ivo Hanke 6; Igor Penka 6; Hana Petrášová 7; Sabina Ševčíková 8; Zdeněk Král 1; Jiří Mayer 1
Působiště autorů: Interní hematologická a onkologická klinika LF MU a FN Brno, pracoviště Bohunice 1; Oddělení nukleární medicíny, centrum PET, RECAMO, Masarykův onkologický ústav, Brno 2; Ordinace praktického lékaře pro dospělé, Pustiměř 3; Oddělení klinické biochemie FN Brno, pracoviště Bohunice 4; Ústav patologie LF MU a FN Brno, pracoviště Bohunice 5; Chirurgická klinika LF MU a FN Brno, pracoviště Bohunice 6; Radiologická klinika LF MU a FN Brno, pracoviště Bohunice 7; Ústav patologické fyziologie LF MU Brno 8; Katedra laboratorních metod LF MU, Brno 9
Vyšlo v časopise: Vnitř Lék 2016; 62(4): 287-298
Kategorie: Přehledné referáty
Souhrn
Castlemanova choroba je termín pro reaktivní lymfocytární a plazmocytární proliferaci, která se vyskytuje buď ve formě lokalizované, unicentrické, obvykle bez systémových příznaků, nebo ve formě generalizované, multicentrické, obvykle se systémovými příznaky (www.vzacne-diagnozy.cz). V posledních 25 letech jsme diagnostikovali, léčili a sledovali celkem 14 histologicky jednoznačně prokázaných případů Castlemanovy nemoci: 7 pacientů mělo lokalizovanou formu nemoci; v 5 ze 7 těchto případů bylo patologické ložisko uloženo intratorakálně či intraabdominálně a pouze u 2 bylo na povrchu těla. U žádného nemocného s unicentrickou formou nemoci nebyly přítomny klinické příznaky a u všech těchto osob vedla operační léčba k totálnímu odstranění nemoci. Naproti tomu u všech 7 pacientů s multicentrickou formou Castlemanovy nemoci se vyskytovaly febrilie nebo subfebrilie, přitom 3 z těchto 7 pacientů si stěžovali na výrazné a obtěžující noční pocení. Klinické projevy vaskulitidy, která byla příčinou cévní mozkové příhody, byly přítomny u 1 ze 7 pacientů. Osteosklerotické změny na skeletu jsme detekovali u 1 nemocného, u něhož byla i retence tekutin, pravděpodobně související s touto nemocí. Polyklonální zmnožení imunoglobulinů, dominantně imunoglobulinu typu IgG, bylo přítomno u 5 ze 7 pacientů s multicentrickou formou. V 1 případě byla navíc přítomna kompletní molekula monoklonálního imunoglobulinu a v jednom případě byly zvýšeny volné lehké řetězce κ. Pro diagnostiku multicentrické formy nemoci bylo třeba u 6 ze 7 pacientů více než 1 odběru materiálu pro histologické vyšetření zvětšených lymfatických uzlin. Pro diagnostiku této nemoci se ukázalo jako přínosné provést operační odstranění a histologické vyšetření těch uzlin, které nejvíce akumulovaly fluorodeoxyglukózu při PET-CT vyšetření. V textu jsou popisovány zkušenosti s léčbou. Základem léčby byla v posledních letech monoklonální protilátka antiCD20 rituximab, anebo talidomid či lenalidomid, případně jejich kombinace. Nejnovějším lékem pro tyto nemocné je protilátka proti interleukinu 6 zvaná siltuximab (Sylvant), s ní však zatím vlastní zkušenosti nemáme. Z našich 7 pacientů s multicentrickou formou bylo léčeno 5, 1 pacient léčbu odmítal a u jednoho nejsou známky aktivity nemoci natolik vyjádřené, že by vyžadovaly léčbu. Léčba obsahující rituximab docílila kompletní remise u 2 pacientů a léčba obsahující talidomid a lenalidomid dovedla 3 pacienty do kompletní remise nemoci. V jednom z těchto případů nemoc nereagovala na iniciální léčbu rituximabem a remisi navodil talidomid a lenalidomid a v jednom z těchto případů nemoc nereagovala na iniciální léčbu talidomidem a kompletní remise bylo dosaženo rituximabem. Zatím nedošlo k recidivě ani u jednoho pacienta s multicentrickou formou Castlemanovy nemoci po ukončené léčbě.
Klíčová slova:
anémie chronických chorob – Castlemanova choroba – hyperproteinemie – lenalidomid – polyklonální hypergamaglobulinemie – rituximab – siltuximab – talidomidÚvod
Castlemanova choroba je nemaligní proces (neklonální proliferace lymfocytů a plazmocytů), která svým průběhem a přítomnou lymfadenopatií může připomínat maligní lymfom a vysokou koncentrací celkové bílkoviny a imunoglobulinů někdy též mnohočetný myelom, zvláště pokud se prokáže i přítomnost monoklonálního imunoglobulinu. Castlemanova choroba se může projevit jen jedním ložiskem. Pro tyto případy se používá termínu lokalizovaná (unicentrická) forma. Unicentrická forma je obvykle asymptomatická, nebo symptomy jsou jen mírné a dominantně je za ně odpovědný tlak zvětšených uzlin na okolní orgány a tkáně. Chirurgická léčba zpravidla vše vyřeší. Morfologicky odpovídá většina těchto unicentrických forem hyalinně-vaskulárnímu typu.
Polyklonální proliferace lymfocytů a plazmocytů však může postihnout generalizovaně uzliny, slezinu i játra. Tato forma nemoci se nazývá multicentrická a je obvykle spojena s různě intenzivními příznaky. Typické jsou neinfekční subfebrilie či febrilie, úbytek hmotnosti, noční pocení. Jsou tu však i četné další, nepravidelně se vyskytující příznaky, vaskulitida, změny na skeletu, poškození funkce ledvin [1]. Typickými laboratorními nálezy jsou: anémie, trombocytóza (nebo trombocytopenie), leukocytóza s neutrofilií, hypoalbuminemie, polyklonální hypergamaglobulinemie a zvýšené markery zánětu.
Diferenciálně diagnosticky je nutné odlišit maligní lymfomy, sarkoidózu, chronické infekty, a IgG4 asociované autoimunitní nemoci. Na multicentrickou Castlemanovu chorobu je nutné myslet v rámci diagnózy anémie chronických chorob [2].
Histologická diagnostika multicentrické formy Castlemanovy nemoci je dosti obtížná, protože tato nemoc nemá typické buněčné znaky a nejedná se o klonální proliferaci, ale o proliferaci polyklonální, neboli reaktivní. A tak je často třeba opakovaných histologických vyšetření, než se podaří tuto nemoc prokázat a odlišit od nespecifických reaktivních změn v lymfatické uzlině, a tím pádem i nasměrovat nemocné k odpovídající léčbě. Multicentrická forma Castlemanovy nemoci je dnes dobře léčitelná, a proto v případech, kdy lékař pojme na tuto nemoc podezření, je třeba nenechat se odradit nespecifickým závěrem prvního histologického hodnocení odebrané periferní lymfatické uzliny a snažit se při dalším vyšetřování odebrat uzlinu s největší akumulací fluorodeoxyglukózy, a tedy s nejvyšší pravděpodobností správného stanovení diagnózy [1]. Onemocnění sice nemá maligní charakter, ale má v sobě zvýšené riziko maligní transformace, což opodstatňuje následující dispenzarizaci i po ukončené léčbě.
V následujícím textu shrnujeme naše zkušenosti s projevy této nemoci, diagnostikou a léčbou této nemoci a v diskusi uvedeme přehled informací o této nemoci. Četné informace nejen o této vzácné nemoci lze nalézt na www.vzacne-diagnozy.cz.
Soubor pacientů
Na našem pracovišti bylo v posledních letech podrobně vyšetřeno a dlouhodobě sledováno celkem 14 pacientů s Castlemanovou chorobou. U 7 pacientů byla potvrzena diagnóza unicentrické formy a u 7 byla prokázána multicentrická forma Castlemanovy nemoci. V naší databázi máme celkem 28 pacientů s diagnózou Castlemanova nemoc, ale popis soustředíme pouze na 14 z nich, u nichž máme kompletní vyšetření a kteří jsou dlouhodobě sledováni na našem pracovišti.
Lokalizovaná forma nemoci byla diagnostikovaná u 3 mužů a u 4 žen, medián věku byl 55 (51–69) let. U žádné z těchto osob nezpůsobovala unicentrická forma jakékoliv klinické symptomy. V případě, že ložisko bylo na povrchu těla, tak to byl vždy pacient, který si jej nahmatal a inicioval diagnostický proces. Na povrchu těla bylo však ložisko umístěno jen u 2 osob. U dalších 5 bylo odhaleno náhodně zobrazovacími metodami použitými z jiné indikace.
Léčba byla operační, vždy se podařilo provést totální resekci ložiska (tumoru) a histologicky stanovit diagnózu. Tito pacienti jsou na naší ambulanci sledováni, ale u žádného z nich nedošlo k recidivě. Přehled lokalizací unicentrické formy Castlemanovy nemoci a délku sledování uvádí tab. 1. Jak je z tabulky zřejmé, žádný z pacientů s lokalizovanou formou nemoci neměl v laboratorních hodnotách patologické nálezy, které obvykle vídáme u multicentrické formy Castlemanovy nemoci.
Tab. 1. Charakteristika pacientů s unicentrickou formou nemoci. U všech pacientů bylo ložisko totálně operačně kompletně odstraněno a jsou bez jakýchkoliv projevů nemoci. 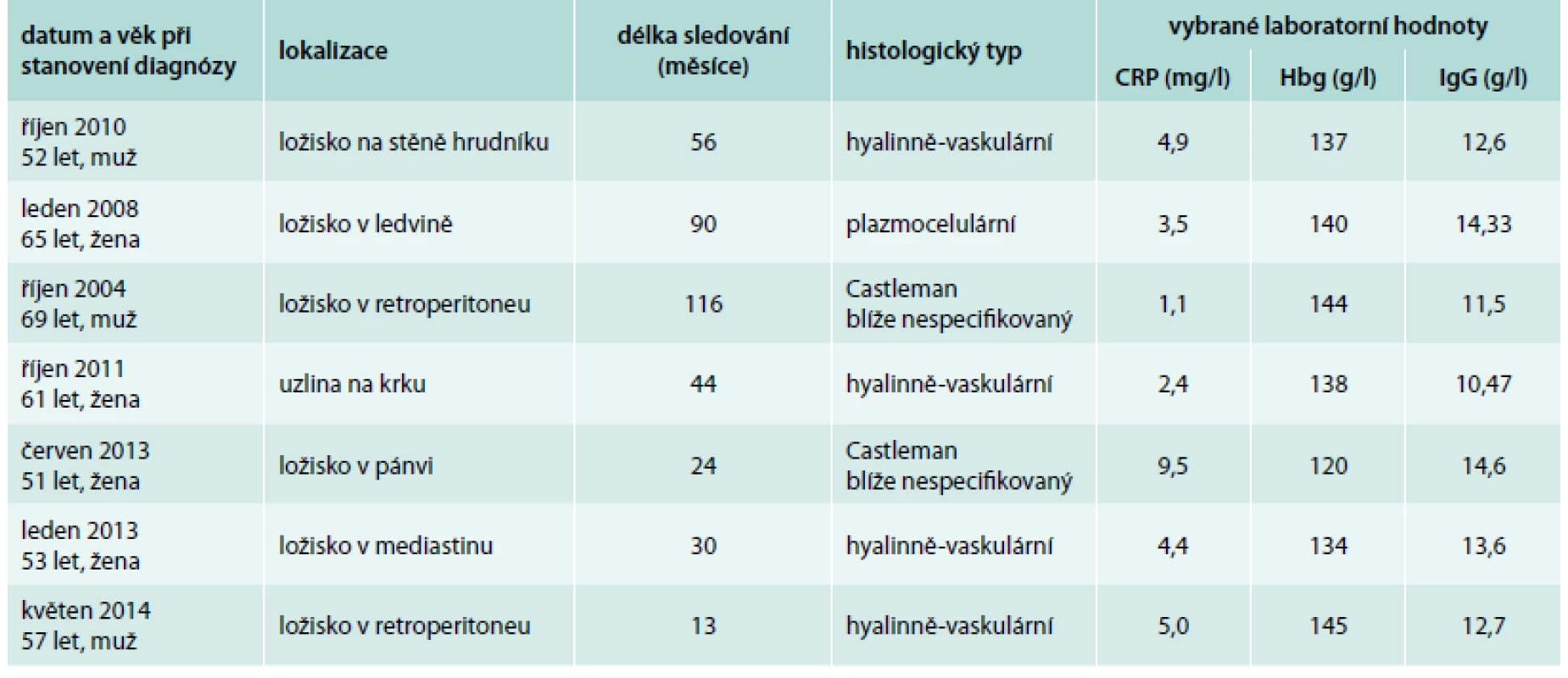
V případě 7 pacientů s multicentrickou formou Castlemanovy nemoci to byly vždy symptomy nemoci, které pacienty přivedly k lékaři. Datum stanovení diagnózy, histologický typ, rozsah nemoci, koncentraci imunoglobulinu typu IgG a výsledky vyšetření monoklonálního imunoglobulinu (imunofixace) uvádíme v tab. 2. Medián věku při stanovení diagnózy byl 58 (21–72) let a ve všech 7 případech se jednalo o muže.
Tab. 2. Pacienti s multicentrickou formou nemoci, rozsah nemoci a koncentrace celkového IgG v době stanovení diagnózy a výsledek vyšetření přítomnosti monoklonálního imunoglobulinu. Počtem předchozích nekonkluzivních histologických vyšetření ilustrujeme obtížnost stanovení této diagnózy 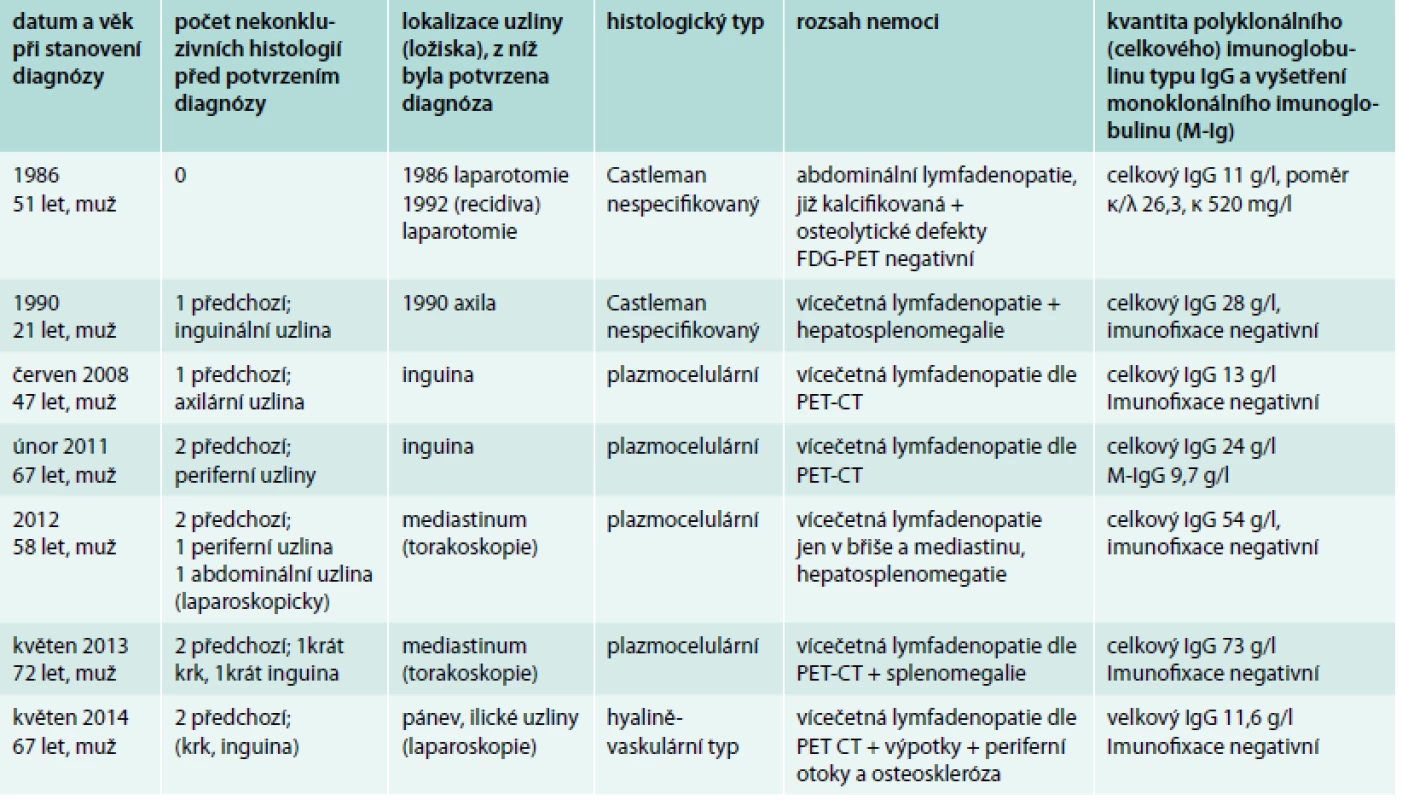
celkový IgG – koncentrace polyklonálního a případně i monoklonálního imunoglobulinu typu IgG M-IgG – monoklonální imunoglobulin typu IgG Výsledek vyšetření HIV a vyšetření lidského herpesviru 8 (HHV8) nebyl u žádného pacienta pozitivní. Detekce HHV8 je prováděna metodou polymerázové řetězové reakce (PCR) pomocí komerční soupravy CMV HHV6,7,8 R-gene společnosti Argene (Francie) na pracovišti Centra molekulární biologie a genové terapie Interní hematologické a onkologické kliniky LF MU a FN Brno, pracoviště Bohunice (kontakt pro případné žádosti o vyšetření: Mgr. Pavlína Volfová, Ph.D., pvolfova@fnbrno.cz, Sekce oportunních infekcí, Dětská nemocnice, Černopolní 9, 625 00 Brno). Výchozím biologickým materiálem pro toto vyšetření je 2,5–5 ml nesrážlivé periferní krve odebrané do zkumavky s EDTA. Transport vzorku do laboratoře je možný při pokojové teplotě, stabilita vzorku je 1–2 dny při 4 °C. Vyšetření HHV8 není rutinně prováděno ve všech laboratořích, ale u pacientů se systémovými příznaky Castlemanovy choroby může mít přítomnost viru vliv na podanou léčbu.
Průběh choroby u prvního nemocného je značně atypický, protože v roce 1986 podstoupil první operaci pro tuto nemoc, ložisko bylo vyňato, ale po čase nemoc recidivovala. Byla provedena další resekce. V současné době, tedy po 29 letech, má tento pacient při kontrolním PET-CT vyšetření v dutině břišní mnohočetné, již kalcifikované lymfatické uzliny, ale je prost dalších klinických příznaků. Jeho laboratorní hodnoty, až na stabilně vyšší koncentraci volných lehkých řetězců κ, jsou v normě.
Druhý pacient byl diagnostikován na naší klinice již v roce 1990. Měl typické B symptomy, anémii chronických chorob, hepatosplenomegalii a lymfadenopatii. Léčbu odmítal a zemřel po 22letém průběhu Castlemanovy nemoci na karcinom plic, který progredoval při léčbě.
Třetí pacient k nám přišel v roce 2008 s generalizovanou lymfadenopatií, B symptomy a vaskulitidou, která byla zřejmě příčinou cévní mozkové příhody. U tohoto pacienta nemoc překvapivě neustupovala při léčbě rituximabem, úspěšná byla až léčba talidomidem. Symptomy nemoci při léčbě talidomidem ustupovaly, ale léčba byla provázena intenzivními nežádoucími účinky talidomidu (obstipace, patologická únava, neuropatie). Proto byla léčba změněna na na léčbu lenalidomidem. Ten mu byl podáván celkem 12 měsíců. Od ukončení léčby je pacient v kompletní remisi nemoci, bez příznaků nemoci a bez patologického nálezu na kontrolních PET-CT zobrazeních, podrobnější popis průběhu vyšel již dříve [3].
Čtvrtý pacient přišel v roce 2011 s lymfadenopatií, dominantně postihující tříselné uzliny, ale také vyšší etáže lymfatických uzlin. Pacient byl léčen kombinací obsahující talidomid, posléze i lenalidomidem a dle posledního vyšetření je v kompletní remisi bez specifické léčby.
Pátý pacient byl po několika nekonkluzivních histologických odběrech diagnostikován v roce 2012. Nemoc u něj způsobovala lymfadenopatii v oblasti mediastina i dutiny břišní. Pacient měl febrilie a noční pocení. V klinickém nálezu dominovala hepatosplenomegalie, ale příčina hepatosplenomegalie nebyla zcela jasná, protože pacient měl chronickou pankreatitidu a opakované operace žlučových cest, takže další možnou příčinou hepatomegalie mohlo být chronické poškození jater. Po 6 měsících léčby obsahující talidomid vymizely veškeré klinické příznaky nemoci a upravil se i nález na PET-CT. Bohužel pacient několik měsíců po ukončené léčbě zemřel na akutní pankreatitidu [4].
Šestý pacient přišel na naše pracoviště opět pro výrazný úbytek hmotnosti, více než o 10 % za půl roku, kolísavé febrilie a noční poty. Diagnóza byla prokázána až z mediastinální uzliny. Pacientovi jsme podali zprvu 2 cykly chemoterapie R-CHOP (rituximab, cyklofosfamid, vinkristin, adriamycin, prednison v klasických dávkách), ale pro infekční komplikace pokračovala pouze monoterapie rituximabem (375 mg/m2). Celkem byl aplikován rituximab 8krát a pacient je dle kontrolních PET-CT v kompletní remisi nemoci [5].
U sedmého pacienta, u něhož v létě roku 2015 v době hodnocení probíhala léčba, byl interval do stanovení diagnózy více let. Odběry z periferních uzlin nepřinesly objasnění diagnózy, nálezy byly hodnoceny jako reaktivní lymfadenopatie. Teprve až po odběru z abdominálních uzlin, které dle PET-CT vyšetření nejvíce akumulovaly fluorodeoxyglukózu, byla histologicky potvrzena Castlemanova choroba. Na rozdíl od předchozích pacientů byla u tohoto nemocného popsána na skeletu osteosklerotická ložiska a dále retence tekutin projevující se nevelkým výpotkem v pohrudniční dutině. U tohoto pacienta byla podána léčba ve složení rituximab (375 mg/m2) i. v. infuze 1krát za měsíc + dexametazon 20 mg tbl. 1.–4. den cyklu + cyklofosfamid (500 mg/m2) 1. a 15. den cyklu. Teploty a pocity únavy vymizely již po 1. aplikaci. Na PET-CT vyšetření, provedeném po 4 cyklech této léčby, bylo prokázáno signifikantní zmenšení původně patologicky zvětšených lymfatických uzlin a dále regredoval výpotek v pohrudničních dutinách, který před léčbou dosahoval šíře 50 mm a nyní, po 4 cyklech této léčby, byla přítomna pouze rezidua, šíře pleurálního prostoru se zmenšila na 6–8 mm. Ústup pleurálního výpotku a signifikantní zmenšení lymfatických uzlin po 4 cyklech výše uvedené léčby hodnotíme jako remisi nemoci, i když osteosklerotické změny ve skeletu přetrvávají. Tento pacient podstoupil před zahájením léčby echokardiografické vyšetření, které bylo bez patologických morfologických a funkčních změn s ejekční frakcí 58 %, což svědčí pro nekardiální původ retence tekutin.
U všech 7 pacientů s multicentrickou formou Castlemanovy nemoci se vyskytovaly febrilie nebo subfebrilie. U 3 ze 7 pacientů bylo výrazné a obtěžující noční pocení. Klinické projevy vaskulitidy, která velmi pravděpodobně byla i příčinou cévní mozkové příhody, jsme diagnostikovali u 1 z těchto 7 pacientů. Osteosklerotické změny na skeletu jsme detekovali u 1 nemocného, u něhož byla i retence tekutin (anasarka). Polyklonální zmnožení imunoglobulinů, dominantně imunoglobulinu typu IgG, bylo přítomno u 5 ze 7 pacientů. V 1 případně byla navíc přítomna kompletní molekula monoklonálního imunoglobulinu, v jednom případě byla zvýšená koncentrace volných lehkých řetězců κ. Léčba těchto pacientů i výsledky jsou shrnuty v tab. 3.
Tab. 3. Přehled léčby pacientů s multicentrickou Castlemanovou chorobou a délka sledování. Pacienti s multicentrickou formou nemoci, stav nemoci v září roku 2015 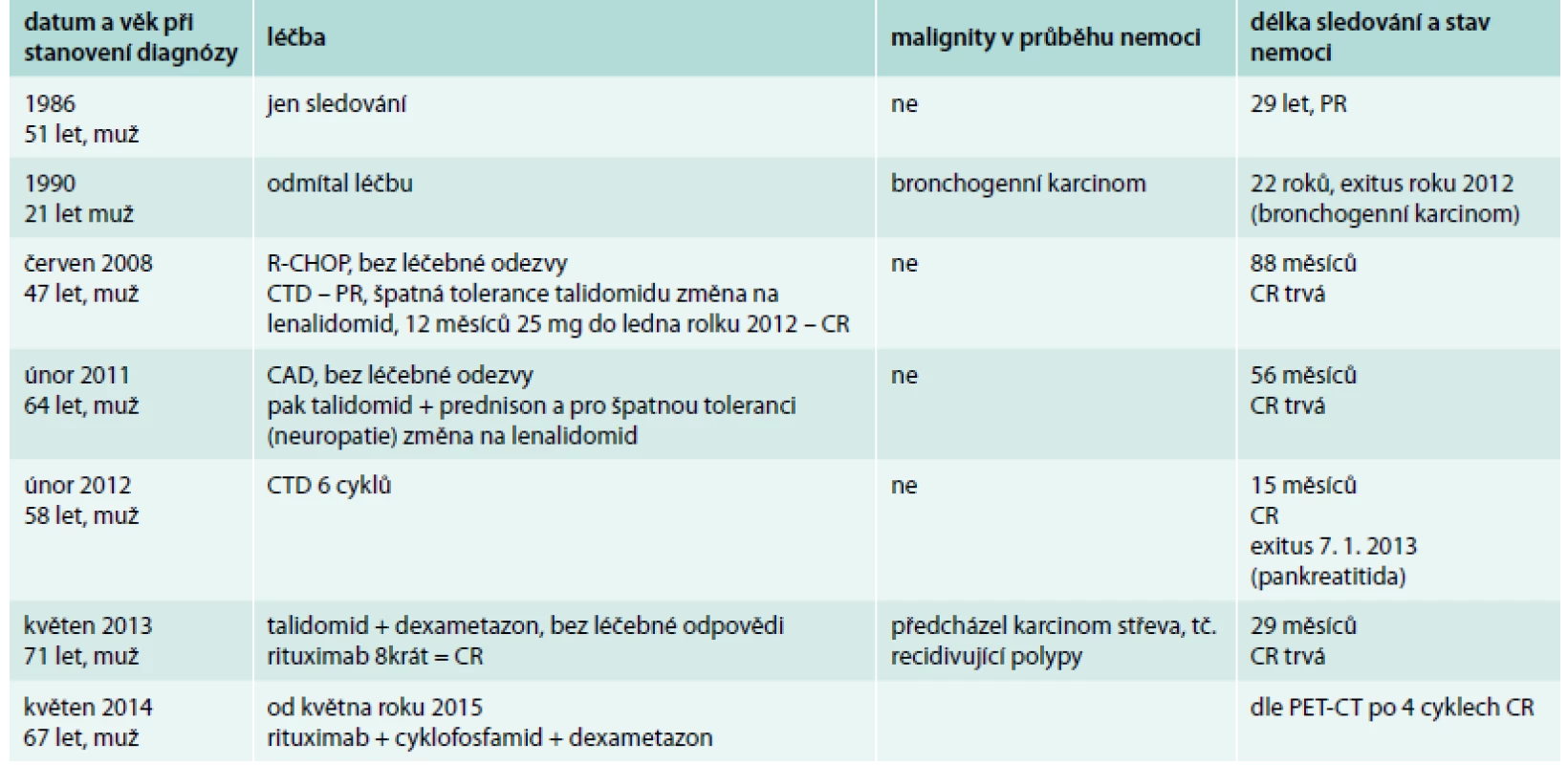
R-CHOP – rituximab, cyklofosfamid, vinkristin, adriamycin, prednison CTD – cyklofosfamid, talidomid, dexametazon CAD – cyklofosfamid, adriamycin, dexametazon CR – kompletní remise Diskuse
Vývoj poznání a členění Castlemanovy nemoci
Castlemanova choroba je reaktivní lymfoproliferace související s nadprodukcí cytokinů. V roce 1954 popsal tuto chorobu Benjamin Castleman. Jednalo se o první popis lokalizované angiofolikulární hyperplazie léčitelné operací [6].
První podrobnější histologické hodnocení a rozlišení hyalinně-vaskulárního a plazmocelulárního typu bylo zveřejněno v roce 1972 [7].
V roce 1978 bylo poprvé popsáno mnohočetné postižení lymfatických uzlin angiofolikulární hyperplazií, čili multicentrická forma Castlemanovy nemoci [8]. Od roku 1985 je známá koincidence Castlemanovy nemoci s infekcí HIV s pozdějším přechodem do Kaposiho sarkomu.
Prví popis souvislosti multicentrické Castlemanovy nemoci s humánním herpetickým virem typu 8 (virus Kaposiho sarkomu) popsal Soulier v roce 1995 a tato skutečnost byla posléze potvrzena dalšími autory [9,10]. Později se ukázalo, že téměř všichni HIV pozitivní pacienti s Castlemanovou chorobou mají přítomný virus Kaposiho sarkomu (HHV8), ale že i u části pacientů s Castlemanovou chorobou, kteří nejsou infikováni virem HIV, je přítomný tento virus.
Od roku 2000 je jasné, že příčinou jak Castlemanovy nemoci, tak i příbuzné nemoci POEMS syndromu, je nadprodukce cytokinů a že tyto nemoci se mohou vyskytovat společně [11]. V roce 2013 vyšel popis nové varianty Castlemanovy nemoci, kterou japonští autoři nazvali TAFRO syndrom. TAFRO syndrom je akronym pro trombocytopenii, ascites (anasarku), fibrotické změny v kostní dřeni s mikrocytární anémií, renální insuficienci, organomegalii a histologický nález Castlemanovy nemoci – obvykle smíšeného nebo hyalinně-vaskulárního typu. TAFRO varianta Castlemanovy nemoci nebývá provázena polyklonálním zmnožením imunoglobulinů a v kostní dřeni nebývají polyklonální plazmocyty, jak tomu bývá u klasické plazmocelulární formy Castlemanovy nemoci, ale spíše megakaryocytární hyperplazie [12,13]. Po prvních popisech TAFRO syndromu se věřilo, že tato choroba je vázaná jen na mongoloidní rasu jižního typu, totiž na Japonce [14]. V roce 2015 se objevil první popis této nemoci u rozené obyvatelky Itálie, takže je nutno ji očekávat i v evropské (kavkazoidní) populaci [15].
Castlemanova choroba patří mezi velmi vzácné choroby. Epidemiologická data máme jen z odhadů provedených v USA, v nichž stanovili incidenci na 0,15 případů/1 milion obyvatel a prevalenci na 2,4/1 milión obyvatel [16].
Patofyziologie nemoci
Multicentrická forma Castlemanovy nemoci je termín pro heterogenní skupinu patologických stavů spojených s proliferací morfologicky benigních lymfocytů. Příčinou jsou výrazně zvýšené hladiny proinflamatorních cytokinů, dominantně interleukinu 6 (IL6), s jehož koncentrací koreluje agresivita nemoci. Narušení signální kaskády IL6 protilátkami proti IL6 nebo protilátkami proti receptoru pro IL6 vede k ústupům příznaků nemoci i velikosti lymfadenopatie. IL6 je multifunkční cytokin, který indukuje plazmocytózu v kostní dřeni [17], hypergamaglobulinemii, zvýšenou tvorbu vaskulárního endoteliálního růstového faktoru (VEGF), trombocytózu, tvorbu proteinů akutního zánětu v játrech (tedy i CRP), aktivaci makrofágů a T buněk. IL6 je zodpovědný i za autoimunitní projevy, které Castlemanovu nemoc občas provázejí.
Na rozdíl od plazmocelulární varianty Castlemanovy nemoci se v případě pacientů s POEMS syndromem (akronym Polyneuropathy, Organomegaly, Endokrinopathy, Monoclonal gammopathy, Skin changes), předpokládá zvýšení VEGF (Vascular Endotelial Growth Factor) nezávislé na IL6 [17].
Určitou roli v patofyziologii hraje také interleukin 1, neboť byl popsán pacient nereagující na léčbu protilátkami proti IL6, který ale zareagoval na protilátky proti interleukinu 1 [17].
Zatím je pouze známo, že humánní herpesvirus 8 (HHV8), známý též jako virus Kaposiho sarkomu, indukuje tvorbu virového homologu IL6, a tím zvýšení všech prozánětlivých cytokinů. Nejasnou otázkou zůstává, co je příčinou zvýšených hladin prozánětlivých cytokinů u HHV8 negativních osob. Hypoteticky se připouští možnost systémové inflamatorní choroby způsobené autoprotilátkami či mutacemi proinflamatorních genů, nebo mechanizmus paraneoplastického syndromu s ektopickou produkcí cytokinů. Jako třetí možnost se také připouští zvýšení produkce IL6 následkem infekce zatím neidentifikovatelným virem [17,18].
Z pohledu vyvolávajícího činitele lze rozdělit multicentricku formu Castlemanovy nemoci na nemoc způsobenou infekcí HHV8 a na idiopatickou formu s neznámou vyvolávající příčinou [17,18].
V roce 2015 se člení nemoc dle výsledků virologických vyšetření na:
- Castlemanovu chorobu s průkazem viru HIV obvykle s pozitivitou lidského herpesviru 8 (HHV8)
- Castlemanovu chorobu bez průkazu viru HIV, ale s průkazem HHV8 metodou PCR v periferní krvi anebo s pozitivitou latentního HHV8 nukleárního antigenu v lymfatické tkáni
- idiopatická multicentrická Castlemanova choroba – případy, v nichž není prokázán ani HIV ani HHV8 infekce. Tato forma je nejčastější
Přítomnost viru HIV byla prokázána jen u menšiny (u 15 %), přítomnost viru HHV8 byla prokázána jen u 17 % [18].
Obtíže histologické diagnostiky
Morfologové v roce 2014 stále rozlišují jen 2 základní typy a další 2 typy jako odvozené varianty. V souboru asi 198 HIV negativních případů multicentrické formy Castlemanovy nemoci byly stanoveny tyto histologické typy:
- hyalinně-vaskulární typ 17–49 %
- plazmocelulární typ 46–77 %
- smíšený typ 4–20 %
- vzácný plazmablastický typ, který se ale vyskytuje jedině při HHV8 infekci, je možná transformace v plazmablastické lymfomy [19]
Histologický obraz hyalinně-vaskulárního typu je poměrně typický, takže problémy se stanovením diagnózy jsou asi méně časté, než je tomu u plazmocelulární varianty Castlemanovy choroby. Ta je charakterizována výraznou interfolikulární plazmocytózou v lymfatické uzlině. Plazmocyty jsou polyklonální. Celková architektonika lymfatické uzliny je zachována. Interfolikulárně bývají zmnožené cévy. Lymfatické folikuly obsahují hyperplastická zárodečná centra. Malá část zárodečných center často vykazuje regresivní změny a může připomínat folikuly u hyalinně vaskulární varianty s koncentricky uspořádanými lymfocyty v plášťové zóně. Bioptická diagnostika Castlemanovy choroby je obtížná. Zejména u plazmocelulární varianty jsou morfologické znaky značně nespecifické. Existuje celá řada nádorových, autoimunitních a infekčních onemocnění, která mohou imitovat obraz Castlemanovy choroby. Na druhou stranu jsou málokdy všechny morfologické znaky plně vyjádřeny a odlišení od reaktivně změněné lymfatické uzliny může být problematické [19]. Pokud je bioptický nález nejednoznačný a podezření na multicentrickou formu Castlemanovy choroby trvá, je třeba exstirpovat a histologicky vyšetřit další lymfatickou uzlinu. V našem malém souboru u 5 ze 7 pacientů s multicentrickou formou Castlemanovy nemoci předcházely 1–2 biopsie s nespecifickým nálezem zánětlivých změn. Často byly pro první excizi zvoleny dobře přístupné zvětšené uzliny na povrchu těla. A teprve až jsme obdrželi jednou či opakovaně histologický závěr „nespecifické reaktivní změny v uzlině“, přistoupili jsme k náročnějšímu odběru metodou torakoskopie či laparotomie a cílem operačního výkonu byly patologické uzliny s nejvyšší akumulací fluorodeoxyglukózy. Odběry cílené na nejvíce fluorodeoxyglukózu akumulující uzliny přinesly histologické potvrzení této diagnózy.
Japonští autoři udávají ve svém souboru interval od prvních symptomů nemoci do stanovení diagnózy 27,5 měsíce [20]. V našem souboru nejsme schopni interval od prvních příznaků do stanovení diagnózy určit, protože pacienti si ani datum prvních příznaků nepamatovali, ale jistě to bude řádově v letech.
Příznaky
Za pravidelné příznaky lze považovat neinfekční subfebrilie případně febrilie, noční pocení a úbytek hmotnosti neboli B symptomy. Tyto symptomy měli všichni naši pacienti s multicentrickou formou Castlemanovy nemoci.
Vyšetření obvykle odhalí periferní ale i mediastinální a abdominální lymfadenopatii a hepatosplenomegalii [19].
RTG snímky skeletu prokáží v některých případech osteosklerotická ložiska. Může být přítomna i retence tekutin a u těchto pacientů pomůže vyšetření brain natriuretického faktoru (BNP) a echokardiografické vyšetření srdce k diferenciální diagnostice kardiální a nekardiální příčiny retence tekutin. Na akrech se mohou objevit projevy vaskulitidy. Nejčastější příznaky nemoci a jejich frekvenci dokumentují výsledky zatím největšího souboru pacientů z Mayo Clinic v USA (tab. 4). Typické laboratorní nálezy jsou uvedeny v tab. 5. Nemoc může provázet ale více nepravidelně se vyskytujících projevů, které zde jen stručně vyjmenujeme.
Tab. 4. Klinické nálezy popsané v souboru 113 pacientů s Castlemanovou chorobou na Mayo Clinic (dle [34]) ![Klinické nálezy popsané v souboru 113 pacientů s Castlemanovou chorobou na Mayo Clinic (dle [34])](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/43236cb39d0a4bca81b299567881ca67.png)
MCN – multicentrická nemoc UCN – unicentrická nemoc Tab. 5. Laboratorní nálezy nacházené u multicentrické formy Castlemanovy choroby [34,35] ![Laboratorní nálezy nacházené u multicentrické formy Castlemanovy choroby [34,35]](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/2eb8658eeb29e74c4c26dd7c555a3b9b.png)
Poškození ledvin
Mírné poškození funkce ledvin je popisováno relativně častěji, zatímco poškození funkce ledvin s retencí dusíkatých látek vedoucí až k úplné anurii je u Castlemanovy nemoci výjimečné. Bioptická vyšetření těchto pacientů prokázala v podstatě 2 typy poškození: v 60 % poškození drobných cév ledvin (tzv. endoteliózu) a ve 20 % AA-amyloidózou [21–23]. Závažné poškození funkce ledvin jsme v našem souboru nezaznamenali.
Změny odpovídající POEMS syndromu
POEMS syndrom je akronym pro polyneuropatii, organomegalii, endokrinopatii, monoklonální gamapatii a kožní změny (skin changes) [24,25]. Tato jednotka může existovat samostatně, ale může se také prolínat s Castlemanovou chorobou. Při POEMS syndromu bývá přítomen edém papily, nevýrazná neuropatie a při zobrazení skeletu jsou zřetelné osteosklerotické změny. Příznaky POEMS syndromu a Castlemanovy choroby se mohou překrývat, proto může být problém jak nemoc nazvat.
Dle autorů z Mayo Clinic by se termín POEMS syndrom měl používat pouze pro nemocné s periferní neuropatií a dalšími znaky POEMS syndromu, kteří mají prokázanou klonální expanzi plazmocytů v kostní dřeni. Pro nemocné s Castlemanovou chorobou, kteří sice mají některé známky POEMS syndromu, ale nemají ani neuropatii, ani klonální plazmocyty v kostní dřeni, doporučují používat termín „variantní forma Castlemanovy choroby se znaky POEMS syndromu“.
V souboru 113 pacientů s multicentrickou formou Castlemanovy choroby byly u 34 % zjištěny příznaky POEMS syndromu.
K projevům patří tvorba kožních hemangiomů, které lze považovat za jeden ze znaků POEMS syndromu [26–32]. V našem souboru jsme osteosklerotické změny na skeletu odhalili pouze u 1 ze 7 sledovaných osob s multicentrickou formou nemoci.
Nekardiální dušnost a retence tekutin
Dalšími popisovanými příznaky je dušnost, jejíž etiologie není zcela jasná, a měnlivé patologické nálezy v plicním parenchymu při HRCT vyšetření [16,19]. V souvislosti s Castlemanovou nemocí byla již dříve popisována retence tekutin (periferní edémy, ascites, plicní či perikardiální výpotek). Anasarka je jedním z hlavních příznaků Castleman–TAFRO syndromu. Náš poslední popisovaný pacient měl normální nález na echokardiografickém vyšetření s ejekční frakcí 58 %, a přesto měl oboustranné otoky dolních končetin a oboustranný perikardiální výpotek, který ale ustoupil při léčbě obsahující rituximab. U tohoto našeho pacienta byla Castlemanova choroba zřejmě příčinou otoků a tekutiny v pleurálním prostoru.
Vaskulitidy a cévní mozkové příhody
Vaskulitidy nejsou pravidelné, vyskytují se občas a jsou často příčinou cévních mozkových příhod [16,29,32]. V našem souboru jsme vaskulitidu zjistili u jednoho pacienta, u něhož zřejmě způsobila cévní mozkovou příhodu s pravostrannou hemiparézou.
Poruchy imunity a autoimunity
Castlemanova nemoc může vést k poruchám imunitní reakce a vzniku autoimunit. Nejčastější z autoimunit je autoimunitní anémie, trombocytopenie a již výše zmíněná vaskulitida. Je nutno však respektovat i snížení imunity, které může být příčinou infekčních komplikací. U našeho šestého pacienta s multicentrickou formou Castlemanovy nemoci předcházely stanovení diagnózy dvě ataky pásového oparu a v průběhu léčby pak třetí ataka. Jeho léčba byla provázena závažnými infekčními komplikacemi, proto jsme po 2 cyklech chemoterapie R-CHOP pokračovali jenom v monoterapii rituximabem, kterou snesl bez dalších komplikací.
Průjmy a zažívací problémy
Choroba má opravdu velice měnlivé příznaky, výjimečně se tato nemoc projevila jako delší dobu trvající průjmy s hmotnostním úbytkem [33]. Tuto komplikaci jsme v našem souboru nezaznamenali.
Průběh idiopatické multicentrické formy Castlemanovy nemoci
Idiopatická multicetrická forma Castlemanovy nemoci se typicky objevuje ve 4. a v 5. dekádě života, častěji u mužů než u žen. Z popisu případů je však zřetelné, že u většiny nemocných má choroba dlouholetý průběh, pacienty sice rychle nezabíjí, ale výrazně zhoršuje kvalitu jejich života. Projevy případné vaskulitidy mohou trvale invalidizovat (cévní mozkové příhody) a komplikují další léčbu i ošetřování. Vzhledem k narušení imunity se ve srovnání s průměrnou populací u těchto nemocných zvyšuje výskyt dalších maligních chorob [35].
V podstatě se popisují následné 4 formy klinických průběhů [35]:
- opakované relapsy a remise
- stabilní perzistující choroba
- progredující fatální choroba
- transformace v maligní lymfom
Poměrně často se objevují popisy komplikujících cévních mozkových příhod, které pravděpodobně souvisejí s vaskulitidou [35].
Léčba
Klasická chemoterapie
V letech před příchodem biologických léků do klinické praxe (antiCD20 protilátky a talidomidu a lenalidomidu) byly testovány klasické chemoterapeutické kombinace používané pro léčbu maligních lymfomů. Léčba založená na kombinaci cytostatik v některých případech vedla k vymizení symptomů nemoci, ale jak plyne z naší zkušenosti, v případě alterované imunity provázející Castlemanovu nemoc a dlouhodobější neutropenie může být klasická chemoterapie provázena život ohrožujícími infekcemi. Přehled všech publikovaných zkušeností s klasickou chemoterapií lze nalézt v citované literatuře [36–38].
AntiCD20 protilátka (rituximab)
Rituximab je monoklonální protilátka proti povrchovému antigenu CD20, který je lokalizován na fyziologických i transformovaných B-lymfocytech. Po navázání dochází k destrukci těchto lymfocytů. A protože polyklonální B-lymfocyty tvoří převážnou část uzlin postižených Castlemanovou chorobou, je racionální použít cílené destrukce těchto buněk pomocí antiCD20 protilátky. Rituximab je u této choroby účinný i v monoterapii, jak vyplývá z četných citovaných popisů případů, ale je možné také účinek rituximabu potencovat kombinací s dalšími léky, které se používají při léčbě maligních lymfomů, tedy s glukokortikoidy a dále s alkylačními či antracyklinovými cytostatiky. Rituximab má potenciál navodit léta trvající kompletní remisi a podstatné je, že účinnost této léčby byla potvrzena velkým počtem publikací, takže na rituximab v této indikaci lze nahlížet jako na léčbu volby [39–50]. Gerald v roce 2007 popsal 92 % léčebných odezev při monoterapii rituximabem, přičemž léčebné odezvy měly dlouhodobý charakter, 79 % pacientů bylo po 2 letech sledování stále v remisi [51]. Léčba rituximabem snižuje dle některých pozorování riziko pozdější transformace v maligní lymfom [51].
V literatuře lze najít několik prací, které popisují synergický účinek podání rituximabu a talidomidu. Talidomid, imunomodulační, antiinflamatorní a antiangiogenní lék má silnou aktivitu proti této nemoci i v monoterapii. Proto je doporučována kombinovaná léčba rituximabem a talidomidem [52,53].
Z našich 7 pacientů byli rituximabem léčeni 3, v prvním případě nebyla po rituximabu dostatečná léčebná odezva, kompletní remise bylo dosaženo teprve talidomidem a lenalidomidem. V druhém a třetím případě navodil rituximab kompletní remisi nemoci potvrzenou PET-CT vyšetřením. U 2 ze 3 léčených navodila tedy léčba obsahující rituximab kompletní remisi nemoci.
IMIDs – imunomodulační léky
Talidomid byl jako první zařazen do skupiny IMIDs – immunomodulatory drugs. V lidském organizmu má velmi pestré účinky. Mimo jiné potlačuje tvorbu některých cytokinů, mezi nimi IL6 a VEGF. A právě tato jeho vlastnost, tedy schopnost potlačovat tvorbu prozánětlivých cytokinů, jej činní účinným proti Castlemanově nemoci, jak dokládají četné popisy případů [54–62].
V našem souboru 7 pacientů jsme talidomid a případně lenalidomid použili celkem 3krát, ve dvou případech navolily tyto léky remisi nemoci. V jednom případě, v němž byl použit talidomid jako lék první volby, jeho podávání nevedlo k navození remise, a proto byla tato léčba ukončena a v rámci léčby druhé linie byl podán rituximab, který navodil kompletní remisi.
Bortezomib
Úspěchy bortezomibu u mnohočetného myelomu vedly k testování bortezomibu u plazmocelulární varianty Castlemanovy nemoci. A dle 3 publikací, které popisují tuto léčbu, bylo podání bortezomibu spojeno s dosažením kompletní remise. Bortezomib je tedy po rituximabu dalším novým účinným lékem pro tyto nemocné [63–65].
Protilátka proti interleukinu 6 a jeho receptoru
V literatuře lze nalézt popisy případů s multicentrickou formou Castlemanovy nemoci úspěšně léčených protilátkou proti receptoru interleukinu 6, zvanou tocilizumab. Úspěšnost této léčby byla prokázána. Tato látka je používána hlavně v Asii a Japonsku, jak plyne z citované literatury [66–73].
Po léčbě tocilizumabem byla také popsána regrese orgánového poškození při Castlemanově nemoci, ústup kardiomyopatie anebo zlepšení funkce ledvin [74–76].
V Evropské unii je od května roku 2014 registrována pro léčbu multicentrické formy Castlemanovy choroby protilátka proti interleukinu 6 zvaná siltuximab (SYLVANT). Podmínkou je nepřítomnost infekce HIV a nepřítomnost infekce lidským herpesvirem 8 (HHV8). Siltuximab tvoří stabilní komplexy s bioaktivními formami interleukinu 6 a brání jeho vazbě na rozpustné i membránové vazebné receptory. Siltuximab se podává v doporučené dávce 11 mg/kg formou intravenózní infuze 1krát za 3 týdny až do případného selhání léčby. Ošetřující lékař si musí být vědom, že přípravek siltuximab může maskovat známky akutního zánětu včetně potlačení horečky a reaktantů akutní fáze, a naopak může vést ke zvýšení hodnoty triglyceridů a cholesterolu v séru. Proto se požaduje, aby pacienti měli vždy před podáním siltuximabu alespoň počet neutrofilů > 1,0 × 109/l a počet trombocytů > 50 × 109/1 a při závažné infekci by se léčba siltuximabem měla vždy přerušit [77–80].
Randomizované srovnání léčby siltuximabu ve srovnání s placebem prokázalo u 53 hodnotitelných pacientů léčených siltuximabem celkem jen 34 % léčebných odezev, zatímco nemocní léčení placebem byli bez jakéhokoliv zlepšení [80].
Závěry pro praxi
- nejasná lymfadenopatie a teploty trvající déle než 3 týdny mohou mít příčinu mimo jiné v Castlemanově nemoci
- polyklonální zvýšení imunoglobulinů a volných lehkých řetězců κ a λ a zvýšená koncentrace celkové bílkoviny, stejně jako zvýšené CRP bez příznaků infekce anebo anémie odpovídající anémii chronických chorob, může mít příčinu v Castlemanově nemoci
- chronická zánětlivá reakce s febriliemi či subfebriliemi, nočním pocením a úbytkem hmotnosti může mít příčinu v Castlemanově nemoci
- histologická diagnostika multicentrické formy nemoci je obtížná, protože jde o reaktivní proliferaci lymfocytů a plazmocytů, které musí vždy tvořit typický morfologický obraz a nemoc může být popsána jako nespecifické reaktivní změny; pro úspěch histologického vyšetření se ukázalo jako přínosné zvolit pro odběr k histologickému vyšetření ty uzliny, které vykazují nejvyšší akumulaci fluorodeoxyglukózy při PET-CT vyšetření
- PET-CT zobrazení je užitečné pro zjištění rozsahu nemoci i pro hodnocení léčebného efektu
- multicentrická forma Castlemanovy choroby může být spojena s defektem imunitní odezvy, a proto klasická chemoterapie a léčba vysokými dávkami glukokortikoidů může přivodit závažné nežádoucí komplikace (běžné i oportunní infekce)
- základními léky pro multicentrickou formu Castlemanovy choroby jsou: monoklonální protilátka antiCD20, rituximab (Mabthera), léky ze skupiny IMIDs (talidomid, lenalidomid) a monoklonální protilátka proti IL6 (siltuximab) a proti receptoru pro IL6 (tocilizumab)
- v případě, že nemoc nereaguje na jednu z výše uvedených alternativ, je třeba otestovat další ze jmenovaných léků, protože nemoc nereagující na jeden typ léčby může kompletně ustoupit po jiné léčbě, jak dokumentují zkušenosti z našeho malého souboru, u některých pacientů nemoc lépe ustupuje po léčbě obsahující IMIDs, zatímco u jiných po léčbě obsahující rituximab, a praxe vždy ukáže, který z výše jmenovaných léků je pro konkrétního pacienta optimální
- podrobné informace lze nalézt též na www.vzacne-diagnozy.cz
Práce byla vytvořena na podporu následujících grantových aktivit: AZV 15–29508A – MZ ČR – RVO (FNBr, 65269705) a 23/14/NAP.
prof. MUDr. Zdeněk Adam, CSc.
z.adam@fnbrno.cz
Interní hematologická a onkologická klinika LF MU a FN Brno, pracoviště Bohunice
www.fnbrno.cz
Doručeno do redakce 4. 8. 2015
Přijato po recenzi 1. 10. 2015
Zdroje
1. Dispenzieri A. Castleman disease. Cancer Treat Res 2008; 142 : 293–330.
2. Ščudla V. Anémie chronických chorob, standardy diagnostiky a léčby. Vnitř Lék 2002; 48(5): 422–426.
3. Szturz P, Adam Z, Moulis M et al. Naše zkušenosti s léčbou multicentrické plazmocelulární varianty Castlemanovy choroby s projevy vaskulitidy. Vnitř Lék 2012; 58(9): 679–690.
4. Adam Z, Szturz P, Křen L et al. PET-CT dokumentovaný rychlý nástup léčebné odpovědi cyklofosfamidu, thalidomidu a dexametazonu u multicentrické formy Castlemanovy nemoci. Popis případu a přehled informací o léčbě. Vnitř Lék 2013; 59(4): 301–312.
5. Adam Z, Szturz P, Koukalová R et al. PET-CT dokumentovaná remise multicentrické formy Castlemanovy choroby po léčbě rituximabem Popis případu a přehled literatury Vnitř Lék 2015; 61(3): 251–259.
6. Castleman B, Towe VW. Case report of the Massachusetts General Hospital weekly clinicopathological exercises, fouded by Richard C Cabot. N Engl J Med 1954; 251(10): 396–400.
7. Keller AR, Hochholzer L, Castleman B. Hyaline-vascular and plasma-cell types of giant lymph node hyperplasia of the mediastinum and other localisation. Cancer 1972; 29(3): 670–683.
8. Gaba AR, Stein RS, Sweet DJ et al. Multicentric giant node hyperplasia. Am J Clin Pathol 1978; 69(1): 86–90.
9. Soulier J, Grollet L, Oksenhendler E et al. Kaposi’s sarcoma-associated herpesvirus-like DNA sequences in multicentric Castleman’s disease. Blood 1995; 86(4): 1276–1280.
10. Chadbum A, Cesarman E, Nador RG et al. Kaposi´s sarcoma-associated herpesvirus sequences in benign lymphoid proliferations not associated with human immunodeficiency virus. Cancer 1997; 80(4): 788–797.
11. Riu P, Noesl LH, Droz D et al. Glomerular involvement in lymfoproliferative disorders with hyperproduction of cytokines (Castleman, POEMS). Adv Nephrol Necker Hosp 2000; 30 : 305–331.
12. Masaki Y, Nakajima A, Iwao H et al. Japanese variant of multicentric castleman’s disease associated with serositis and thrombocytopenia – a report of two cases: is TAFRO syndrome (Castleman - Kojima disease) a distinct clinicopathological entity? J Clin Exp Hematop 2013; 53(1): 79–85.
13. Kawabata H, Takai K, Kojima M et al. Castleman-Kojima disease (TAFRO syndrome): a novel systemic inflammatory disease characterized by a constellation of symptoms, namely, thrombocytopenia, ascites (anasarca), microcytic anemia, myelofibrosis, renal dysfunction, and organomegaly. J Clin Exp Hematop 2013; 53(1): 57–61.
14. Inoue M, Ankou M, Hua J et al. Complete resolution of TAFRO syndrome (thrombocytopenia, anasarca, fever, reticulin fibrosis and organomegaly) after immunosuppressive therapies using corticosteroids and cyclosporin A: a case report. J Clin Exp Hematop 2013; 53(1): 95–99.
15. Tedesco S, Postacchini L, Manfredi L et al. Successful treatment of a Caucasian case of multifocal Castleman´s disease with TAFRO syndrome with pathophysiology targeted therapy - case report. Exp Hematol Oncol 2015; 4(1): 3. Dostupné z DOI: <http://dx.doi.org/10.1186/2162–3619–4-3>.
16. Robinson D Jr, Reynolds M, Casper C et al. Clinical epidemiology and treatment patterns of patients with multicentric Castleman disease: results from two US treatment centres. Br J Haematol 2014; 165(1): 39–48.
17. Fajgenbaum DC, vanRhee F, Nabel CS. HHV-8 negative idiopathic multicentric Castleman disease: novel insight into biology pathogenesis and therapy. Blood 2014; 123(19): 2924–2933.
18. Bower M, Pria AD, Coyle C et al. Diagnostic criteria schemes for multicentric Castleman disease in 75 cases. J Acquir Immune Defic Syndr 2014; 65(2): e80-e82. Dostupné z DOI: http://dx.doi.org/10.1097/QAI.0b013e3182a8338f.
19. Cronin DM, Warnke RA. Castleman disease: an update on classification and the spectrum of associated lesions. Adv Anat Pathol 2009; 16(4): 236–246.
20. Kawabata H, Kadowaki N, Nishikori M et al. Clinical features and treatment of multicentric Castleman’s disease : a retrospective study of 21 Japanese patients at a single institute. J Clin Exp Hematop 2013; 53(1): 69–77.
21. El Karoui K, Vuiblet V, Dion D et al. Renal involvement in Castleman disease. Nephrol Dial Transplant 2011; 26(2): 599–609.
22. Sydor A, Madura M, Wagrowska-Danilewicz M. Amyloid a amyloidosis and renal failure in a course of Castleman disease. Nephrology (Carlton) 2007; 12(6): 620–621.
23. Leung KT, Wong KM, Choi KS et al. Multiicentric Castleman’s disease complicated by secondary renal amyloidosis. Nephrology (Carlton) 2004; 9(6): 392–393.
24. Dispenzieri A, Buadi FK. A review of POEMS syndrome. Oncology (Williston Park) 2013; 27(12): 1242–1250.
25. Dispenzieri A. POEMS syndrome: 2014 update on diagnosis, risk-stratification, and management. Am J Hematol 2014; 89(2): 214–223.
26. Fajgenbaum DC, Rosenbach M, van Rhee F et al. Eruptive cherry hemangiomatosis associated with multicentric Castleman disease: a case report and diagnostic clue. JAMA Dermatol 2013; 149(2): 204–208. Erratum in JAMA Dermatol 2014; 150(4): 460.
27. Ruwan KP, Parakramawansha C, Wijeweera I et al. A case of POEMS syndrome with mixed hyaline vascular and plasma cell type Castleman’s disease. Ceylon Med J 2009; 54(2): 68–69.
28. Misri R, Kharkar V, Dandale A et al. Multiple capillary hemangiomas: a distinctive lesion of multicentric Castleman’s disease and POEMS syndrome. Indian J Dermatol Venereol Leprol 2008; 74(4): 364–366.
29. Garcia T, Dafer R, Hocker S et al Recurrent strokes in two patients with POEMS syndrome and Castleman’s disease. J Stroke Cerebrovasc Dis 2007; 16(6): 278–284.
30. Owens CL, Weir EG, Ali SZ. Cytopathologic findings in “POEMS” syndrome associated with Castleman disease. Diagn Cytopathol 2007; 35(8): 512–515.
31. Eisenbarth SC, Colegio OR, Iyer A et al. Images in neuro-oncology: a case of POEMS (Polyneuropathy, Organomegaly, Endocrinopathy, Monoclonal protein and Skin changes) in a patient with multicentric Castleman’s disease. J Neurooncol 2007; 81(2): 163–165.
32. Huang J, Wang L, Zhou W et al. Hyaline vascular Castleman disease associated with POEMS syndrome and cerebral infarction. Ann Hematol 2007; 86(1): 59–61.
33. Tal Y, Haber G, Cohen MJ et al. Autologous stem cell transplantation in a rare multicentric Castleman disease of the plasma cell variant. Int J Hematol 2011; 93(5): 677–680.
34. Dispenzieri A, Armitage JO, Loes MJ et al. The clinical spectrum of Castleman´s disease. Am J Hematol 2012; 87(11): 997–1002.
35. Robinson D jr, Reynolds M, Casper C et al. Clinical epidemiology and treatment patterns of patients with multicentric Castleman disease: results from two US treatment centres. Br J Haematol 2014; 165(1): 39–48.
36. Chronowski GM, Ha CS, Wilder RB et al. Treatment of unicentric and multicentric Castleman disease and the role of radiotherapy. Cancer 2001; 92(3): 670–676.
37. Wolf M, Van Offel JF, Van de Velde A et al. Multicentric plasma cell variant Castleman’s disease presenting with cutaneous vasculitis and pulmonary parenchymal involvement in a patient with ankylosing spondylitis: case report and review of the literature. Acta Clin Belg 2011; 66(4): 305–310.
38. Dham A, Peterson BA. Castleman disease. Curr Opin Hematol 2007; 14(4): 354–359.
39. Peker D, Martinez AE, Schwartz MA et al. Complete remission in 4 patients with human herpesvirus 8-associated multicentric Castleman disease using rituximab and liposomal doxorubicin, a novel chemotherapy combination. Clin Adv Hematol Oncol 2012; 10(3): 204–206.
40. Hoffmann C, Schmid H, Müller M et al. Improved outcome with rituximab in patients with HIV-associated multicentric Castleman disease. Blood 2011; 118(13): 3499–3503.
41. Fragasso A, Mannarella C, Ciancio A et al. Complete remission and virologic response to combined chemoimmunotherapy (R-CVP) followed by rituximab maintenance in HIV-negative, HHV-8 positive patient with multicentric Castleman disease. Leuk Lymphoma 2008; 49(11): 2224–2226.
42. Casquero A, Barroso A, Fernández Guerrero ML. Use of rituximab as a salvage therapy for HIV-associated multicentric Castleman disease. Ann Hematol 2006; 85(3): 185–187.
43. Ide M, Kawachi Y, Izumi Y et al. Long-term remission in HIV-negative patients with multicentric Castleman’s disease using rituximab. Eur J Haematol 2006; 76(2): 119–123.
44. Powles T, Stebbing J, Montoto S et al. Rituximab as retreatment for rituximab pretreated HIV-associated multicentric Castleman disease. Blood 2007; 110(12): 4132–4133.
45. Bestawros A, Michel R, Séguin C et al. Multicentric Castleman’s disease treated with combination chemotherapy and rituximab in four HIV-positive men: a case series. Am J Hematol 2008; 83(6): 508–511.
46. Buchler T, Dubash S, Lee V et al. Rituximab failure in fulminant multicentric HIV/human herpesvirus 8-associated Castleman’s disease with multiorgan failure: report of two cases. AIDS 2008; 22(13): 1685–1687.
47. Bower M, Veraitch O, Szydlo R et al. Cytokine changes during rituximab therapy in HIV-associated multicentric Castleman disease. Blood 2006; 113(19): 4521–4524.
48. Mian H, Leber B. Mixed variant multicentric Castleman disease treated with rituximab: case report. J Pediatr Hematol Oncol 2010; 32(8): 622.
49. Lee JP, Kim DK, Oh DY et al. Successfully treated multicentric Castleman’s disease with renal thrombotic microangiopathy using rituximab and corticosteroid. Clin Nephrol 2011; 75(2): 165–170.
50. Gérard L, Bérezné A, Galicier L et al . Prospective study of rituximab in chemotherapy-dependent human immunodeficiency virus associated multicentric Castleman’s disease: ANRS 117 CastlemaB Trial. J Clin Oncol 2007; 25(22): 3350–3356.
51. Gérard L, Michot JM, Burcheri S et al. Rituximab decreases the risk of lymphoma in patients with HIV-associated multicentric Castleman disease. Blood 2012; 119(10): 2228–2233.
52. Ramasamy K, Gandhi S, Flowers MT et al. Rituximab and thalidomide combination therapy for Castleman Disease. Brit J Haematol 2012; 158(3): 415–429.
53. Stary G, Kohrgruber N, Herneth AM et al. Complete regression of HIV-associated multicentric Castleman disease treated with rituximab and thalidomide. AIDS 2008; 22(10): 1232–1234.
54. Fishman SJ, Feins NR, D’Amato RJ et al. Long-term remission of Crohn’s disease treated with thalidomide: a seminal case report. Angiogenesis 1999; 3(3): 201–204.
55. Lee FC, Merchant SH. Alleviation of systemic manifestations of multicentric Castleman’s disease by thalidomide. Am J Hematol 2003; 73(1): 48–53.
56. Starkey CR, Joste NE, Lee FC. Near-total resolution of multicentric Castleman disease by prolonged treatment with thalidomide. Am J Hematol. 2006; 81(4): 303–304.
57. Kim SY, Lee SA, Ryoo HM et al. Thalidomide for POEMS syndrome. Ann Hematol 2006; 85(8): 545–546.
58. Wang X, Ye S, Xiong C et al. Successful treatment with bortezomib and thalidomide for POEMS syndrome associated with multicentric mixed-type Castleman’s disease. Jpn J Clin Oncol 2011; 41(10): 1221–1224.
59. Menegato MA, Canelles MF, Tonutti E et al. Remission of nephrotic syndrome after thalidomide therapy in a patient with Castleman’s disease. Clin Nephrol 2004; 61(5): 352–356.
60. Miltenyi Z, Toth J, Gonda A et al. Successful immunomodulatory therapy in castleman disease with paraneoplastic pemphigus vulgaris. Pathol Oncol Res 2009; 15(3): 375–381.
61. Zhao X, Shi R, Jin X et al. Diffuse hyperpigmented plaques as cutaneous manifestation of multicentric Castleman disease and treatment with thalidomide: report of three cases. J Am Acad Dermatol 2011; 65(2): 430–432.
62. Jung CP, Emmerich B, Goebel FD et al. Successful treatment of a patient with HIV-associated multicentric Castleman disease (MCD) with thalidomide. Am J Hematol 2004; 75(3): 176–177.
63. Wang X, Ye S, Xiong C et al. Successful treatment with bortezomib and thalidomide for POEMS syndrome associated with multicentric mixed-type Castleman’s disease. Jpn J Clin Oncol 2011; 41(10): 1221–1224.
64. Hess G, Wagner V, Kreft A et al. Effects of bortezomib on proinflamatory cytokine levels and transfusion dependency in patient with multicentric Castleman disease. Brit J Haematol 2006; 134(5): 544–545.
65. Sobas MA, Alonso Vence N, Diaz Arias J et al. Efficacy of bortezomib in refractory form of multicentric Castleman disease associated to POEMS syndrome (MCD-POEMS variant). Ann Hematol 2010; 89(2): 217–219.
66. Galeotti C, Boucheron A, Guillaume S et al. Sustained remission of multicentric Castleman disease in children treated with tocilizumab, an anti-interleukin-6 receptor antibody. Mol Cancer Ther 2012; 11(8): 1623–1626.
67. Yuzuriha A, Saitoh T, Koiso H et al. Successful treatment of autoimmune hemolytic anemia associated with multicentric Castleman disease by anti-interleukin-6 receptor antibody (tocilizumab) therapy. Acta Haematol 2011; 126(3): 147–150.
68. Higuchi T, Nakanishi T, Takada K et al. A case of multicentric Castleman’s disease having lung lesion successfully treated with humanized anti-interleukin-6 receptor antibody, tocilizumab. J Korean Med Sci 2010; 25(9): 1364–1367.
69. Arita Y, Sakata Y, Sudo T et al. The efficacy of tocilizumab in a patient with pulmonary arterial hypertension associated with Castleman’s disease. Heart Vessels 2010; 25(5): 444–447.
70. Song SN, Tomosugi N, Kawabata H et al. Down-regulation of hepcidin resulting from long-term treatment with an anti-IL-6 receptor antibody (tocilizumab) improves anemia of inflammation in multicentric Castleman disease. Blood 2010; 116(18): 3627–3634.
71. Nishimoto N, Terao K, Mima T et al. Mechanisms and pathologic significances in increase in serum interleukin-6 (IL-6) and soluble IL-6 receptor after administration of an anti-IL-6 receptor antibody, tocilizumab, in patients with rheumatoid arthritis and Castleman disease. Blood 2008; 112(10): 3959–3964.
72. Williams SC. First IL-6-blocking drug nears approval for rare blood disorder. Nat Med 2013; 19(10): 1193.
73. Robey RC, Mletzko S, Colley C et al. The use of monoclonal antibodies to treat Castleman’s disease. Immunotherapy 2014; 6(2): 211–219.
74. Nagai K, Ueda A, Yamagata K. Successful use of tocilizumab in a case of multicentric Castleman’s disease and end-stage renal disease. Ther Apher Dial 2014; 18(2): 210–211.
75. Man L, Goudar RK. Reversal of cardiomyopathy with tocilizumab in a case of HIV-negative Castleman’s disease. Eur J Haematol 2013; 91(3): 273–276.
76. Otani N, Morishita Y, Oh I et al. Successful treatment of a mesangial proliferative glomerulonephritis with interstitial nephritis associated with Castleman’s disease by an anti-interleukin-6 receptor antibody (tocilizumab). Intern Med 2012; 51(11): 1375–1378.
77. Liu YC, Stone K, van Rhee F. Siltuximab for multicentric Castleman disease. Expert Rev Hematol 2014; 7(5): 545–557.
78. van Rhee F, Fayad L, Voorhees P et al. Siltuximab, a novel anti-interleukin-6 monoclonal antibody, for Castleman’s disease. J Clin Oncol 2010; 28(23): 3701–3708.
79. Kurzrock R, Voorhees PM, Casper C et al. A phase I, open-label study of siltuximab, an anti-IL-6 monoclonal antibody, in patients with B-cell non-Hodgkin lymphoma, multiple myeloma, or Castleman disease. Clin Cancer Res 2013; 19(13): 3659–3670.
80. van Rhee F, Wong RS, Munshi N et al. Siltuximab for multicentric Castleman´s disease. A randomized double blind placebo controlled trial. Lancet Oncol 2014; 15(9): 966–974.
Štítky
Diabetológia Endokrinológia Interné lekárstvo
Článok vyšiel v časopiseVnitřní lékařství
Najčítanejšie tento týždeň
2016 Číslo 4- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
- Intermitentní hladovění v prevenci a léčbě chorob
- Rizikové období v léčbě růstovým hormonem: přechod mladých pacientů k lékařům pro dospělé
- Statinová intolerance
- Monoklonální protilátky v léčbě hyperlipidemií
-
Všetky články tohto čísla
- Epikardiální tuk jako další kamínek v mozaice upřesnění kardiovaskulárního rizika? – editorial
- Metformin u nemocných s 2. typem diabetes mellitus a laktátová acidóza – editorial
- Populace pacientů s diabetem se změnila, pacienti žijí déle a vykazují vyšší riziko srdečního selhání – editorial
- DRESS syndrom – editorial
- Efektivní příprava střeva před koloskopií – nízkoobjemový PEG v děleném režimu
- Význam epikardiálneho tuku a obezitných parametrov pri predikcii koronárnej choroby srdca
- Diuretická liečba u pacientov s akútnym pľúcnym edémom nevyvolala závažnú hyponatriémiu ani hypokaliémiu
- Analýza vztahu volných lehkých řetězců κ/λ a páru těžkých/lehkých řetězců imunoglobulinu ke stratifikaci mnohočetného myelomu podle Mayo Stratification of Myeloma and Revised International Staging System
- Oznam/Oznámení
- Mutácia protrombínového génu 20210A v slovenskej populácii
- Léčba 14 případů Castlemanovy nemoci: zkušenosti jednoho centra a přehled literatury
- Chronická obličková choroba, metformín a laktátová acidóza
- Betablokátory a chronická obstrukční plicní nemoc
- Přehled současných metod screeningu kolorektálního karcinomu
- Účinek antihypertenzní léčby u diabetu závisí na hodnotách krevního tlaku: systematický přehled a metaanalýzy
- Co přináší fixní kombinace kandesartanu a amlodipinu?
- Sú niektoré antidiabetiká aj liekmi na srdcové zlyhávanie?
-
PCSK9 inhibitory – nové možnosti v léčbě hypercholesterolemie: U koho budou indikovány?
Stanovisko České společnosti pro aterosklerózu - DRESS syndróm
-
MUDr. Karel Roztočil, CSc.,
předseda České angiologické společnosti České lékařské společnosti JEP slaví 75. narozeniny - 41. Angiologické dny
-
Eva Sedláčková, Viera Bajčiová a kol.
Neuroendokrinní nádory
- Vnitřní lékařství
- Archív čísel
- Aktuálne číslo
- Iba online
- Informácie o časopise
Najčítanejšie v tomto čísle- DRESS syndróm
-
PCSK9 inhibitory – nové možnosti v léčbě hypercholesterolemie: U koho budou indikovány?
Stanovisko České společnosti pro aterosklerózu - Betablokátory a chronická obstrukční plicní nemoc
- Chronická obličková choroba, metformín a laktátová acidóza
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



