Management metabolických nežádoucích účinků everolimu u pacientů s renálním karcinomem
Management of metabolic adverse effects of everolimus in patients with renal carcinoma
Everolimus is administered to patients with metastatic renal cell carcinoma in full daily dose of 10 mg or in reduced daily dose of 5 mg in case adverse effect occurred. These include metabolic adverse effects, mucositis, anorexia, and non-infectious pneumonitis and lead to increase in morbidity and decrease in the quality of life of the patient. Our goal was to evaluate the administration of fenofibrate and metformin in everolimus induced hypertriglyceridemia and hyperglycemia.
The role of mTOR in lipid and glucose metabolism was researched in literature. The effect of including fenofibrate and metformin into metabolic adverse effect management guidelines in metastatic renal cell carcinoma patients who are administered everolimus was evaluated.
Fenofibrate, metformin, and everolimus have several similar effects on intracellular level, therefore the effect of fenofibrate and metformin in treating everolimus induced metabolic adverse effects in metastatic renal cell carcinoma patients may be limited. The manifestation of metabolic adverse effects in patients treated with everolimus is not identical with metabolic syndrome or type II diabetes in standard population.
Keywords:
fenofibrate – everolimus – metabolic adverse effects – metformin – Renal cell carcinoma
Authors:
Jana Gregorová 1,2; Petra Holečková 3; Kateřina Žáková 1
Authors‘ workplace:
Oddělení klinické farmacie, Nemocnice Na Bulovce, Praha
1; Ústav aplikované farmacie, Farmaceutická fakulta VFU, Brno
2; Ústav radiační onkologie 1. LF UK a Nemocnice Na Bulovce, Praha
3
Published in:
Čas. Lék. čes. 2019; 158: 300-305
Category:
Original Article
Overview
Everolimus je podáván pacientům s metastatickým renálním karcinomem v dávce 10 mg/den nebo v redukované dávce 5 mg/den při výskytu nežádoucích účinků. Mezi ně patří zejména metabolické nežádoucí účinky, mukozitida, anorexie nebo neinfekční pneumonitida, jež vedou ke zvýšení morbidity a zhoršení kvality života nemocného. Cílem práce bylo zhodnocení podávání fenofibrátu a metforminu při výskytu hypertriglyceridemie a hyperglykemie navozené everolimem.
Literární rešerše byla zaměřena na roli mTOR v lipidovém a glukózovém metabolismu. Bylo provedeno zhodnocení zařazení fenofibrátu a metforminu do doporučených postupů k řešení metabolických nežádoucích účinků spojených s podáváním everolimu u pacientů s metastatickým renálním karcinomem. Fenofibrát, metformin a everolimus se překrývají v některých účincích na intracelulární úrovni. Vzhledem k tomu může být účinek fenofibrátu a metforminu při léčbě metabolických nežádoucích účinků vyvolaných everolimem u pacientů s metastatickým renálním karcinomem omezený. Stav, kdy se projeví metabolické nežádoucí účinky při terapii everolimem, není totožný s metabolickým syndromem nebo diabetem 2. typu u běžné populace.
V managementu hypertriglyceridemie a hyperglykemie navozené everolimem mají své místo kromě monitorování plazmatických hladin everolimu také fenofibrát a metformin, vzhledem k patofyziologii těchto nežádoucích účinků ovšem může být jejich efekt limitovaný.
Klíčová slova:
everolimus – metabolické nežádoucí účinky – fenofibrát – renální karcinom.
ÚVOD
Karcinom ledviny je nejčastějším primárním nádorem ledviny mimo ledvinnou pánvičku. Jeho výskyt v posledních 10 letech ve vyspělých zemích světa roste pomalým, ale stabilním tempem. 5leté přežití u pacientů s metastatickým renálním karcinomem (mRCC) činí pouze 5–15 % (1). Nejčastějším histologickým typem RCC je světlobuněčný karcinom, u 25 % pacientů je diagnostikován histologicky jiný typ.
Everolimus, analog rapamycinu, má antiproliferativní účinek, kterého se využívá nejen v transplantologii ke snížení proliferace lymfocytů, ale také v onkologii k ovlivnění proliferace nádorových buněk. V březnu 2009 americký Úřad pro kontrolu léčiv a potravin (FDA) schválil everolimus pro léčbu mRCC, který progredoval při terapii inhibitorem tyrosinkinázy.
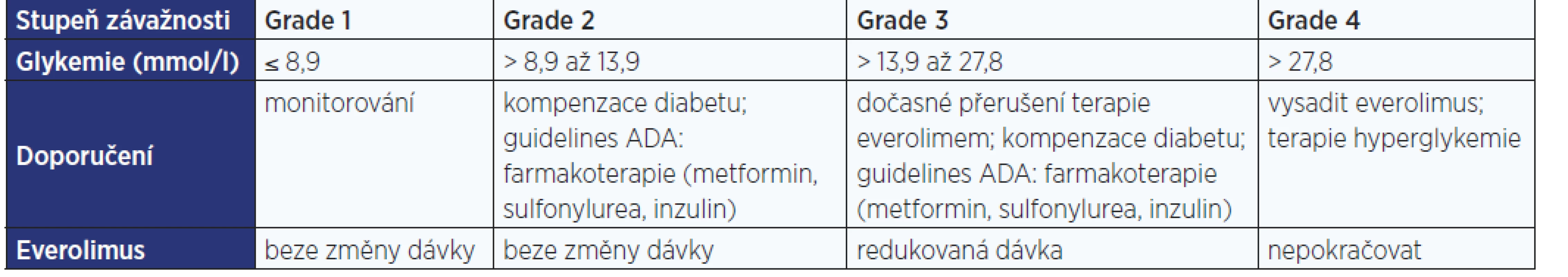
Everolimus stejně jako ostatní inhibitory mTOR (savčího rapamycinového cílového receptoru) vykazuje závažné vedlejší účinky. Ve studiích fáze III hodnotících everolimus u mRCC byla hypercholesterolemie, hypertriglyceridemie a hyperglykemie hlášena významně častěji u skupin léčených everolimem než ve skupinách s placebem (2). Incidence metabolických nežádoucích příhod u pacientů s mRCC zaznamenaných ve studiích fáze III byla následující: hypercholesterolemie 76 %, hypertriglyceridemie 71 %, hyperglykemie 57 % (3–5). Většina těchto nežádoucích příhod byla mírných, tedy stupně závažnosti 1–2 dle klasifikace CTCAE (Common Terminology Criteria for Adverse Events) a může být řešena snížením dávky, případně podpůrnou terapií. Závažnější nežádoucí příhody stupně 3–4 vedou k přerušení či ukončení léčby.
Ovlivnění lipidového a glukózového metabolismu everolimem je velmi komplexní a doporučené postupy k jejich řešení zahrnují také podávání fenofibrátu a metforminu, tedy léčiv primárně určených pro pacienty s metabolickým syndromem a diabetem 2. typu, nikoli s mRCC.
Cílem práce bylo zhodnocení potenciálu fenofibrátu a metforminu v řešení metabolických nežádoucích účinků everolimu u pacientů s mRCC.
METODIKA
Byla provedena literární rešerše zaměřená na roli mTOR v lipidovém a glukózovém metabolismu. Na základě vybraných klíčových slov (mTOR, everolimus, lipid metabolism, glucose metabolism, fenofibrate, metformin, PPAR, adverse event) byly v databázi PubMed vyhledány články vztahující se k dané problematice a prostudovány jejich fulltexty. Zaměřily jsme se na kritické zhodnocení současných doporučených postupů k řešení metabolických nežádoucích účinků everolimu u pacientů s mRCC a na vhodnost použití fenofibrátu a metforminu v těchto případech.
VÝSLEDNÁ ZJIŠTĚNÍ
Místo mTOR v lipidovém metabolismu
Lipidy jsou důležité strukturální molekuly, které tvoří podstatnou část plazmatických membrán a subcelulárních organel, působí jako signalizační molekuly jak v buňce (fosfoinositidy), tak na úrovni celého organismu (např. steroidní hormony), jsou důležitým zdrojem energie hlavně ve formě triglyceridů (TAG) uložených v adipocytech a jsou alternativou glukózy v katabolickém metabolismu. Důležitým rysem metabolismu nádorových buněk je zvýšení syntézy lipidů, které jsou mimo jiné důležité pro dostatečnou tvorbu jejich membrán (6, 7).
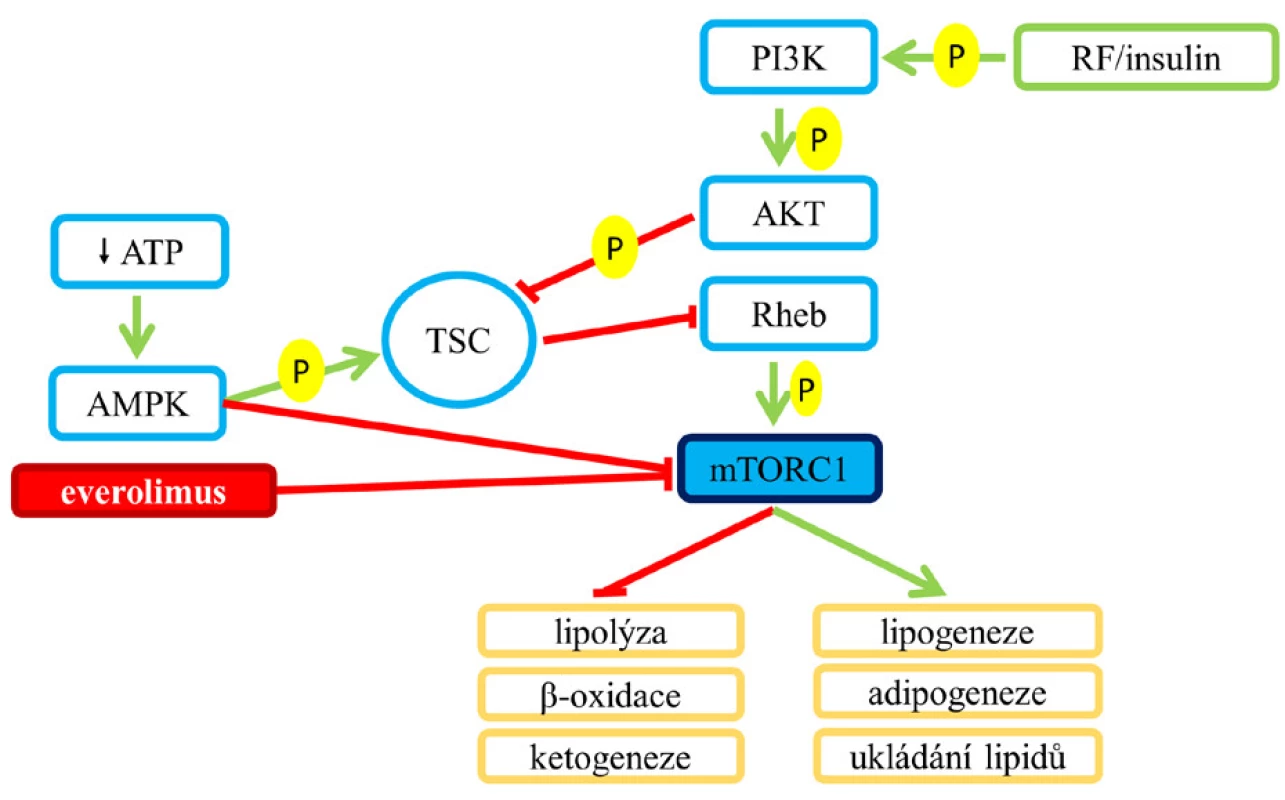
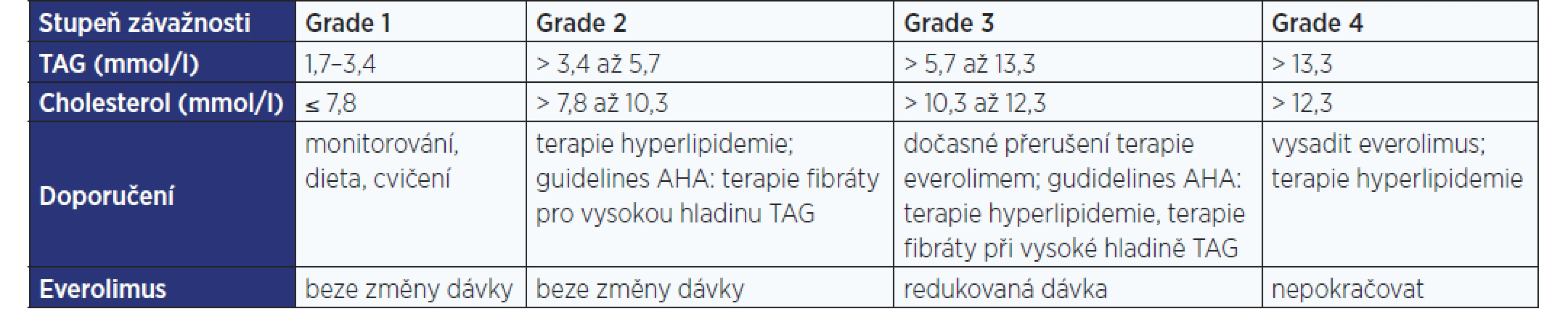
mTORC1 (mTOR komplex 1) kontroluje lipidový metabolismus na několika úrovních. Regulovány jsou lipogeneze, adipogeneze, transport lipidů a jejich ukládání do tukové tkáně, dále je jím kontrolována lipolýza, β-oxidace mastných kyselin a ketogeneze (8) (viz obr. 1).
Po jídle dochází v organismu ke zvýšení plazmatických hladin glukózy a inzulinu, který ovlivněním membránových receptorů vede k aktivaci hlavní intracelulární dráhy PI3K/Akt/mTORC1 a následné regulaci dvou klíčových efektorů této dráhy: S6K (ribosomová p70S6 kináza) a eIF4E (eukaryotický iniciační faktor 4E) (6, 7). mTORC1 také reguluje aktivitu fosfatázy lipinu 1 a některých transkripčních faktorů, například PPARα a PPARγ (α a γ receptory aktivované proliferátory peroxisomů) zapojených do lipidového metabolismu; jejich funkce bude podrobněji vysvětlena dále.
Aktivace mTORC1, ke které přechodně dochází po jídle, vede k přesunu glukózy do tukových zásob, základem tohoto procesu je tedy stimulace anabolických pochodů, jakými jsou lipogeneze, adipogeneze, transport lipidů a jejich ukládání do tukové tkáně. Naopak je tlumena lipolýza, β-oxidace mastných kyselin a ketogeneze (obr. 1).
Lipogeneze
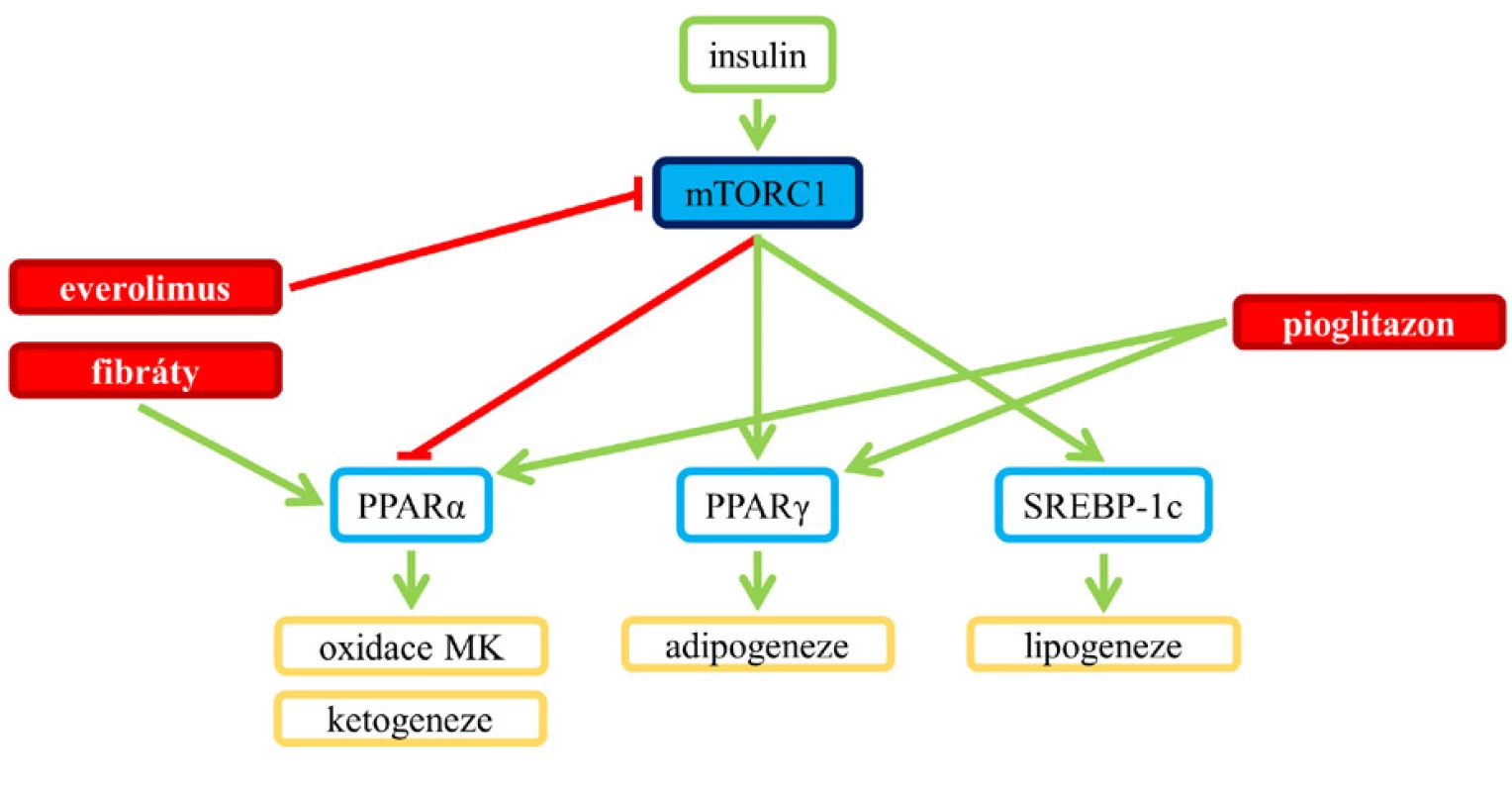
Studie ukazují, že aktivace mTORC1 podporuje lipogenezi prostřednictvím regulace transkripčních faktorů – SREBP (proteinu vážícího se na sterol‑regulující element), jež regulují homeostázu lipidů kontrolou exprese genů důležitých pro syntézu cholesterolu, mastných kyselin, triglyceridů a fosfolipidů (9) (obr. 2). SREBP jsou umístěny ve vázané formě v membráně endoplazmatického retikula, jejich uvolnění a štěpení je iniciováno buď nízkou hladinou sterolu v buňce (SREBP-2), nebo inzulinem (SREBP-1c) (6, 7).
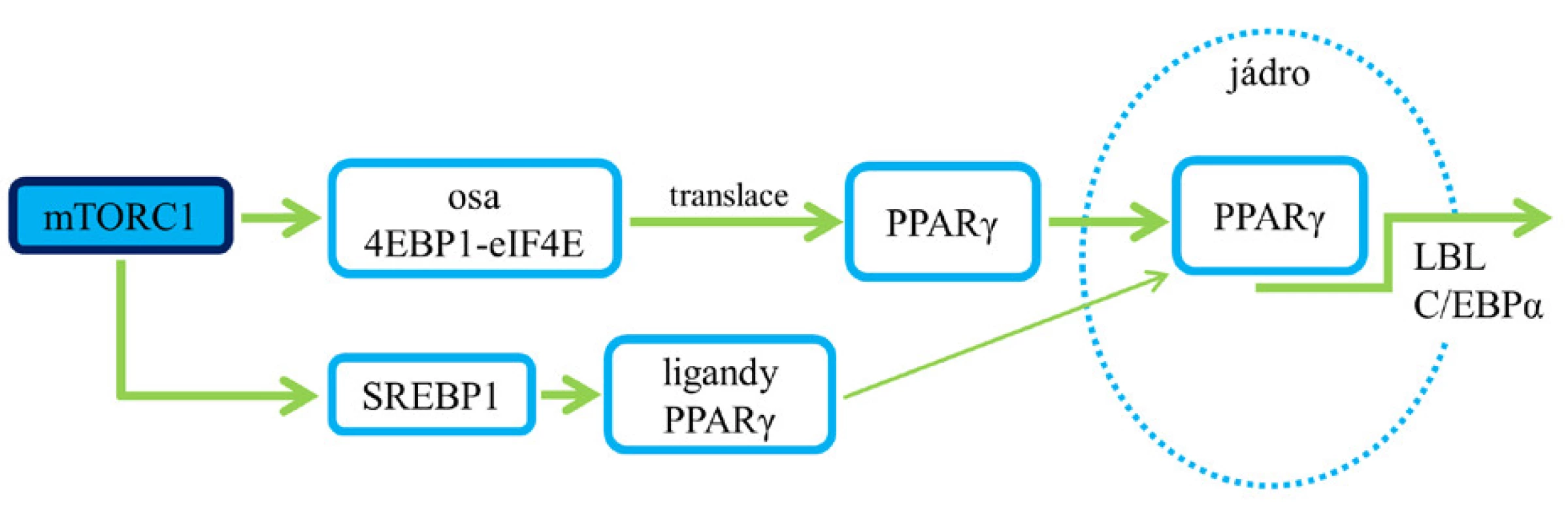
Aktivace mTORC1 zvyšuje transkripční aktivitu SREBP indukcí jejich translokace z membrány endoplazmatického retikula do Golgiho aparátu a rozštěpením, po kterém následuje uvolnění a přemístění jejich zralé formy do jádra, kde regulují genovou expresi. Za podmínek nízké mTOR aktivity se v jádře kumuluje fosfatáza lipin 1, která podporuje spojení SREBP s jadernou matrix, a oslabuje tak jejich schopnost vázat se s cílovými geny. Tento efekt je pak blokován aktivací mTORC1, která lipin 1 fosforyluje (6, 7).
Výsledkem aktivace mTORC1 a následného ovlivnění SREBP-1c je exprese enzymů, jež jsou zapojené do lipogeneze – ACC (acetyl-CoA karboxyláza), FAS (syntáza mastných kyselin), SCD (stearoyl-CoA desaturáza) a HMGCR (hydroxymethylglutaryl-CoA reduktáza) (8). Oslabení aktivity mTORC1 rapamycinem blokuje SREBP-1c indukovanou expresi lipogenetických enzymů (2).
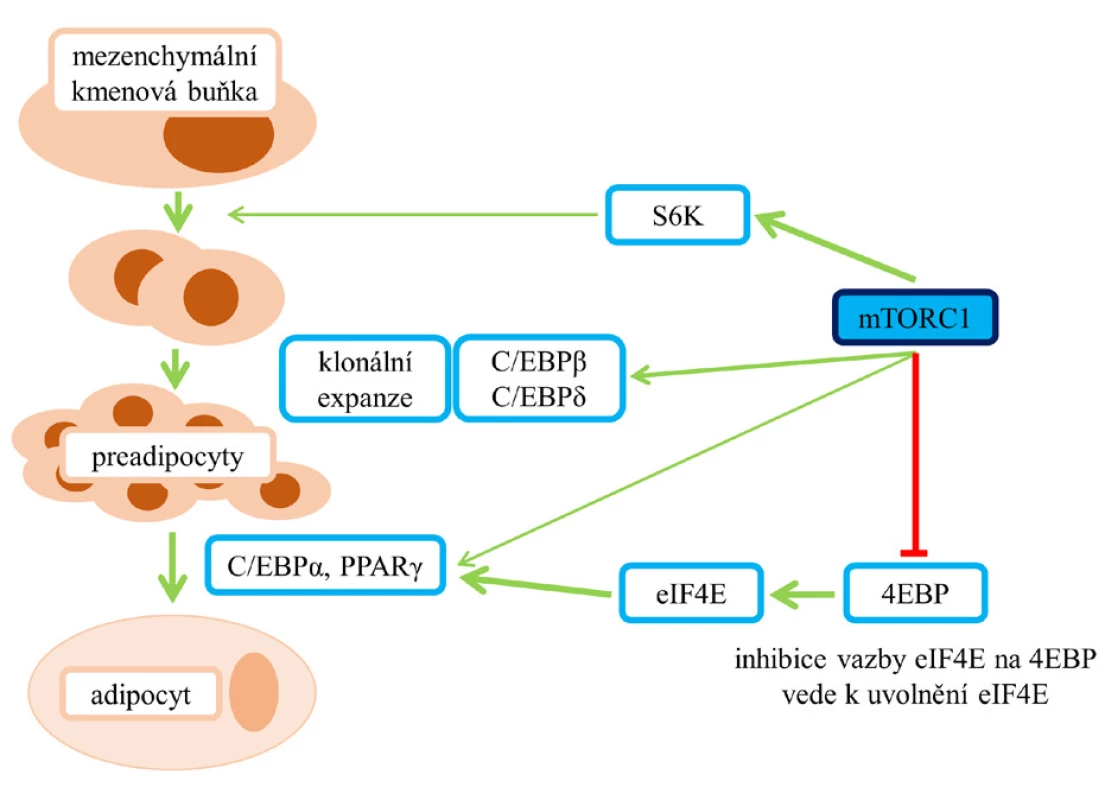
Adipogeneze
Závislost adipogeneze na aktivaci mTOR ukazují obr. 3 a 4 (8). Tento biologický proces vede k tvorbě zralých adipocytů z mezenchymových kmenových buněk, prekurzorů tukových buněk, a je řízen prostřednictvím transkripčních faktorů – C/EBP (CAAT/enhancer vázající protein) a PPARγ. Transkripční faktory C/EBPβ a C/EBPδ ovlivňují klonální expanzi preadipocytů, C/EBPα a PPARγ pak terminální diferenciaci a vznik adipocytů (8). Fosforylace 4EBP (eukaryotického iniciačního faktoru 4E [eIF4E] vázajícího protein), tedy inhibice vazby a následné uvolnění eIF4E, vede ke zvýšení translace C/EBPα a indukci exprese PPARγ (6, 7). Při léčbě rapamycinem dochází v různých modelech buněčných kultur k blokádě adipogeneze (6, 7).
Transport lipidů a jejich ukládání do tukové tkáně
TAG a cholesterol syntetizované v játrech jsou s apoproteiny uvolňovány do oběhu ve formě lipoproteinů o velmi nízké hustotě (VLDL). mTORC1 se podílí na kontrole extracelulární lipoproteinové lipázy (LPL), ve vodě rozpustné lipázy přítomné v plazmě a na povrchu endotelových buněk, a to především ve svalové a tukové tkáni. Inzulin zvyšuje její aktivitu, zatímco rapamycin ji naopak snižuje (2). LPL hydrolyzuje TAG v cirkulujících VLDL a podporuje konverzi na intermediální lipoproteiny (IDL) a lipoproteiny o nízké hustotě (LDL), což usnadňuje vychytávání lipoproteinů v tkáních (8).
Aktivace mTORC1 vede ke zvýšení exprese receptorů pro LDL (LDLR) (2). U pacientů po transplantaci ledviny na terapii sirolimem byl popsán 68% pokles LDL katabolismu (2).
Lipolýza a β-oxidace mastných kyselin
Přestože molekulární mechanismy regulace lipolýzy nejsou plně objasněny, bylo zjištěno, že aktivovaná mTORC1 blokuje v adipocytech a hepatocytech lipolýzu a β-oxidaci mastných kyselin a přispívá k ukládání TAG uvolněných jednak z jater, jednak vyrobených de novo v adipocytech (8). V těchto situacích je blokována aktivita ATGL (adipózní triacylglycerolové lipázy), která v adipocytech katalyzuje lipolýzu triglyceridů na diacylglyceridy (DAG), a také aktivita HSL (hormon-sensitivní lipázy), jež převádí DAG na monoacylglyceroly (8). In vitro studie ukázaly, že inhibice mTOR rapamycinem zvyšuje β-oxidaci mastných kyselin v hepatocytech a kosterních svalech (2). U pacientů po transplantaci ledviny indukuje léčba sirolimem zvýšení volných mastných kyselin o 42 %, což svědčí o jejich uvolňování z tukové tkáně v důsledku snížení inhibice HSL (2).
Ketogeneze
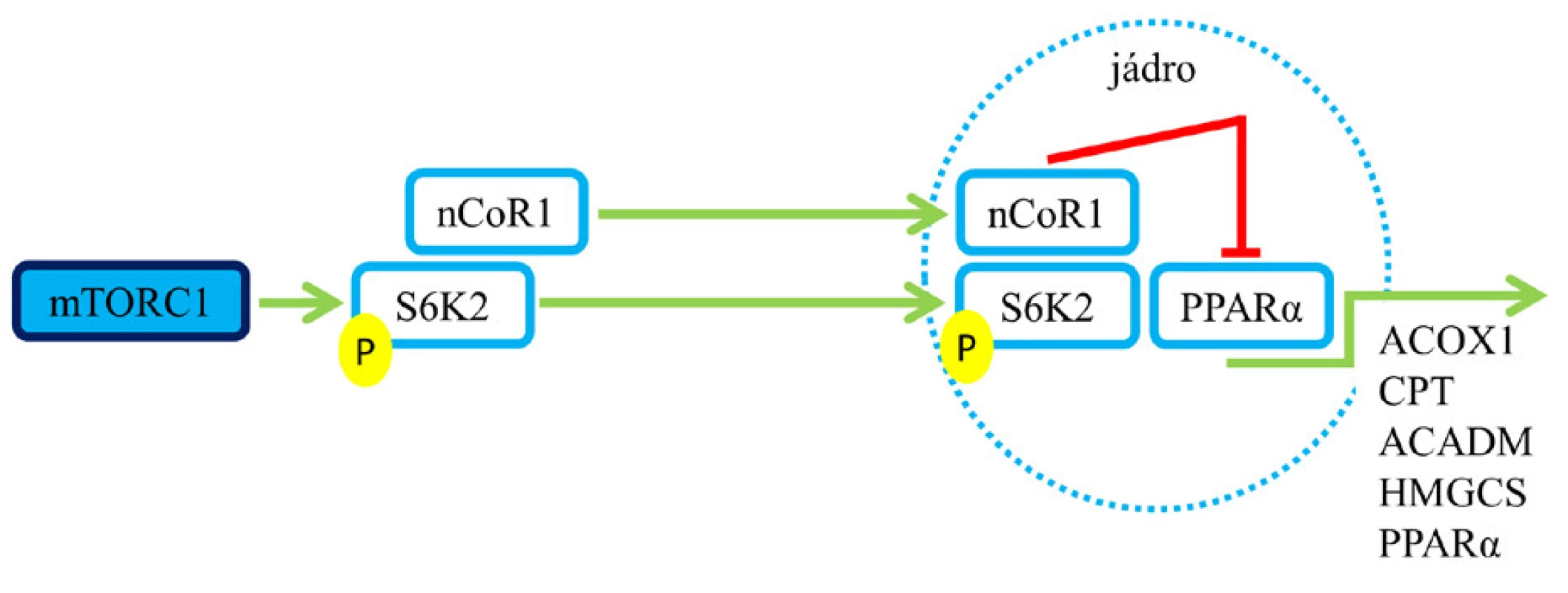
Ketolátky (acetoacetát, β-hydroxybutyrát) jsou při hladovění využívány srdečním a příčně pruhovaným svalem i mozkem jako energetický substrát. Zdá se, že aktivace mTORC1 vede k potlačení exprese enzymů zapojených do procesu ketogeneze regulací nCoR1 (jaderného receptoru korepresoru 1) a PPARα způsobem, který je pravděpodobně závislý na S6K2 (viz obr. 5). Tyto inhibiční účinky na PPARα a jejich transkripční cíle, jako jsou ACOX1 (acyl-CoA oxidáza 1), CPT (karnitinpalmitoyltransferáza), ACADM (gen pro acyl-CoA dehydrogenázu mastných kyselin se středně dlouhým řetězcem) a další, mohou vysvětlit negativní regulaci oxidace mastných kyselin. Represe β-oxidace a ketogeneze pravděpodobně působí společně se stimulací lipogeneze a s podporou toku acetyl-CoA směrem k syntéze a ukládání lipidů (8).
Zařazení fibrátů do managementu nežádoucích účinků everolimu
Pacienti užívající inhibitory mTOR mají být monitorováni z důvodu možného výskytu nebo zhoršení hyperlipidemie. Pokud se objeví, doporučují se úprava stravy, cvičení a léčiva snižující hladinu lipidů. Podávání fibrátů je zařazeno do současných doporučených postupů k řešení triglyceridemie, která je spojována s terapií everolimem (viz tab. 1). Zařazení fibrátů do těchto postupů vychází z jejich komplexního a pozitivního ovlivnění lipidového spektra u pacientů s metabolickým syndromem a diabetem 2. typu. Přesný mechanismus účinku fenofibrátu však není dosud plně objasněn.
PPAR jsou specifické receptory v buněčném jádře, mají funkci transkripčních faktorů a regulují expresi některých genů zasahujících do metabolismu lipidů a lipoproteinů.
PPARα jsou aktivovány mastnými kyselinami a fibráty, výsledkem této aktivace je řada metabolických efektů:
- Útlum syntézy apoproteinu CIII, který je inhibitorem LPL zodpovědné za odbourávání VLDL. Výsledkem je urychlený proces degradace VLDL a snížení koncentrace triglyceridů.
- Zvýšená syntéza LPL, která je lokalizována v krevních kapilárách hlavně svalové a tukové tkáně. Výsledkem je zrychlené odbourávání VLDL v krvi.
- Syntéza menších částic VLDL s menším obsahem apoproteinu CIII a triglyceridů.
- Zahájení procesu zpětného transportu cholesterolu z periferních tkání, exprese apoproteinu AI, základem částic HDL, které na sebe v krvi váží volný cholesterol.
- Aktivace genu pro zvýšení syntézy transportéru, který zprostředkuje přenos cholesterolu z nitra buněk periferních tkání přes buněčnou membránu a jeho navázání na částice nesoucí apoprotein AI (na částice HDL).
- Aktivace genu pro receptor, který na povrchu hepatocytů váže částce HDL nesoucího cholesterol z periferních tkání (10, 11).
Všechny tyto účinky fibrátů se velmi dobře uplatní především u nemocných s metabolickým syndromem, pro něž je charakteristická tzv. lipidová triáda – zvýšená hladina triglyceridů, nízká koncentrace HDL a zvýšená tvorba malých aterogenních LDL.
V poslední době se ukázalo, že hladina PPARα a jejich transkripční aktivita je blokována aktivitou mTORC1 (12). V jaterních buňkách byla u myší nalačno pozorována velmi nízká aktivita mTORC1 ve srovnání se stavem po jídle, ale současně byla přítomná vysoká hladina PPARα a vysoká exprese jejich cílových genů (12). Vysoká hladina PPARγ a vysoká exprese jejich cílových genů je naopak spojována s vysokou aktivitou mTORC1 (12). Afinitu k PPARγ mají některé thiazolidindiony (glitazony), především pioglitazon, který ovlivňuje jak PPARγ, tak PPARα. Inhibicí mTORC1 dochází ke zvýšení hladiny PPARα a jejich transkripční aktivity, podobně působí fibráty – výsledkem je aktivace oxidace mastných kyselin a ketogeneze. Aktivace PPARα podněcuje fosforylaci AMPK, její aktivace vede k inhibici mTORC1 (11, 13). Rozdílné ovlivnění PPARα a PPARγ aktivovanou mTORC1 a začlenění fibrátů do tohoto procesu ukazuje obr. 6.
Je popisováno, že aktivace PPARα podněcuje fosforylaci AMP-dependentní proteinkinázy (AMPK), což u myší vede v jádře ke zvýšení hladiny transkripčních faktorů FOXO1 (forkhead box, podskupina „O“) a ke zvýšení exprese ATGL, klíčové lipázy, která hydrolyzuje TAG (13), což je podobný stav jako při terapii inhibitory mTOR.
Místo mTOR v metabolismu glukózy
Vliv mTORC1 na homeostázu glukózy je komplexní. V normálních buňkách je po stimulaci dráhy PI3K/Akt/mTORC1 růstovými faktory podporován anabolický program zahrnující zvýšenou glykolýzu a syntézu mastných kyselin, mezi regulační prvky patří i hypoxií indukovatelný faktor 1 (HIF-1) a SREBP (8) (viz obr. 7).
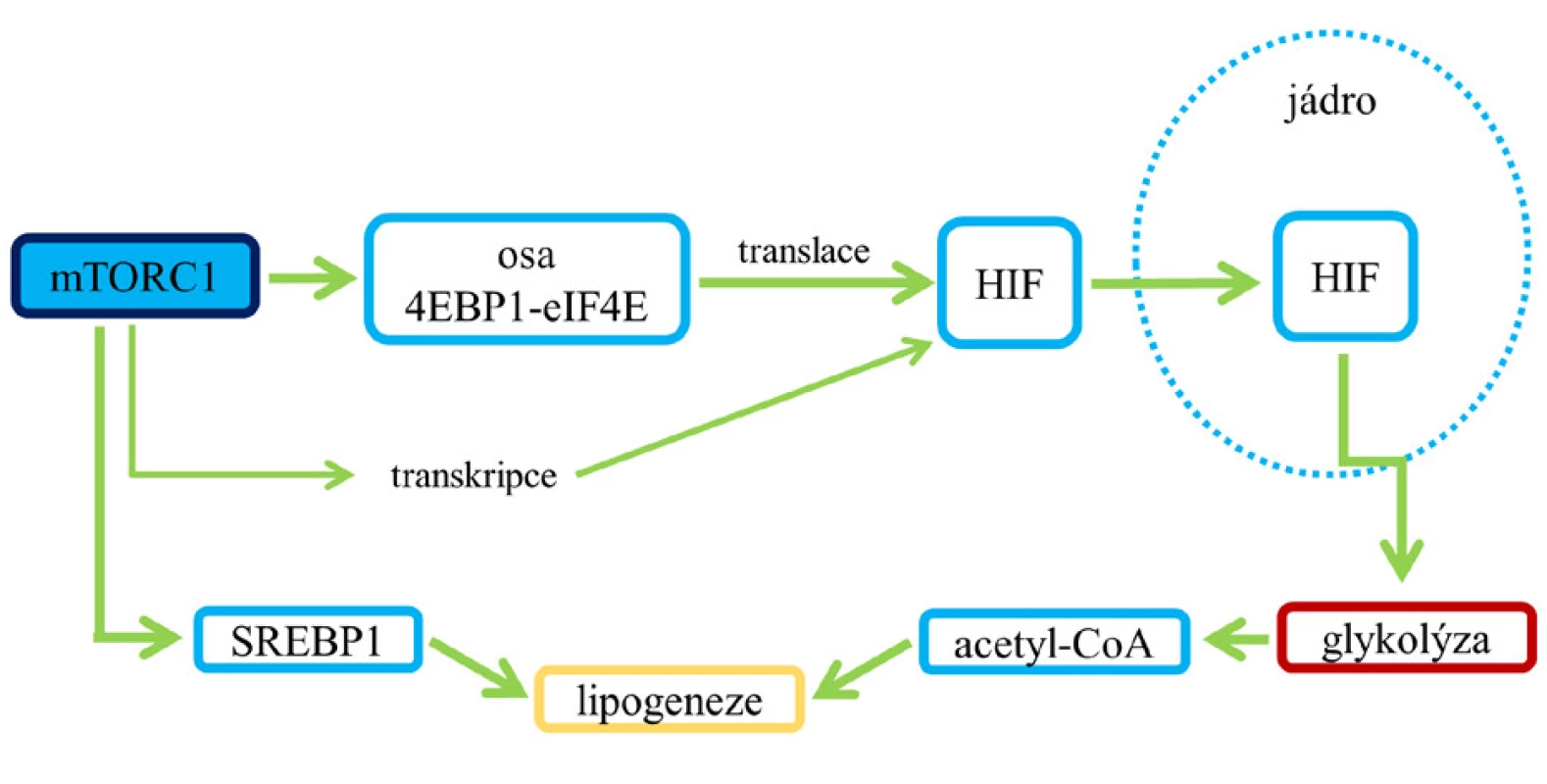
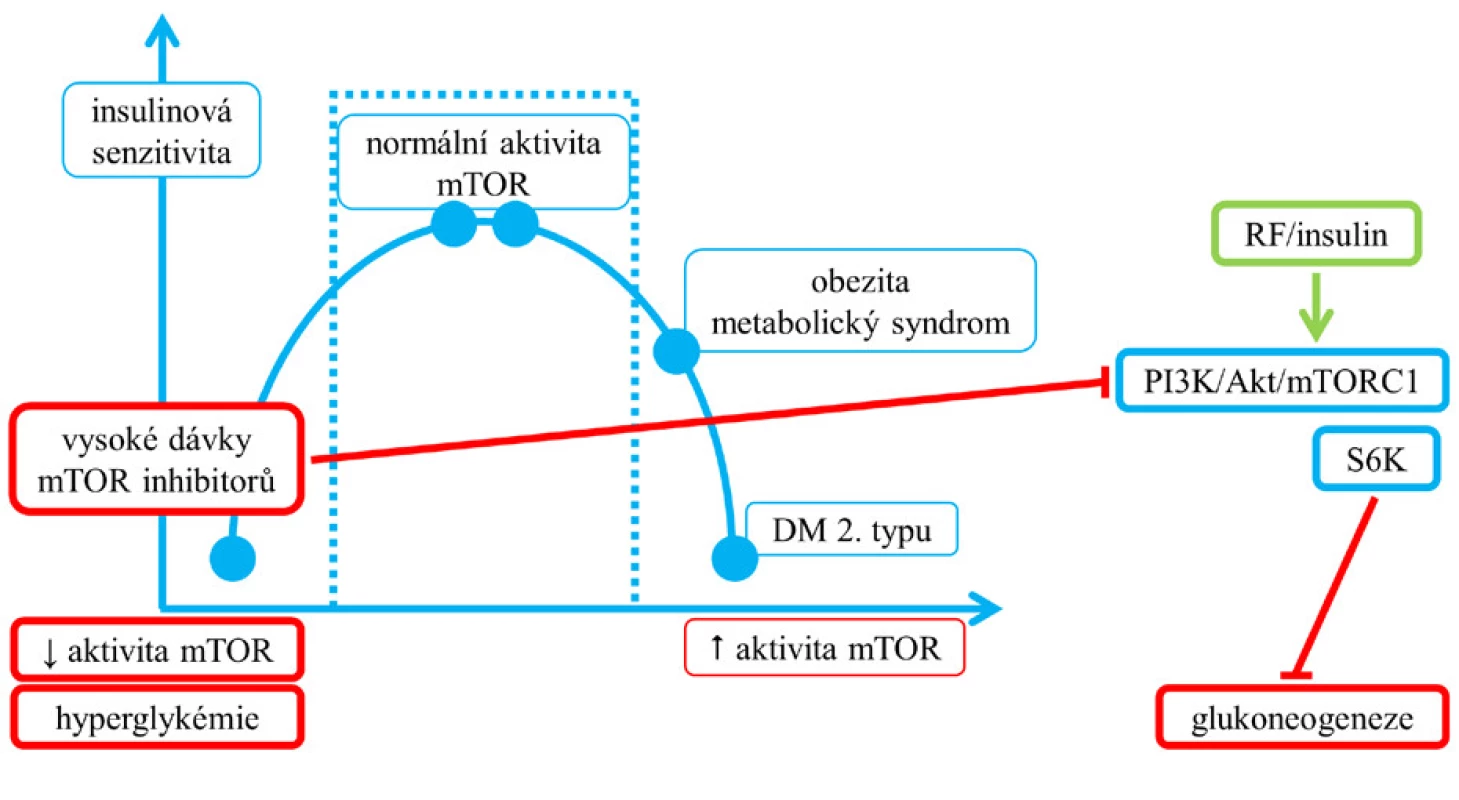
Při normálním příjmu potravy je aktivace mTORC1 v metabolických tkáních přechodná, ale za podmínek nadměrného příjmu energie u obezity a diabetu 2. typu může být chronicky zvýšená, pravděpodobně v podmínkách hyperglykemie a hyperinzulinemie dochází k rozvoji inzulinové rezistence (8). Předpokládá se, že vztah mezi aktivitou mTORC1 a senzitivitou tkání k inzulinu pravděpodobně sleduje křivku ve tvaru obráceného písmene U, kde příliš malá nebo příliš vysoká aktivita mTORC1 vede k inzulinové rezistenci (2) (viz obr. 8). V játrech vede fosforylace serinu IRS (substrát inzulinového receptoru) zprostředkovaná S6K1 k oslabení metabolické cesty PI3K/Akt, a tím podporuje glukoneogenezi (2). Aktivace mTORC1 v β-buňkách zvyšuje sekreci inzulinu a snižuje hladinu glukózy v krvi, trvalá aktivace mTORC1 v β-buňkách vede v konečném důsledku k vyčerpání jejich kapacity (2).
Zařazení metforminu do managementu nežádoucích účinků everolimu
V roce 2012 Americká diabetologická asociace a Evropská asociace pro studium diabetu poskytly praktické pokyny pro management diabetu 2. typu. Ačkoli tato doporučení nejsou přímo adresována pro diabetes mellitus, který se nově objevil u pacientů léčených inhibitory mTOR z důvodu nádoru nebo transplantace, strategie managementu je podobná pro všechny příčiny cukrovky (5). Jestliže se hyperglykemie vyvine i přes úpravu životosprávy, je jako 1. linie obvykle doporučován metformin (viz tab. 2). Avšak metformin je kontraindikovaný u pacientů s renální insuficiencí (odhadovaná glomerulární filtrace < 60 ml/min), s významným oslabením jaterních funkcí a u stavů, při kterých dochází ke snížení tkáňové perfuze (např. infarkt myokardu či sepse) (5).
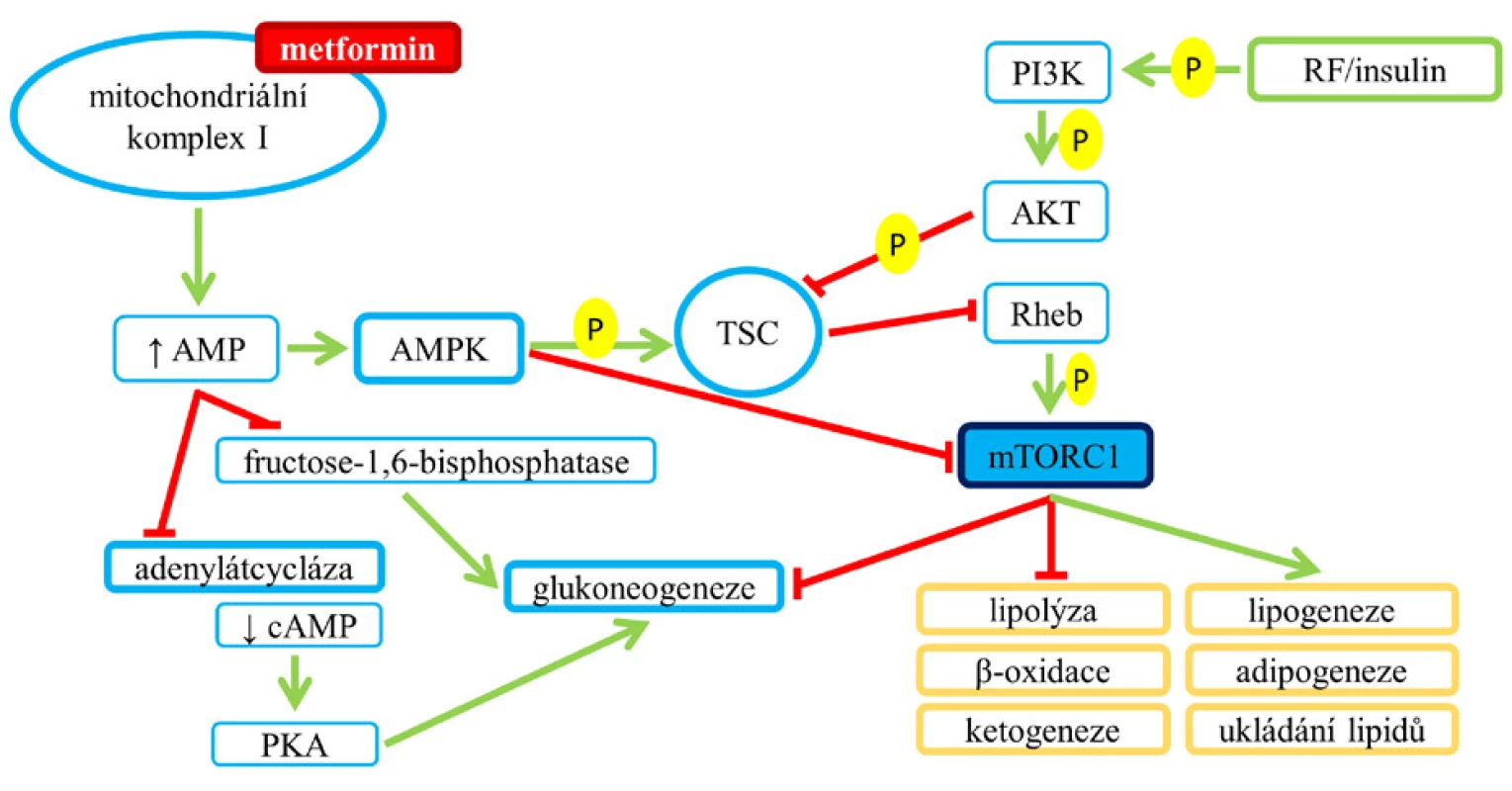
Metformin u pacientů s diabetem 2. typu zlepšuje homeostázu glukózy částečně inhibicí mTORC1 (5) a dále ovlivněním (zvýšením) intracelulární hladiny adenosinmonofosfátu (AMP), což vede k aktivaci AMPK a inhibici glukoneogeneze (blíže obr. 9).
DISKUSE
Metabolické nežádoucí účinky everolimu se vyskytují relativně často. Je ovlivněn jak lipidový, tak glukózový metabolismus. Patofyziologie dyslipidemie, hyperglykemie a inzulinové rezistence, jež vznikly v důsledku podávání mTOR inhibitorů, je odlišná od patofyziologie hyperlipidemie a inzulinové rezistence, které jsou důsledkem metabolického syndromu nebo provázejí diabetes 2. typu (2).
Doporučené postupy pracují s mírněním symptomů pomocí režimových opatření, použitím konkomitantní farmakoterapie a úpravou dávky everolimu, ale bez znalosti jeho plazmatických koncentrací dosahovaných u konkrétního pacienta. Dyslipidemie, jež vznikla při terapii everolimem, je důsledkem inhibice mTORC1, a tedy odblokování na ni navazující lipolýzy a β-oxidace mastných kyselin, a zvýšené aktivity PPARα (13). Inhibice mTORC1 vede také k zablokování aktivity transkripčních faktorů SREBP a k negativní regulaci lipogeneze a adipogeneze (6). Současně je výrazně snížená periferní clearance lipidů (2).
V doporučených postupech je u hypertriglyceridemie navozené everolimem léčivem volby fenofibrát (14), který působí jako agonista PPARα. V dalších studiích je třeba odpovědět na otázku, jak se uplatní efekt fenofibrátu a jím navozená aktivace PPARα, pokud již dochází k aktivaci těchto receptorů v důsledku inhibice mTOR everolimem, nebo zda se na ovlivnění hyperlipidemie fenofibrátem podílejí ještě další mechanismy účinku.
U metabolického syndromu a diabetu 2. typu je pozorována inzulinová rezistence, která je důsledkem nadměrné trvalé aktivace mTORC1 (2). Patofyziologie hyperglykemie, jež vzniká při terapii everolimem, je naopak důsledkem inhibice mTORC1, tedy aktivace glukoneogeneze a snížení sekrece inzulinu (2, 9). Metformin také inhibuje mTORC1, ale má další účinky na ní nezávislé – jedním z nich je inhibice glukoneogeneze (15). Z výše uvedeného vyplývá, že – při respektování kontraindikací – metformin patří do doporučených postupů k řešení hyperglykemie navozené everolimem.
Je třeba mít na paměti dvě skutečnosti: Zaprvé se everolimus s fenofibrátem a metforminem alespoň částečně překrývají ve svých farmakodynamických účincích, v inhibici mTORC1, proto může být jejich efekt u dyslipidemie a hyperglykemie způsobené everolimem limitovaný a může mít jiný dopad než u metabolického syndromu nebo diabetu 2. typu. Zadruhé pacienti s mRCC mohou, ale také nemusejí současně trpět metabolickým syndromem nebo diabetem 2. typu, a tudíž mohou, ale také nemusejí chronicky užívat metformin a/nebo fenofibrát. Everolimus pak může mít u těchto populací odlišný dopad na lipidový a glukózový metabolismus.
Monitorování koncentrací everolimu se rutinně používá ke zlepšení účinnosti a bezpečnosti terapie v transplantologii a je třeba říci, že podobný přístup by byl žádoucí i v onkologii (16).
Měření plazmatických koncentrací everolimu u pacientů s mRCC by mohlo být vhodné jako součást správného managementu nežádoucích účinků.
Podání metforminu a fenofibrátu při výskytu hyperglykemie a hypertriglyceridemie – při respektování jejich kontraindikací – je možné, jen mohou mít vzhledem k částečně společnému farmakodynamickému účinku s everolimem limitovaný efekt.
Prohlášení o střetu zájmů
Prohlašujeme, že nám nejsou známy žádné střety zájmů spojené s touto publikací a že nedošlo k žádné finanční podpoře, která by mohla ovlivnit její výsledek.
Seznam použitých zkratek
- 4EBP eukaryotický iniciační faktor 4E (eIF4E) vázající protein
- ACADM gen pro acyl-CoA dehydrogenázu mastných kyselin se středně dlouhým řetězcem
- ACC acetyl-CoA karboxyláza
- ACOX1 acyl-CoA oxidáza 1
- AHA American Heart Association
- AKT proteinkináza B
- AMP adenosinmonofosfát
- AMPK AMP-dependentní proteinkináza
- ATGL adipózní triacylglycerolová lipáza
- ATP adenosintrifosfát
- C/EBP CAAT/enhancer vázající protein
- CPT karnitinpalmitoyltransferáza
- CTCAE Common Terminology Criteria for Adverse Events
- DAG diacylglyceridy
- eIF4E eukaryotický iniciační faktor 4E
- FAS syntáza mastných kyselin
- FDA Úřad pro kontrolu potravin a léčiv (Food and Drug Administration)
- FOXO forkhead box, podskupina „O“
- HIF-1 hypoxií indukovatelný faktor 1
- HMG hydroxymethylglutaryl
- HMGCR hydroxymethylglutaryl-CoA reduktáza
- HMGCS hydroxymethylglutaryl-CoA syntáza
- HSL hormon-senzitivní lipáza
- CH cholesterol
- IDL intermediální lipoproteiny
- IRS substrát inzulinového receptoru
- LDL lipoproteiny o nízké hustotě
- LDLR receptor pro LDL
- LPL lipoproteinová lipáza
- mRCC metastatický renální karcinom
- mTOR savčí rapamycinový cílový receptor (mammalian target of rapamycin)
- mTORC komplex mTOR
- nCoR1 jaderný receptor korepresor 1
- PI3K fosfatidylinositol-3-kináza
- PPAR receptor aktivovaný proliferátory peroxisomů
- Raptor regulační protein asociovaný s mTOR
- Rheb obohacený homolog Ras v mozku
- S6K ribosomová p70S6 kináza
- SCD stearoyl-CoA desaturáza
- SREBP protein vážící se na sterol-regulující element (sterol regulatory element binding protein)
- TAG triglyceridy
- TSC komplex tuberózní sklerózy
- VLDL lipoproteiny o velmi nízké hustotě
Adresa pro korespondenci:
PharmDr. Jana Gregorová
Oddělení klinické farmacie
Nemocnice Na Bulovce
Budínova 67/2, 180 81 Praha
Tel.: 266 084 104
e-mail: jana.gregorova@bulovka.cz
Sources
- Li S, Kong Y, Si L et al. Phosphorylation of mTOR and S6RP predicts the efficacy of everolimus in patients with metastatic renal cell carcinoma. BMC Cancer 2014; 14 : 376.
- Vergés B, Walter T, Cariou B. Endocrine side effects of anti-cancer drugs: effects of anti-cancer targeted therapies on lipid and glucose metabolism. Eur J Endocrinol 2014; 170 : 43–55.
- Barthélémy P, Hoch B, Chevreau C et al. mTOR inhibitors in advanced renal cell carcinomas: from biology to clinical practice. Crit Rev Oncol Hematol 2013; 88 : 42–56.
- Aapro M, Andre F, Blackwell K et al. Adverse event management in patients with advanced cancer receiving oral everolimus: focus on breast cancer. Ann Oncol 2014; 25 : 763−773.
- Kaplan B, Qazi Y, Wellen JR. Strategies for the management of adverse events associated with mTOR inhibitors. Transplant Rev (Orlando) 2014; 28: 126–133.
- Laplante M, Sabatini DM. An emerging role of mTOR in lipid biosynthesis. Curr Biol 2009; 19(22): 1046−1052.
- Laplante M, Sabatini DM. Regulation of mTORC1 and its impact on gene expression at a glance. J Cell Sci 2013; 126 : 1713–1719.
- Ricoult S, Manning BD. The multifaceted role of mTORC1 in the control of lipid metabolism. EMBO Rep 2013; 14 : 242–251.
- Chen WL, Chen YL, Chiang YM et al. Fenofibrate lowers lipid accumulation in myotubes by modulating the PPARα/AMPK/FoxO1/ATGL pathway. Biochem Pharmacol 2012; 84 : 522–53.
- Kota BP, Huang TH, Roufogalis BD. An overview on biological mechanisms of PPARs. Pharmacol Res 2005; 51 : 85–94.
- Grabacka M, Pierzchalska M, Reiss K. Peroxisome proliferator activated receptor α ligands as anticancer drugs targeting mitochondrial metabolism. Curr Pharm Biotechnol 2013; 14(3): 342–356.
- Rui L. Energy metabolism in the liver. Compr Physiol 2014; 4(1): 177–197.
- Waickman AT, Powell JD. mTOR, metabolism, and the regulation of T-cell differentiation and function. Immunol Rev 2012; 249(1): 43–58.
- Peterson ME. Management of adverse events in patients with hormone receptor-positive breast cancer treated with everolimus: observations from a phase III clinical trial. Support Care Cancer 2013; 21 : 2341–2349.
- An H, He L. Current understanding of metformin effect on the control of hyperglycemia in diabetes. J Endocrinol 2016; 228, R97−R106.
- Widmer N, Bardin C, Chatelut E et al. Review of therapeutic drug monitoring of anticancer drugs part two – targeted therapies. Eur J Cancer 2014; 50 : 2020−2036.
Labels
Addictology Allergology and clinical immunology Angiology Audiology Clinical biochemistry Dermatology & STDs Paediatric gastroenterology Paediatric surgery Paediatric cardiology Paediatric neurology Paediatric ENT Paediatric psychiatry Paediatric rheumatology Diabetology Pharmacy Vascular surgery Pain management Dental HygienistArticle was published in
Journal of Czech Physicians

- Advances in the Treatment of Myasthenia Gravis on the Horizon
- Possibilities of Using Metamizole in the Treatment of Acute Primary Headaches
- Metamizole vs. Tramadol in Postoperative Analgesia
- Metamizole at a Glance and in Practice – Effective Non-Opioid Analgesic for All Ages
- Spasmolytic Effect of Metamizole
-
All articles in this issue
- Klinická farmacie v České republice
- Vyplatí se bezpečná farmakoterapie?
- Specializační a kontinuální vzdělávání v oboru klinická farmacie
- Klinický farmaceut v pediatrii: možný přínos?
- Podání léčiv nutričními sondami: příklady, pracovní skupina
- Inhibitory protonové pumpy v praxi klinického farmaceuta
- Klinicky významné lékové interakce antiretrovirotik
- Altepláza v intrapleurální terapii: Co víme a nevíme?
- Management metabolických nežádoucích účinků everolimu u pacientů s renálním karcinomem
- Možnosti farmakologického ovlivnění singultu u pacientů v paliativní péči
- Kombinace mirtazapinu a paroxetinu: možná klinicky projevená interakce?
- Fatální Stevensův-Johnsonův syndrom: komplikace při hospitalizaci pacienta na gerontopsychiatrii a prostor pro multioborovou spolupráci
- Spánek a jeho poruchy v neurologii
- Specifika spánku u žen a jeho poruch
- Precizní psychiatrie – reálná možnost?
- Přednáškové večery spolku českých lékařů v Praze (BŘEZEN 2020)
- Význam spánkové medicíny v pediatrii
- Princip posuzování a uznávání nemocí z povolání v České republice
- Journal of Czech Physicians
- Journal archive
- Current issue
- About the journal
Most read in this issue
- Možnosti farmakologického ovlivnění singultu u pacientů v paliativní péči
- Altepláza v intrapleurální terapii: Co víme a nevíme?
- Spánek a jeho poruchy v neurologii
- Inhibitory protonové pumpy v praxi klinického farmaceuta
