-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Sto rokov alergénovej imunoterapie, prvý rok sublingválnej tabletovej formy Oralair
One hunfred years of allergen immunotherapy, first year in the form of sublingual tablets
Allergy is one of the most common chronic diseases in the world. Treatment with H1-antihistamines, antileukotrienes, beta-2-adrenergic receptor agonists and corticosteroids provide a temporary suppression of inflammatory mediators and immune cells and release the symptoms but doesn’t solve the cause of the disease. The only causal treatment which can reprogram the specific immunity from allergy to tolerance is allergen specific immunotherapy (ASIT).
The aim of ASIT is the induction of an immune-tolerant state in which allergen-specific T regulatory cells (Treg) play the main role. These Treg cells inhibit both Th1 and Th2 responses through the production of IL-10 and TGF-beta. A decrease in the IgE/IgG4 ratio has been observed which correlates with the clinical efficacy. ASIT involves repeated administration of stepwise increasing doses of the allergen given subcutaneously or orally / sublingually.
Sublingual immunotherapy takes advantage of an important physiological mechanism of oral mucosal tolerance. Draining lymph nodes represent specialized microenvironment favoring the induction of mucosal tolerance through the production of blocking IgG antibodies and the induction of T suppressive lymphocytes. Many EBM trials approved safety and effectiveness of SLIT. In the form of sublingual tablet makes the manipulation, dosage and compliance of patient more easier.Key words:
allergy, allergen tolerance, ASIT, SLIT.
Autoři: E. Pekarová; Gürtler L’.
Působiště autorů: Alergo-imunologická ambulancia, Banská Bystrica ; Prednosta: MUDr. Milan Kmeť, PhD. ; FNsP F. D. Roosevelta, Interná klinika
Vyšlo v časopise: Prakt. Lék. 2011; 91(9): 544-548
Kategorie: Public relations
Souhrn
Alergia je jedným z najčastejších chronických ochorení sveta. Liečba H1-antihistaminikami, antileukotriénmi, beta-2-mimetikami a kortikosteroidmi dočasne potlačí zápalové mediátory a imunitné bunky a uľaví od symptómov, ale nerieši základnú príčinu ochorenia. Jedinou kauzálnou liečbou, ktorá dokáže preprogramovať špecifickú imunitu z alergie na toleranciu je alergénová špecifická imunoterapia (ASIT).
Cieľom ASIT je navodenie stavu imunitnej tolerancie, v ktorom hlavnú úlohu zohrávajú alergén špecifické T regulačné bunky. Tieto inhibujú Th1 aj Th2 odpovede cez produkciu IL-10 a TGF-beta. Súčasne sa pozoruje pokles pomeru IgE/IgG4, čo koreluje s klinickou efektivitou. ASIT predstavuje opakované podávanie postupne sa zvyšujúcich dávok alergénu subkutánne alebo orálne / sublingválne.
Sublingválna imunoterapia (SLIT) využíva fyziologický mechanizmus orálnej slizničnej tolerancie. Drénujúce lymfatické uzliny predstavujú špecializované mikroprostredie indukujúce slizničnú toleranciu produkciou blokujúcich IgG protilátok a indukciou T supresívnych lymfocytov. Množstvo EBM štúdií dokázalo bezpečnosť a efektivitu SLIT. SLIT vo forme tabliet zlepšuje komfort, uľahčuje manipuláciu, dávkovanie a spoluprácu pacienta.Kľúčové slová:
alergia, alergénová tolerancia, ASIT, SLIT.Alergia
Alergia je jedným z najčastejších chronických ochorení vo svete. V rozvinutých krajinách sa odhaduje postihnutie u 10–25 % populácie. Charakteristické prejavy ochorenia sú:
- kýchanie,
- nosová kongescia,
- serózna sekrécia,
- svrbenie nosa, alebo podnebia,
- alergická konjunktivitída,
- opuchy.
Alergické prejavy a ich prevalencia sa vekom menia. Alergie na peľ sa prejavujú ako sezónna rhinokonjunktivitída, laicky nazývaná „senná nádcha“. U pacientov s alergickou nádchou je riziko rozvoja do astmy trikrát vyššie ako u bežnej populácie. Kompletné odstránenie, či vyhýbanie sa alergénu nie je možné.
V súčasnosti existuje niekoľko účinných skupín liekov:
- H1-antihistaminiká,
- antileukotriény,
- beta-2-mimetiká,
- kortikosteroidy,
ktoré sú schopné efektívne, ale len dočasne tlmiť symptómy. Nepredstavujú však kauzálnu liečbu.
ASIT je jediná terapia schopná zasiahnuť v mieste hlavnej príčiny alergickej reakcie, a to modifikáciou či utlmením aberantnej imunitnej odpovede.
Alergény indukujú alergickú či hypersenzitívnu odpoveď u atopických jedincov, čím vedú k produkcii vysokých koncentrácií alergén-špecifických IgE protilátok. Neatopickí jedinci produkujú primárne špecifické imunoglobulíny izotypu IgG s veľmi nízkymi hladinami izotypu IgE. Špecifické protilátky IgE, ktoré vznikli po prvom kontakte s alergénom, sa naviažu na vysokoafinitné Fc-epsilon receptory I na mastocytoch a bazofiloch (fáza senzibilizácie). Po následnej reexpozícii sa molekuly alergénu viažu na IgE naviazané na bunkách, premostia Fab receptory a výsledkom je uvoľnenie histamínu, leukotriénov a iných mediátorov a spustenie včasnej alergickej či dokonca systémovej anafylaktickej reakcie. Niekoľko hodín po expozícii alergénu nasleduje oneskorená fáza reakcie, ktorá pozostáva z infiltrácie postihnutého tkaniva zápalovými bunkami, ako sú lymfocyty a eozinofily. Pri chronickej reexpozícii alergénu prechádza neskorá fáza do chronického alergického zápalu.
V senzibilizačnej fáze alergény stimulujú klonálnu expanziu špecifických T a B buniek a produkciu špecifických protilátok. V závislosti od charakteru stimulu, sa naivné T bunky diferencujú do Th1,Th2, Th17 a Th9 efektorových buniek.
U alergikov je rovnováha posunutá na Th2 lymfocytárnu odpoveď s produkciou IL-4, IL-5, IL-13. IL-5 je eozinofilový rastový a diferenciačný faktor a IL-4 a IL-13 sú faktory, ktoré spôsobujú u B lymfocytov prešmyk z produkcie IgM na sekréciu IgE.
Väčšina produkcie protilátok prebieha v lymfatickom tkanive či kostnej dreni. Navyše dochádza k lokálnej produkcii IgE v inflamovaných slizničných miestach, ako sú pľúca, nos (2).
Diagnostika
Patrí do rúk špecialistu klinického imunológa a alergológa. Diagnostika alergických ochorení je komplexná. Vzniká analýzou údajov získaných z podrobnej anamnézy, fyzikálneho vyšetrenia a výsledkov laboratórnych vyšetrení.
História
Pred 100 rokmi, Leonard Noon a John Freeman publikovali pioniersku prácu o alergénovej špecifickej imunoterapii s extraktom peľu tráv.
Alergénová špecifická imunoterapia (tiež nesprávne nazývaná desenzibilizácia, hyposenzibilizácia, špecifická imunoterapia) je podávanie postupne a pomaly sa zvyšujúcich dávok príčinného alergénu v liečbe IgE-mediovaného alergického ochorenia, kým sa nedosiahne udržiavacia dávka, alebo je pacient zbavený symptómov (14).
Princíp ASIT použil už kráľ Mithridates VI (132-63 B.C) z Pontu, tiež nazývaný Eupator. V snahe ochrániť sa proti otráveniu, použil zvyšujúce sa dávky hadieho jedu s cieľom stať sa imúnny voči toxínu.
Ďalší spôsob ASIT započal Edward Jenner, ktorý použil vakcínu pravých kravských kiahní. Dunbar (1903) v Hamburgu použil koncept protektívnej imunity a vyvinul hyperimúnne sérum zo zvierat vakcinovaných peľovým extraktom, na liečbu sennej nádchy. Substanciu nazval „Pollantin“. V Mníchove a Berlíne A. Wolff-Eisner objavil, že spúšťačmi sennej nádchy sú proteíny v peľových zrnách. V Paríži, Alexander Besredka, v snahe neutralizovať hypersenzitivitu, injikoval zvieratám postupne sa zvyšujúce dávky riedených roztokov alergénov. Týmto bol schopný indukovať „toleranciu“ a procedúru nazval „vakcinácia anti-anaphylaxis“. Clemens von Pirquet pozoroval podobný fenomén navodenia tolerancie pri testovaní lokálnej kožnej reaktivity.
Scheppegrell (1909) podával v práškovej forme sušený peľ lokálne na sliznicu nosa pacientov so sennou nádchou (14). V roku 1911 mal Leonard Noon odvahu vyskúšať Besredkove experimenty na človeku. Na meranie efektu liečby, ktorú nazýval „ profylaktická inokulácia“, použil konjunktiválny provokačný test s kvapkami rôznych extraktov roztokov a vyhodnocoval začervenanie a zápalovú reakciu pred a po liečbe. Robert Cook, jeden z autorov termínu „atopia“ zaviedol túto liečbu do Spojených Štátov pod názvom „aktívna imunizácia“ a neskôr (1922) navrhol termín „hyposenzitizácia“ .
Už v roku 1911, Lambert, Ancel a Bouin použili orálnu aplikáciu antigénu a pozorovali fenomén prechodnej neodpovedavosti, ktorý nazvali „skeptophylaxia“. Po tom, ako Dale a Laidlaw ukázali, že hlavným mediátorom anafylaxie je histamín, nastúpili snahy o nešpecifickú hyposenzibilizáciu s použitím zmesi imunoglobulínu G a histamínového komplexu – Histaglobín. Injekčne, či inhalačne boli použité na nešpecifickú hyposenzibilizáciu aj mikrobiálne či bakteriálne lyzáty.
Prvú skutočnú klinickú štúdiu s alergén špecifickou imunoterapiou uskutočnil v roku 1950 William Frankland v Anglicku. V roku 1970 vznikol koncept alergoidov – chemická modifikácia alergénnych proteínov s použitím formaldehydu či glutaraldehydu, s cieľom znížiť alergénnosť, a tým nežiadúce vedľajšie reakcie pri zachovanej imunogenite.
Posledným objavom sú malé karbamylované alergoidy, ktoré sú rezistentné na natrávenie proteolytickými enzýmami pri sublingválnej imunoterapii.
V začiatkoch alergénovej imunoterapie boli používané hlavne vodné roztoky, neskôr depotné či semidepotné preparáty s adjuvanciami ako aluminiumhydroxid (Alum). V posledných rokoch sa používa tyrozín, kalciumfosfát, monofosforyl lipid (MPL), čo je derivát lipopolysacharidu (LPS) odvodeného z baktérie Salmonela Minnesota, ktorá stimuluje signály cez Toll-like receptor TLR4. Na predĺženie uvoľňovania alergénu sa používa naviazanie alergénu na chemicky modifikovaný MPL a absorbovaný na L-tyrozínové depo. Iný prístup používa alergény viazané na polyetylénglykol (PEG).
Od roku 1990 sa objavili nové modifikátory imunitnej odpovede, ktoré môžu byť kombinované s alergénom a modulujú Th2 imunitnú odpoveď. Zvlášť sú to CpG-oligonukleotidy, ktoré preukázali silnú polarizáciu k Th1 imunitnej odpovedi. Klasickou metódou aplikácie ASIT je subkutánne injekčné podanie. Skúšajú sa aj iné postupy – aplikácie cestou
- orálnou,
- nasálnou,
- rektálnou,
- epikutánnou (15),
- intradermálnou skarifikáciou, a
- priame injekčné podanie do lymfatických uzlín.
Po množstve kontrolovaných klinických štúdií so sublingválnou aplikáciou ASIT, bola táto uznaná za účinnú a bezpečnú. V súčasnosti sa používa ako preparáty vo forme roztoku alebo alergénových tabliet.
Princípy ASIT, imunologické mechanizmy
Alergénová tolerancia
je adaptácia imunitného systému charakterizovaná špecifickou nezápalovou reaktivitou voči danému alergénu, ktorá by za iných okolností indukovala bunkovú či humorálnu imunitnú odpoveď vedúci k zápalu či produkcii IgE. Pravdepodobne rovnaké mechanizmy sa zúčastňujú aj prevencie voči senzibilizácii na iné alergény.
Alergénová tolerancia je spojená s periférnou T-bunkovou toleranciou, ktorá je charakterizovaná hlavne vznikom alergén-špecifických regulačných T lymfocytov (Treg).
Existujú Treg prirodzene sa vyskytujúce, ktoré sa vyvýjajú v týmuse a sú prítomné pri narodení a indukovateľné Treg, ktoré vznikajú na periférii za rôznych tolerogénnych podmienok. ASIT indukuje Treg typ 1 (Tr1), ktoré produkujú IL-10. Produkcia cytokínov Treg bunkami varíruje v závislosti na rezidenčnom orgáne, mikroprostredí, ako aj na spôsobe, akým sú stimulované (7). Treg produkujú IL-10 a TGF-beta, ktoré suprimujú produkciu IgE a indukujú IgG4 a IgA. IL-10, aj TGF-beta priamo suprimujú alergický zápal indukovaný efektorovými bunkami, ako sú mastocyty, bazofily a eozinofily. Navyše Treg suprimujú Th2 a tieto nemôžu produkovať IL-4, IL-5 a IL-13, ktoré sú nevyhnutné na diferenciáciu, prežitie a aktivitu mastocytov, bazofilov, eozinofilov a hlien-produkujúcich buniek. Treg suprimujú aj Th1, Th17, Th22.
ASIT stimuluje aj autokrinnú aktivitu alergén-špecifických Treg buniek (7).
Po zahájení ASIT iniciálne stúpajú koncentrácie alergén-špecifického IgE a klesajú k hodnotám pred liečbou počas udržiavacej fázy. ASIT indukuje zvlášť alergén-špecifické protilátky typu IgG4, IgG1 10–100 násobne.
IgG4 má unikátne štrukturálne vlastnosti blokujúcich protilátok. Vďaka svojej pántovej oblasti má nižšiu afinitu k niektorým Fc receptorom. IgG4 môže dynamicky vymieňať Fab rameno a vytvárať tak bi-špecifické protilátky, ktoré sú funkčne monomérické a signifikantne znižujú možnosť väzby s alergénmi a zosilňujú alergén-blokujúcu aktivitu. IgG4 nespúšťa komplementovú kaskádu a je schopný inhibovať tvorbu imunitných komplexov s inými IgG subtypmi (8).
Počas ASIT klesá pomer IgE/IgG4 v priebehu týždňov; hladiny IgG4 stúpajú rádovo v týždňoch, signifikantný pokles IgE nastáva v priebehu rokov. Po úspešnej ASIT sú oslabené včasná aj neskorá fáza alergickej odpovede v koži, spojivkách, nosovej aj bronchiálnej sliznici a zvyšuje sa prah koncentrácie alergénu, ktorý je nevyhnutný k spusteniu alergickej reakcie v cieľovom tkanive. Navyše ASIT oslabuje aj množstvo a intenzitu reakcií na alergén-nešpecifickú stimuláciu (7).
Imunitné mechanizmy špecifickej sublingválnej imunoterapie
ASIT indukuje 3 kategórie imunologických zmien:
- moduláciu odpovedí alergén-špecifických protilátok,
- redukciu v rekruitmente, a
- aktivácii prozápalových buniek, zmeny v odpovediach špecifických T lymfocytov (10).
V množstve štúdií o mechanizmoch SLIT bol pozorovaný pokles pomeru IgE/IgG4. Tieto zmeny korelovali s celkovou klinickou efektivitou vakcíny. Tieto alergén-špecifické IgG a IgA protilátky súťažia s IgE o väzbu na alergén, a tým bránia degranulácii bazofilov a mastocytov, ako aj vychytávaniu alergénu a prezentácii T lymfocytov. Tieto protilátky sú aktívne aj ako blokujúce protilátky zapojením nízko afinitných Fc gama RII na B lymfocytoch, bazofiloch a mastocytoch. Fc gama RII obsahuje imunoreceptory s „tyrozin-based inhibičným motívom“ (ITIM), ktoré prevádzajú negatívne signály, tieto bránia aktivácii bunky a uvoľneniu solubilných prozápalových mediátorov po agregácii s Fc epsilon RI.
Antigén-špecifické T-bunky so supresívnou / regulačnou funkciou zohrávajú kľučovú úlohu pri kontrole imunitných reakcií voči vlastným aj cudzím antigénom. Tieto Treg bunky sú heterogénne a rozlišujú sa podľa povrchových znakov a produkovaných cytokínových vzorov (tab. 1). Treg bunky sú obyčajne anergické s nízkou spontánnou proliferáciou a sú závislé na exogénnom IL-2. Potláčajú Th1 aj Th2 imunitné odpovede, a to priamym kontaktom bunka-bunka, alebo produkciou imunosupresívnych cytokínov.
SLIT využíva dôležitý fyziologický mechanizmus (orálnu toleranciu), ktorý zabezpečuje toleranciu voči rôznorodým antigénnym stimulom z okolia, zvlášť z potravy a komenzálnych baktérií. Počas SLIT, je alergén zachytený lokálne na sliznici dendritickými bunkami (DC)(Langerhansove bunky) mechanizmom fagocytózy, makropinocytózy či receptor-mediovanou endocytózou. Následne DC dozrievajú a migrujú do proximálnych drenážnych lymfatických uzlín (LU) (submaxilárne, superficiálne cervikálne a interné jugulárne LU), ako následok zmien v expresii povrchových receptorov (CCR7 chemokínový receptor).
Tieto lymfatické uzliny predstavujú špecializované mikroprostredie preferujúce indukciu slizničnej tolerancie produkciou blokujúcich IgG protilátok a indukciou supresívnych T lymfocytov. Dôsledkom cirkulácie alergén-špecifických aktivovaných efektorových T buniek a pretrvávania účinku pamäťových buniek vyvoláva lokálne sublingválne podanie alergénu počas imunoterapie systémové aj slizničné protektívne imunitné odpovede. Langerhansove bunky orálnej sliznice konštitutívne exprimujú nízko aj vysoko afinitné receptory pre IgE. Po obsadení týchto receptorov produkujú IL-10, TGF-beta a zvyšujú účinok enzýmu indolamin 2-dioxygenáza (IDO), ktorý metabolizuje tryptofán, čím limitujú a znižujú proliferáciu T buniek.
Orálna sliznica obsahuje len málo mastocytov, eozinofilov a bazofilov a integrita lamina propria je kľúčová v limitácii kontaktu alergénov s týmito bunkami v submukóze či krvi. To vysvetľuje výborný bezpečnostný profil SLIT.
Pri protokole SLIT s prehltnutím vakcíny, vedie expozícia alergénu priamo s imunitným systémom gastrointestinálneho (GIT) traktu ku stimulácii Th3 odpovede. Napriek tomu, že tkanivo pod jazykom je vysoko vaskularizovaná sliznica, nedochádza k priamej absorpcii alergénu. Až po prehltnutí a kontakte so sliznicou GIT-u sa rádiofarmakom značený alergén distribuoval do krvi. Štúdie biodistribúcie potvrdili, že asi 20 % podanej dávky alergénu perzistuje 2 hodiny na sublingválnej sliznici, hoci si pacienti vypláchli ústa.
Konvenčné SLIT protokoly pozostávajú zo vzostupnej / iniciálnej fázy (postupné zvyšovanie dávky počas 2–4 týždňov) a udržiavacej dávky (podávanie maximálnej dávky roztoku 3x v týždni počas niekoľkých rokov). Počas takýchto imunizačných schém sa dokázalo zníženie prozápalových buniek a zvýšenie hladiny blokujúcich protilátok IgG ako aj produkcia IL-10 rýchlo (rádovo dni), ale efekt na bunkovú imunitu Th1, Th2 a adaptívnu imunitu rádovo v mesiacoch.
Efektivita na symptómy a spotrebu medikácie sa pozoruje najskôr po 1 roku terapie, s maximálnym prínosom až po 2 rokoch. Niektoré štúdie s rýchlym a ultra-rýchlym protokolom preukázali klinický účinok a zníženie kožnej reaktivity v priebehu týždňov či dokonca dní.
SLIT u detí s rinokonjunktivitídou na peľ tráv a roztoče sa osvedčilo aj v prevencii astmy ako aj nových senzibilizácií (9). SLIT vyžaduje 50–100 násobne vyššie dávky alergénu ako SCIT. Jedným z vysvetlení je aj použitie adjuvancií pri SCIT, ale nie pri SLIT. Pre úspech SLIT je dôležité dosiahnutie hraničnej kumulatívnej dávky alergénu.
Tab. 1. Charakteristiky T regulačných buniek (10): 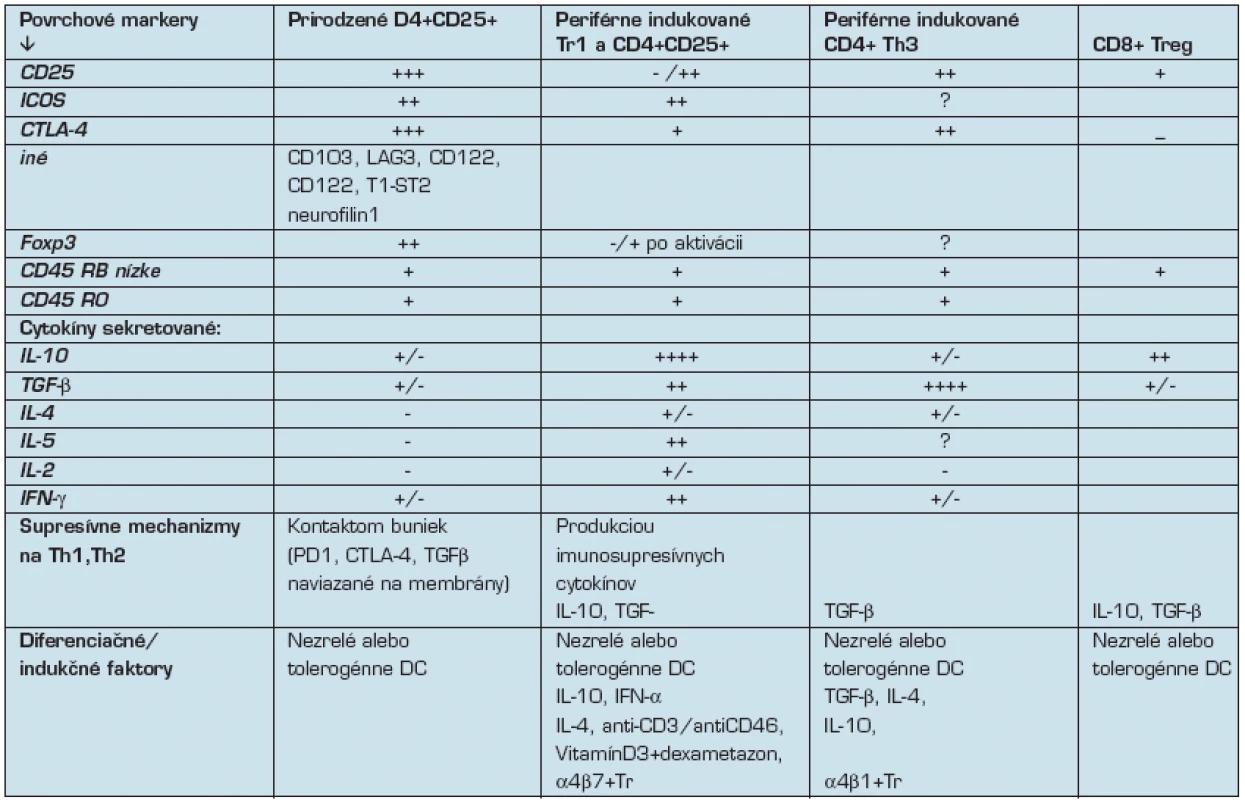
Tab. 2. Predpokladané mechanizmy ASIT (2, 5, 14): 
Tab. 3. Pri indikácii na ASIT by mali byť splnené tieto podmienky (3, 5) 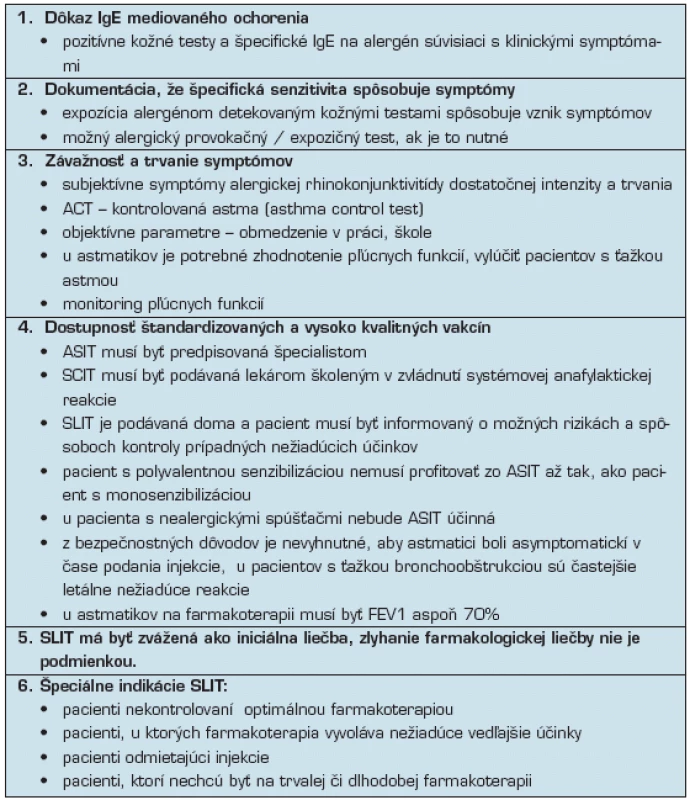
Praktické otázky
Špecifická imunoterapia sa v našej praxi aplikuje formou subkutánnych injekcií, alebo sublingválneho roztoku, alebo tabliet. V princípe ide o postupne zvyšujúce sa dávky – objem a koncentrácia, alergénu, s cieľom preprogramovať špecifickú imunitu voči kauzálnemu alergénu z alergickej reakcie na toleranciu. Ideálne je, ak vakcína obsahuje 100 % jedného kauzálneho alergénu. Ale dajú sa kombinovať viaceré biologicky príbuzné skupiny alergénov – napríklad peľ stromov, tráv, burín.
Čím viac zložiek vakcína obsahuje, tým je menší ich podiel, a tým aj efekt liečby (závislosť od kumulatívnej dávky). Nekombinujú sa peľové alergény s roztočmi, alebo plesňami. Dôvodom sú vlastnosti a rôzne správanie týchto zložiek, interakcie a/alebo enzýmové degradácie. Nie každá kombinácia a koncentrácia alergénov sa vyrába vo všetkých formách SLIT. Vo forme sublingválnych tabliet je na Slovensku dostupná zmes alergénov peľu tráv:
- reznačka laločnatá (Dactylis glomerata L.),
- tomka voňavá (anthoxanthum odoratum L.),
- mätonoh trváci (Lolium perenne L.),
- lipnica lúčna (Poa pratensis L.) a
- Timotejka lúčna (Phleum pratense L.)
v preparáte Oralair® tbl slg.
Liečba SLIT vo forme roztoku trvá 3–5 rokov kontinuálne celoročne. Injekcie aj roztok SLIT je treba skladovať v chladničke pri teplote 3–8 st C. Výhodou tabletovej formy je podávanie približne 4 mesiace pred sezónou a počas sezóny peľu tráv, v našich podmienkach teda od januára do júna a skladovanie pri izbovej teplote, ľahšia manipulácia ako aj presnejšie dávkovanie (11).
Na Slovensku sú dostupné alergénové extrakty Staloral sol., Oralair tbl, Pangramin-SLIT sol slg.
V takto selektovanej populácií pacientov bola potvrdená efektivita imunoterapie na úrovni „Evidence A“.(3)
Horná ani dolná veková hranica pre liečbu nie je pevne stanovená. Metaanalýzy ukázali, že SLIT je efektívna u detí s alergickou rhinitídou vo veku 3–18 rokov (13, 17). Monomérickým alergoidom boli liečené deti s astmou a perzistentnou rhinitídou vo veku 1 roka a 11 mesiacov až 3 rokov a 10 mesiacov (1).
Nežiadúce účinky
zaznamenané v množstve klinických štúdií aj v praxi vyplývajú hlavne z kontaktu alergénu so sliznicou. Svrbenie, pálenie, opuch sliznice v mieste kontaktu bývajú mierne až stredne závažné, najčastejšie v úvode podávania, neskôr sa zmierňujú až úplne vymiznú. Pomôže podávanie antihistaminika pred užitím vakcíny. Veľmi zriedka boli popísané systémové príznaky, pocit opuchu v hrdle, sťažené prehĺtanie alebo dýchanie a zmeny hlasu. V takýchto prípadoch treba liečbu prerušiť a konzultovať ordinujúceho lekára, ktorý zváži ďalší postup.
Ako pri iných formách ASIT, ani so SLIT sa neodporúča začínať počas gravidity. Ak je však pacientka už nastavená na udržiavaciu dávku a počas liečby otehotnie, liečba môže pokračovať pod kontrolou špecialistu.
Kontraindikácie
sú rovnaké pre subkutánnu aj sublingválnu imunoterapiu. Absolútne kontraindikácie zahŕňajú
- závažnú imunitnú nedostatočnosť alebo autoimunitné ochorenie,
- vážne kardiovaskulárne ochorenia (okrem anafylaktických reakcií na jed hmyzu),
- malignity,
- chronické infekcie,
- ťažkú bronchiálnu astmu s trvalo redukovanými pľúcnymi funkciami FEV1 pod 70 % normy napriek farmakologickej liečbe, (liečba betablokátormi vrátane lokálnej, napr. očné kvapky), a
- závažné psychiatrické poruchy pacienta.
Relatívne kontraindikácie sú gravidita.
Nebolo dokázané teratogénne riziko, ale riziko anafylaktickej reakcie počas indukčnej fázy a následné poškodenie fétu existuje. V prípade gravidity, alebo plánovanej gravidity sa neodporúča liečbu začínať. Udržiavacia fáza bez komplikácií môže pokračovať aj počas gravidity pri pravidelnom monitorovaní ordinujúcim lekárom.
Relatívnou kontraindikáciou je aj ťažký atopický ekzém (3).
V prípade SLIT sú kontraindikáciou aj zápaly ústnej dutiny a počas chirurgického výkonu v ústnej dutine (napr. extrakcia zuba) sa liečba má prerušiť na 7 dní až do úplného zahojenia ústnej dutiny.
Budúcnosť špecifickej imunoterapie
Stále sa pracuje na zlepšení účinnosti a bezpečnosti ASIT s vývojom
- čistejších a štandardizovaných extraktov,
- rekombinantných proteínov,
- syntetických peptidov,
- fragmentov,
- hybridných alergénov,
- chimér,
- fúzovaných proteínov,
- DNA vakcín.
Cieľom je dosiahnuť účinnú alergénnu vakcínu bez vedľajších nežiadúcich účinkov spôsobených IgE a T bunkovým mechanizmom. Najväčšou výzvou je vývoj preventívnych stratégií založených na vakcinácii či indukcii tolerancie, ktoré by pomohli úplne eradikovať alergické ochorenia (4, 16).
Záver
Liečba alergických ochorení je kombináciou eliminácie alergénu, tlmenia prejavov farmakami a zásahov do patomechnizmu, tzv. alergénovou imunoterapiou. ASIT je v súčasnosti zlatým štandardom v kauzálnej liečbe IgE mediovaných alergických ochorení. Predstavuje opakované podávanie kauzálneho alergénu, na ktorý je pacient senzibilizovaný a ktorý vyvoláva klinické príznaky.
Cieľom je indukcia stavu imunitnej tolerancie, ktorý pretrváva aj po ukončení liečby. Navyše pôsobí aj preventívne voči senzibilizácii na nové alergény, voči nešpecifickým podnetom a voči progresii do závažnejších stavov, napríklad do astmy. Sublingválna imunoterapia v optimálnej dávke (6) predstavuje výrazný pokrok vďaka výbornému bezpečnostnému profilu. Napriek tomu vyžaduje podrobné inštrukcie a dôsledné sledovanie pacientov. Len lekár špecialista môže indikovať ASIT po presnej diagnostike a stanovení kauzálneho alergénu.
Prvýkrát bola publikovaná štúdia SLIT v DBPC-RCT v roku 1986 a ako alternatíva ku SCIT bola akceptovaná v roku 1998 vo „WHO position paper“ a následne zaradená do guidelinov ARIA. Mechanizmus účinku SLIT využíva prirodzené vlastnosti orálnej / sublingválnej sliznice, ako miesta imunitnej tolerancie (Langerhansove bunky, Fc epsilon R1, IL-10, IDO). Indukuje systémové zmeny podobné SCIT, a navyše zapája lokálne mechanizmy orálnej sliznice a regionálnych lymfatických uzlín.
SLIT by nemala byť zvažovaná ako posledná možnosť v liečbe, ale ako komplementárna k farmakoterapii a režimovým opatreniam.
Skratky:
ASIT – alergénová špecifická imunoterapia;
SLIT – sublingválna alergénová imunoterapia;
SCIT – subkutánna alergénová imunoterapia;
EBM – evidence based medicine;
DC – dendritické bunky;
ARIA – Allergic Rhinitis and its Impact on Asthma;
MUDr. Eva Pekarová,
Povstalecká 6,
97409 Banská Bystrica,
epekarova@gmail.com
Zdroje
1. Agostini, F.,Tellarini, L., Canonica, G.W. et al. Safety of sublingual immunotherapy with a monomeric allergoid in very young children. Allergy 2005, 60, p. 133-134.
2. Akdis, M., Akdis, C. Therapeutic manipulation of immune tolerance in allergic disease. Nature Reviews Drug Discovery, 2009, 8, 10, p. 645-659.
3. Alvarez-Cuesta, E., Bousquet, J., Canonica, G.W. et al. Standards for practical allergen-specific immunotherapy. Alergy 2006, 61, 82, p. 1-20.
4. Bieber, T., Simon, H.U. Allergen-specific immunotherapy: current concepts and future directions. Allergy 66, 6, p. 709-712.
5. Canonica, G.W., Bousquet, J., Casale, T. et al. Sub-Lingual Immunotherapy:World Allergy Organization Position Paper 2009. Allergy 2009,64, Suppl 91.
6. Didier, A., Malling, H.J., Worm, M. et al. Optimal dose, efficacy, and safety of once-daily sublingual immunotherapy with a 5-grass pollen tablet for seasonal allergic rhinitis, JACI 2007, 120, 6, p. 1338-1345.
7. Jutel, M., Akdis, C.A. Immunological mechanisms of allergen-specific immunoherapy. Allergy 2011, 66, p. 725-732.
8. Kolfschoten Neut, M., Schuurman, J., Losen, M. et al. Anti-Inflammatory Activity of Human IgG4 Antibodies by Dynamic Fab Arm Exchange, Science 2007 317 9, p. 1554-1557.
9. Larché, M., Akdis, C.A., Valenta R. Immunological mechanisms of allergen-specific immunotherapy. Nature Reviews Immunology 2006, 6, 10 p. 761-771.
10. Moingeon, P., Batard,T., Fadel, R. et al. Immune mechanisms of allergen-specific sublingual immunotherapy. Allergy 2006, 61, p. 151-165.
11. Panzner, P. Oralair - sublingvální tablety pro specifickou imunoterapii alergie zpusobené pyly trav. Alergie 2010, 3, p. 207-212.
12. Passalacqua, G., Compalati, E., Canonica, G.W. Sublingual Immunotherapy: Clinical Indications in the WAO-SLIT Position Paper. WAO Journal 2010, 3, p. 216-219.
13. Penagos, M., Compalati, E., Tarantini, F. et al. Efficacy of sublingual immunotherapy in the treatment of allergic rhinitis in pediatric patients 3 to 18 years of age: a metanalysis of randomized, placebo-controlled, double-blind trials. Ann. Allergy Asthma Immunol. 2006, 97, p. 141-148.
14. Ring, J., Gutermuth, J. 100 years of hyposensitization: history of allergen-specific immunotherapy (ASIT). Allergy, 2011, 66, p. 713-724.
15. Senti, G., Moos, S., Kündig, T.M. Epicutaneous allergen administration: is this the future of allergen-specific immunotherapy? Allergy 2011, 66, p. 798-809.
16. Valenta, R. From Allergen Genes to Allergy Vaccines. Annu. Rev. Immunol. 2010, 28, p. 211-41
17. Wahn, U., Tabar, A., Kuna, P. et al. Efficacy and safety of 5-grass-pollen sublingual immunotherapy tablets in pediatric allergic rhinoconjunctivitis. JACI 2009, 123 1, p. 160-166.
Štítky
Praktické lekárstvo pre deti a dorast Praktické lekárstvo pre dospelých
Článek DemodikózaČlánek Glomus tumor prstuČlánek Ortostatická hypotenziaČlánek Prohlášení ČOS ČLS JEPČlánek Jubilea
Článok vyšiel v časopisePraktický lékař
Najčítanejšie tento týždeň
2011 Číslo 9- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Kombinace metamizol/paracetamol v léčbě pooperační bolesti u zákroků v rámci jednodenní chirurgie
- Antidepresivní efekt kombinovaného analgetika tramadolu s paracetamolem
- Vareniklin jako pomocník v léčbě nikotinismu i u psychiatrických pacientů
-
Všetky články tohto čísla
-
Základy kognitivní, afektivní a sociální neurovědy
IX. Altruismus - Primární prevence v onkologii
- Ortostatická hypotenzia
- Celoživotní vzdělávání všeobecných praktických lékařů v ČR a nová pravidla ČLK
-
Program Zdraví 2020
Budoucnost evropské zdravotní politiky - Pohled mladých českých praktiků na specializační vzdělávání – dotazníkový výzkum
- Ze života odborných společností ČLS JEP
- Interakce alkoholu a jiných látek: komplikovaný problém
- Demodikóza
- Glomus tumor prstu
- Sto rokov alergénovej imunoterapie, prvý rok sublingválnej tabletovej formy Oralair
-
Miniportréty slavných českých lékařů
Bohuslav Polák, přední český farmakolog a zakladatel slovenské farmakologie - Desiate výročie odhalenia pamätníka Franzovi Kafkovi v Tatrianskych Matlairoch
- Kafka a Rimbaud – jsou si blízcí?
- Vzpomínka na Arnošta Lustiga (co předjímal Kafka, Lustig prožil)
- Návšteva Franza Kafku v Maďarsku
- Vzpomínka na MUDr. Radmila Höschla (1931–2011)
- První celoevropská konference pacientů s kolorektálním karcinomem
- Prohlášení ČOS ČLS JEP
- Poďakovanie prof. MUDr. Miloši Velemínskému
- Ze života odborných společností ČLS JEP
- V ČR Stoupá zájem o estetické operace
- Ze života odborných společností ČLS JEP
- Jubilea
-
Základy kognitivní, afektivní a sociální neurovědy
- Praktický lékař
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Ortostatická hypotenzia
- Glomus tumor prstu
- Demodikóza
- Interakce alkoholu a jiných látek: komplikovaný problém
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



