-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Současné možnosti diagnostiky a léčby systémové AL-amyloidózy
Present possibilities of diagnosis and treatment of systemic AL-amyloidosis
The aim of presented communication is summary of actual knowledge in pathogenesis, diagnosis and treatment of primary systemic AL-amyloidosis. Great attention is devoted to contribution of assessment of serum levels of free light chains including κ/λ ratio, measurement of cardiac biomarkers NT-proBNP and troponin, and also 132I-SAP immunoscintigraphy for treatment response monitoring. The necessity of standardized evaluation of treatment results according to International Society for Amyloidosis recommended criteria are discussed. And also current possibilities of conventional chemotherapy, contribution of high‑dose chemotherapy with autologous stem cell transplantation support (HDT-ASCT), inclusively individual “risk adapted” HDT-ASCT considering prognostic factors of the disease were discussed. Present possibility of immunomodulatory therapy with incorporation of thalidomide, bortezomib and lenalidomide, used in case of treatment failure or disease progression, and also supporting care, including organ transplantation are mentioned. The important role of general practitioners and expert internists in diagnosis of early stages of the disease is highlighted – circumstances chiefly determining treatment strategy and prognosis of this severe, formerly difficult to treat and devastating disease.
Key words:
systemic AL-amyloidosis – diagnosis and classification – conventional chemotherapy – autologous stem cell transplantation – prognosis
Autoři: V. Ščudla; T. Pika
Působiště autorů: III. interní klinika Lékařské fakulty UP a FN Olomouc, přednosta prof. MUDr. Vlastimil Ščudla, CSc.
Vyšlo v časopise: Vnitř Lék 2009; 55(Suppl 1)(Supplementum 1): 77-87
Souhrn
Náplní předloženého sdělení je shrnutí současných poznatků v patogenezi, diagnostice a léčbě primární systémové AL-amyloidózy. Hlubší pozornost je věnována přínosu stanovení sérových hladin volných lehkých řetězců imunoglobulinu včetně poměru κ/λ, srdečních biomarkerů NT-pro BNP a troponinu, i 132I-SAP imunoscintigrafie pro monitorování výsledků léčby. Diskutována je i nutnost standardizovaného hodnocení výsledků terapie s pomocí kritérií doporučených International Society for Amyloidosis. Předloženy jsou i současné možnosti konvenční chemoterapie, přínos vysokodávkované chemoterapie s podporou autologní transplantace krvetvorných buněk (VDT-ATKB) včetně individuálně uzpůsobené „risk adapted“ VDT-ATKB zohledňující prognostické ukazatele nemoci. Nastíněny jsou i současné možnosti imunomodulační léčby se začleněním thalidomidu, bortezomibu a lenalidomidu, využívané především v případě prvotní léčebné rezistence nebo progrese nemoci a významné možnosti podpůrné léčby včetně transplantace selhávajícího orgánu. Je vyzdvižena významná role praktických lékařů a odborných internistů v podchycení počátečních fází nemoci, tedy okolnosti, rozhodující do značné míry o strategii léčby, a tím i o prognóze této závažné, dříve obtížně léčitelné a devastující nemoci.
Klíčová slova:
systémová AL-amyloidóza – diagnóza a klasifikace – konvenční chemoterapie – autologní transplantace krvetvorných buněk – prognózaÚvod
Systémová AL-amyloidóza, označovaná původně jako primární amyloidóza, je onemocnění vyznačující se monoklonální plazmocelulární dyskrazií s tkáňovou depozicí bílkovinného insolubilního fibrilárního materiálu, tj. amyloidu, jehož prekurzorem jsou lehké řetězce (LŘ) monoklonálního imunoglobulinu, především řetězce λ, nebo i jejich fragmenty [1]. Název AL-amyloidóza je odvozen právě od této skutečnosti: A – amyloid, L – lehké řetězce [2,3]. Extracelulární depozice a progresivní akumulace AL-amyloidu v cévní a parenchymové složce životně důležitých orgánů vede k tkáňové dezorganizaci, k úbytku normálních elementů a k progresivní poruše funkce životně důležitých orgánů, zejména srdce, ledvin, jater, zažívacího traktu a periferního i autonomního nervového systému, nikoliv ale CNS [4–8]. Vzhledem k tomu, že depozita AL-amyloidu vyvolávají pouze malou, případně žádnou lokální tkáňovou reakci, neexistuje úzká souvislost mezi tíží amyloidové depozice a stupněm narušení orgánové funkce [3]. Optimální péče o nemocné s AL-amyloidózou je založena na časné diagnóze, přesné typizaci, účinné terapii včetně komplexní podpůrné léčby [9]. Díky soustředěnému zájmu o problematiku AL-amyloidózy došlo v průběhu několika posledních let k nepochybnému zlepšení léčebných výsledků i délky celkového přežití u této stále závažné, život ohrožující choroby [9].
Výskyt a epidemiologie
Přesný výskyt AL-amyloidózy v populaci není znám, v USA je odhadována prevalence na 5,1–12,8 nemocných/milion obyvatel za rok, v západní Evropě na 0,8/100 000 obyvatel za rok [3,10]. Onemocnění postihuje především starší jedince, věkový medián je přibližně 60 let, pouze 10–20 % nemocných je mladších 50 let, přičemž výskyt není odlišný z hlediska pohlaví [3,8]. Ve 12–20 % provází systémová AL-amyloidóza mnohočetný myelom (MM), primární makroglobulinemii nebo vzácně i jiné klonální lymfoproliferativní stavy, např. ne-hodgkinské lymfomy [3,11,12], a pouze u 1 % nemocných se v průběhu AL-amyloidózy vyvine MM [3,12].
Patogeneze systémové AL-amyloidózy
Patogeneze systémové AL-amyloidózy není pro její složitost doposud zcela objasněna. Základní příčinou je ale klonální plazmocelulární dyskrázie CD138 a CD32B pozitivních plazmocytů produkujících „amyloidogenní“ LŘ imunoglobulinu. K syntéze AL-amyloidu dochází v důsledku tvorby makromolekulárních agregátů bílkovinného fibrilárního materiálu za spoluúčasti kodepozice kofaktorů nefibrilárního charakteru [11]. Makromolekulární agregáty jsou tvořeny nerozpustnými polymery s nízkou molekulární hmotností (5–25 kD) s antiparalelní fibrilární β-dimenzionální strukturou. V asi 75 % jde o N terminální části monoklonálního LŘ λ, sestávající z celé nebo z části variabilní (VL) domény. Amyloidogenní potenciál je vázán na variabilní část LŘ, kde k destabilizaci, tj. konverzi solubilní v insolubilní formy, přispívá změna sekvence aminokyselin [12,13]. Bylo zjištěno, že variabilní doména LŘ může v průběhu imunitní odezvy mutovat, přičemž některé z těchto fyziologických mutací postihují kritická strukturální místa destabilizující doménu, a vést tak k tvorbě agregátů. Důležitou determinantou toxicity amyloidogenních LŘ jsou jejich biochemické charakteristiky, neboť v podmínkách in vitro byla prokázána transformace lidských mezangiálních buněk. Ke snížení termodynamické stability, změnám hydrofobie a elektrostatického potenciálu přispívá mj. i interakce s povrchovým buněčným receptorem RAGE („receptor for advanced glycation end product“). Při umístění tkáňových depozit hraje významnou roli i princip orgánového tropizmu, např. podtyp IgVλ VI je spojován s rozvojem amyloidové neuropatie, zatímco IgVλ II nebo III s amyloidovou kardiomyopatií nebo s tvorbou depozit v měkkých tkáních. Na specificitě tkáňové depozice se může podílet i rozpoznání některých tkáňových složek, např. kolagenu. U nemocných po autologní transplantaci krvetvorných buněk (ATKB) bylo časné i celkové přežití podstatně delší u nemocných λ IGLV6S1 typu [14]. V současnosti je zkoumána i otázka genového expresního profilu („amyloid associated V λ germline“ genu). Na rozvoji systémové AL-amyloidózy se podílí i kodepozice kofaktorů nefibrilárního charakteru, např. glykosaminoglykanů (heparan sulfát), SAP (sérová P-amyloidová komponenta) či specifické apolipoproteiny (např. E a J) [11,15]. Všechny typy amyloidových depozit obsahují glykoprotein SAP, který je vysoce odolný proti proteolýze, podílející se na rezistenci fibril amyloidu vůči degradaci. Diskutované faktory se uplatňují jednak v modulaci fibrilogenezy ovlivněním metabolizmu prekurzorových proteinů potenciací stabilizace a akumulace fibril a snížením resorpce a degradace amyloidu v monocyto-makrofágovém systému [16]. Nelze ale pominout ani vliv tkáňového mikroprostředí, ovlivňujícího biochemické charakteristiky amyloidogenních LŘ i cytotoxický potenciál solubilních oligomerů [6]. Dokladem toxicity amyloidových prekurzorů je klinické pozorování, že ke zlepšení orgánové funkce (např. poklesu NT-proBNP) dochází již záhy po nasazení terapie, tedy v příliš krátkém intervalu pro možnou resorpci fibrilárních depozit [17,18]. Plazmocelulární dyskrazie u AL-amyloidózy je blízká monoklonální gamapatii nejistého významu (MGNV), což dokládá i zachycený výskyt cytogenetických změn, např. delece 13 a translokace 14q vyskytující se u MGNV a u MM [19].
Klinický obraz
Klinický obraz systémové AL-amyloidózy závisí především na počtu a tíži zasažených orgánů. I u nemocných s víceorgánovým postihem jsou v popředí klinického obrazu projevy postižení dominantního orgánu [12]. Z rozboru souboru 868 nemocných s AL-amyloidózou vyplynulo, že postižení jednoho orgánu se vyskytuje ve 25 %, dvou orgánů ve 36 % a postižení 3 a více orgánů u 39 % nemocných [6]. Nefropatie v důsledku AL-amyloidózy se vyskytuje v 72 %, kardiomyopatie v 63 %, postižení jater ve 27 %, periferní neuropatie v 19 %, postižení autonomního nervstva v 16 %, inbibice měkkých tkání ve 12 % a amyloidová kožní purpura v 11 % [6].
Součástí klinického obrazu jsou jednak nespecifické projevy celkového charakteru, tj. slabost, malátnost, únavnost, snížení chuti k jídlu a pokles hmotnosti, jednak pestré projevy vyplývající z postižení jednotlivých orgánů a tkání. Mezi subjektivní příznaky patří opakované synkopální stavy a ortostatická hypotenze v důsledku autonomní neuropatie, dále dysgeusie, „sicca like syndrom“, dysfonie v důsledku inbibice hlasivek, projevy dysmotility gastrointestinálního traktu (GIT) vyznačující se sklonem k obstipaci nebo k průjmům, parestezie dolních končetin, močová inkontinence a erektilní dysfunkce při nepřítomnosti diabetes mellitus, případně i zhoršení zraku a sluchu. Fyzikální vyšetření může odhalit přítomnost nepříliš časté, ale vysoce patognomonické periorbitální purpury vznikající v důsledku amyloidové vaskulopatie („račí oči“), depozit amyloidu v oblasti víček, exoftalmu, alopecie, poměrně patognomonické makroglosie s případnými postranními dentálními indentacemi, zvětšení slinných žláz, depozit v kůži a v podkožním tuku, někdy i ekchymóz v důsledku snížení hladiny f. X, trombocytopenie nebo amyloidové vaskulopatie, onycholýzy, známek bolestivého zbytnění některých svalů (svalová pseudohypertrofie) vedoucí v oblasti glenohumerálního skloubení k příznaku „epolet“ [20], zbytnění a deformaci kloubů (bolestivá, séronegativní amyloidová artropatie) v důsledku depozit amyloidu v oblasti kloubních struktur [21], nezřídka i přítomnost periferních otoků a pleurálních výpotků, vzácně i přítomnost amyloidové lymfadenopatie [3,4].
V souboru 868 nemocných se systémovou AL-amyloidózou byl prokázán výskyt slabosti v 68 %, edémy v 62 %, pokles hmotnosti ve 43 %, dušnost ve 40 %, ortostatická hypotenze ve 27 %, dysestezie a parestezie ve 23 %, dysgeusie v 18 %, makroglosie ve 14 %, kožní purpura v 11 % a průjem v 9 % případů [6]. Systémová AL-amyloidóza se v klinické praxi manifestuje navíc i přítomností různě rozvinutých klinických syndromů, jejichž diagnostické řešení může přivést lékaře různých oborů k rozpoznání nemoci:
Renální amyloidóza
Projevuje se především postižením glomerulů, jehož projevem je různě výrazná proteinurie, případně i nefrotický syndrom, mírnou renální dysfunkcí, zatímco obraz rozvinutého selhání ledvin není zcela obvyklý.
Amyloidová kardiomyopatie
Projevy často dominují již při diagnóze nemoci. V klinickém obraze jsou obvykle v popředí projevy pravostranné srdeční slabosti nebo projevy sníženého srdečního výdeje, tj. ortostatická hypotenze a snížení krevního tlaku, přičemž tyto příznaky může zhoršovat i častá fibrilace síní, případně další poruchy srdečního rytmu, možná je i srdeční zástava. Poměrně vzácně se systémová AL-amyloidóza projevuje obrazem anginy pectoris v důsledku depozit amyloidu ve stěnách koronárních cév [3,4,11,12].
Periferní a autonomní neuropatie
Zpravidla axonální, charakteru distální smíšené periferní neuropatie projevující se přítomností dysestezií, parestezií s progresivní ztrátou citlivosti, trnutím a svalovou slabostí [4]. Senzitivní neuropatie je obvykle symetrická, někdy značně bolestivá, zatímco motorická neuropatie je podstatně vzácnější. Častým projevem je syndrom karpálního tunelu, který může předcházet ostatní projevy AL-amyloidózy i o několik let. Nezřídka je v popředí autonomní neuropatie, mající závažnější obraz, neboť se vedle kardiální příčiny a hypokortizolizmu podílí na přítomnosti posturální hypotenze s poklesem TK v ortostáze o > 20 mm Hg (< 90 mm Hg), poruchách motility GIT, u mužů erektilní a ejakulační dysfunkce, dysfunkce močového měchýře s poruchou vyprazdňování, časného pocitu sytosti, poruch chuti nebo anhidrózy.
Amyloidóza GIT a jater
Může být ložisková nebo difuzní. Makroglosie je do jisté míry patognomonická a vzhledem k dominantnímu postižení kořene jazyka může vést k obstrukci dýchacích cest i k poruše polykání. Dyspeptický syndrom bývá v důsledku gastroparézy spojen s pocitem nauzey a předčasné sytosti, s obstipací (pseudoobstrukce), ale i obrazem explozivního postprandiálního průjmu s malabsorpcí a s poklesem hmotnosti. V případě amyloidózy GIT byla popsána perforace střeva i výrazné krvácení z distálních partií tračníku vznikající v důsledku zvýšené vaskulární fragility. Hepatomegálie s pozitivitou jaterních testů, zejména alkalické fosfatázy, a případná splenomegalie se vyskytují asi u 1/4 nemocných [3].
Poruchy hemostázy
Vyskytují se u AL-amyloidózy asi u 1/4 nemocných [22]. Nejčastější je vaskulární purpura v důsledku zvýšené cévní fragility způsobené subendoteliální depozicí amyloidu, v případě splenomegalie lze pozorovat i trombocytopenii [11,22]. Na projevech hemoragické diatézy se může podílet i významné snížení f. X a jsou známa i významná, život ohrožující krvácení po biopsii jater nebo ledvin [3].
Postižení skeletu
Je rozpoznatelné u asi 30 % nemocných s pomocí SAP-imunoscintigrafie. Na rozdíl od MM však není provázeno bolestmi kostí, přítomností osteolytických lézí a patologických zlomenin, radiograficky jsou přítomné změny necharakteristické, nebo dokonce i němé.
Postižení ostatních orgánů a tkání
Vyskytuje se i ložiskové postižení plicního parenchymu (amyloidom), zatímco amyloidová infiltrace tracheobronchiálního stromu vede ke známkám obstrukce. Postižení pleury se projevuje torpidními pleurálními výpotky, infiltrace nadledvin nebo štítné žlázy známkami hypokortizolizmu nebo hypotyreózy.
Diagnostický postup
Rozpoznání AL-amyloidózy se opírá o 2 diagnostické pilíře: průkaz depozit amyloidu a zjištění, že depozita jsou odvozena od monoklonálních LŘ imunoglobulinu, případně o průkaz plazmocelulárního klonu. Správná diagnóza vyžaduje notnou dávku invence, přičemž skutečnou výzvou k pátrání po přítomnosti AL-amyloidózy je nález MIg v séru nebo v moči a některých z popsaných příznaků, projevů a klinických syndromů. Soubor laboratorních testů, používaných v diagnostice a stážování AL-amyloidózy je shrnut v tab. 1 [17].
Tab. 1. Přehled laboratorních testů používaných v diagnostice a stážování AL- amyloidózy [17]. ![Přehled laboratorních testů používaných v diagnostice a stážování AL- amyloidózy [17].](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/867f51ed225003c64f40b39cf67b89cd.jpeg)
Při histologickém vyšetření je pátráno po perivaskulární nebo intersticiální depozici hyalinního, bezstrukturního, při barvení hematoxylin eosinem narůžovělého materiálu. Ke specifickému průkazu amyloidu se používá barvení konžskou červení, kdy v polarizačním mikroskopu lze pozorovat patognomonickou metachromazii s přítomností světle zeleného zbarvení. Vyšetření v elektronovém mikroskopu nachází lineárně uspořádané fibrily v β-konfiguraci, citlivější transmisní mikroskopie je schopna rozpoznat fibrily až v řádu 10 nm. Při necílené biopsii se používá kombinace histobioptického vyšetření kostní dřeně (KD) s pátráním po amyloidu (pozitivita asi v 50 %) a klonalitě plazmocytů v KD se současným vyšetřením podkožního tuku v oblasti břicha, kdy je na pracovištích v USA popisována senzitivita 60–80 % a specificita 92–100 % [23]. Vzhledem k tomu, že v našich podmínkách selhává průkaz v podkožním tuku ve více nežli 50 % případů [3], dává se přednost odběru z oblasti rekta (pozitivita v 50–70 %), slinné žlázy, ojediněle i z oblasti gingivy a jazyka [3,6]. Při negativitě necíleného vyšetření KD, podkožního tuku, nebo i z oblasti rekta a gingivy je indikována cílená biopsie, a to pokud možno z dominantně postiženého orgánu. S více nežli 90% výtěžností se setkáváme při endomyokardiální biopsii, biopsii jater, ledviny a kůže, s více nežli 80% pozitivitou při vyšetření materiálu z oblasti karpálního tunelu, tenkého střeva a surálního nervu. Přímá biopsie není pro diagnózu AL-amyloidózy nezbytná, pokud byla prokázána depozita AL-amyloidu v necílené biopsii a jsou li známky orgánové dysfunkce [4,24]. Pro identifikaci AL-typu amyloidózy je nezbytný jednoznačný průkaz monoklonální plazmocelulární dyskrazie s pomocí imunohistochemického průkazu klonality plazmocytů v KD produkujících jeden typ LŘ, nebo analýzou aspirátu KD s pomocí průtokové cytometrie. Samotný výskyt plazmocytů v KD je ale obvykle nízký, u ~ 60 % nemocných < 10 % plazmocytů. V diagnosticky obtížné situaci lze použít k identifikaci AL-typu amyloidózy sekvenční analýzu aminokyselin amyloidu [25], nebo DNA analýzu. Imunohistologická analýza depozit amyloidu s pomocí monoklonální protilátky proti LŘ k nebo λ je málo citlivá (pozitivita u ~ 50 %) vzhledem ke ztrátě antigenních epitopů, ke kterým dochází v průběhu fibrilogenezy [17]. Naprosto základním a neopominutelným vyšetřením při pátrání po AL-amyloidóze je imunofixační elektroforéza (IFE) bílkovin séra nebo moče, odhalující přítomnost monoklonálního Ig nebo LŘ v 71 a 84 % [4,24]. Standardní elektroforéza bílkovin séra je málo citlivá (pozitivita u ~ 50 %), v pozitivním případě nebývá hladina M-proteinu vysoká (~ 70 % < 20 g/l). V současnosti je již standardním postupem doplnění IFE séra kvantitativním nefelometrickým vyšetřením hladiny volných lehkých řetězců imunoglobulinu (VLŘ-Ig, Freelite test), včetně vyšetření jejich poměru κ/λ, dosahující při kombinaci obou vyšetření senzitivity 99 % [4,26,27]. Zvýšené hladiny S-VLŘ a/nebo abnormální poměr indexu κ/λ se u AL-amyloidózy vyskytuje v 86–92 %, a to v korelaci s náloží amyloidu [28]. Bylo zjištěno, že spíše nežli stupeň amyloidové imbibice odpovídá za kardiotoxicitu a nefrotoxicitu zvýšená hladina S-VLŘ („light chain“ toxicita). Vyšetření hladiny S-VLŘ je tedy v současnosti při podezření na AL-amyloidózu metodou volby, ale i nenahraditelnou metodou monitorování léčebné odezvy [26]. Cytogenetické vyšetření se setkává s přítomností monosomie 8. chromozomu (~ 70 %), s různým typem trisomií, s translokací t(11;14) a s nálezem zisku 1q21, tedy s nálezy obdobnými jako u MM i MGNV [29].
K vyšetření AL-amyloidózy patří i pečlivé zhodnocení stavu funkce zasažených orgánů. Postižení renální funkce se projevuje proteinurií s případným obrazem NS a s různě závažným snížením glomerulární filtrace s případnou retencí dusíkatých katabolitů. K odhalení amyloidové kardiomyopatie napomáhá již vyšetření EKG nacházející sníženou voltáž v končetinových svodech a obraz QS ve V1-3 (obraz „pseudoinfarktu“), případně přítomnost různého typu dysrytmií. Radiografické vyšetření nemusí být vždy provázeno rozšířením srdečního stínu. Za citlivý je považován Ewingův test odhalující sníženou variabilitu srdeční frekvence. Zcela stěžejní je echokardiografické vyšetření, nacházející koncentrické ztluštění zadní stěny a septa, „granulární“ obraz, v pozdní fázi sníženou ejekční frakci (EF), dopplerometricky prokázané známky diastolické i systolické dysfunkce při nepřítomnosti jiného srdečního onemocnění (tab. 2) [30]. Přínosné je i vyšetření srdce s pomocí MRI a stanovení hladin srdečních biomarkerů troponinu a NT-proBNP umožňující časnou, preklinickou detekci depozit amyloidu i monitorování srdeční dysfunkce [31]. Normální hladina NT-proBNP v séru vylučuje amyloidovou kardiomyopatii, zatímco perzistence zvýšené hladiny troponinu signalizuje pokračující ztrátu kardiomyocytů [32]. Nezbytným je pečlivé neurologické vyšetření zaměřené na pátrání po známkách autonomní i distální smíšené senzomotorické neuropatie doplněné o EMG vyšetření, jež je ale poměrně málo citlivé, v úvahu přichází i biopsie surálního nervu. MRI vyšetření lze použít k odhalení amyloidové myopatie a artropatie. Endoskopické vyšetření GIT je indikováno v případě projevů dysmotility a v případě podezření na erozivní amyloidovou enteropatii, doplněné o vyšetření poruch resorpce. Postižení jater lze verifikovat s pomocí jaterní biopsie v případě 1,5násobné zvýšené jaterní formy AF a sonograficky nebo CT prokázané hepatomegalie s šíří nad 15 cm. V krevním obraze může být anémie chronických chorob, koagulační vyšetření může zaznamenat zvýšení cévní fragility, prodlouženou krvácivost, případně i sníženou hladinu f. X [22]. Radiografické vyšetření plic a případně vysoce citlivé HR-CT („high resolution CT“) může napomoci k odhalení postižení plic a pleury. V případě zmnožené retikulonodulární kresby (difuzní intersticiální amyloidóza), „coin lesion“ (amyloidom), pleurálního výpotku (při infiltraci pleury) může vést k diagnóze transbronchiální nebo video-asistovaná torakoskopická biopsie. V odhalení depozit v bronchiálním stromu (tracheobronchiální amyloidóza) se uplatňuje bronchoskopie s odběrem materiálu na histologii a spirometrické vyšetření včetně vyšetření difuzní kapacity plic [30]. Celotělové zhodnocení distribuce depozit amyloidu umožňuje doposud v podmínkách ČR nedostupná radioscintigrafie s použitím 132I-aprotininu nebo 132I-SAP či 99Tc-SAP, vykazující vysokou specificitu (93 %) a senzitivitu (90 %) [33,34]. S výjimkou srdce, případně i nadledvin a jater, umožňuje hodnocení rozsahu amyloidu včetně jeho depozice v KD, ale i regresi nálože amyloidu v průběhu léčby [3,33]. Jde ale o metodu nákladnou, všeobecně málo dostupnou a s potenciálním rizikem přenosu infekce způsobeným získáváním SAP od dárců krve [7]. V současnosti lze při stanovení diagnózy systémové AL-amyloidózy vycházet z kritérií přijatých na „10th International symposium on amyloid and amyloidosis“, Tours 2004 (tab. 2) [30].
Tab. 2. Průkaz postižení orgánů při AL-amyloidóze: biopsie postižených orgánů nebo cílená biopsie z alternativních míst* [30]. ![Průkaz postižení orgánů při AL-amyloidóze: biopsie postižených orgánů nebo cílená biopsie z alternativních míst* [30].](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/74b1aa56580413fddcf08bcbc88cc606.jpeg)
Hodnocení léčebné odezvy
Současné hodnocení léčebné odezvy u systémové AL-amyloidózy vychází z poznání, že funkce orgánů se může restaurovat, pokud dochází k poklesu amyloidogenních prekurzorů. V rámci „10th Symposium of International society for amyloidosis“ byla přijata kritéria hodnocení hematologické odezvy (tab. 3), orgánové odezvy (tab. 4) a kritéria progrese systémové AL-amyloidózy (tab. 5), která významným způsobem přispěla ke sjednocení hodnocení výsledků léčby a umožnila srovnávání výsledků různých klinických studií a pracovišť [30]. V současnosti je základním přístupem v monitorování léčebné odezvy sledování pohybu hladin S-VLŘ . Bylo zjištěno, že > 50% pokles hladiny S-VLŘ (parciální remise – PR), lépe ale > 90% redukce přináší podstatné zlepšení objektivní léčebné odezvy (OR) [3,28]. Při hodnocení prognózy po ASCT VDT-ATKB (vysokodávkovaná chemoterapie s podporou autologní transplantace krvetvorných buněk) se ale uplatňuje spíše nežli procentuální redukce S-VLŘ hodnocení jeho absolutní koncentrace, neboť normalizace hladiny S-VLŘ je spojena s kompletní orgánovou i hematologickou remisí a s celkovou délkou přežití [35]. U nemocných s amyloidovou kardiomyopatií dochází po úspěšné léčbě k rychlému souběžnému poklesu S-VLŘ a NT-proBNP, korelujícím i s délkou celkového přežití (OS – overall survival), zatímco nemocní bez poklesu obou ukazatelů jsou kandidáty časné smrti [9]. K podchycení citlivosti, nebo naopak rezistence k terapii by měla být koncentrace S-VLŘ a NT-proBNP vyšetřována v intervalu nejméně 3 měsíců [9]. Na vysoce specializovaných pracovištích lze použít k hodnocení průběžné regrese celotělových depozit amyloidu 99Tc-SAP nebo 132I - SAP imunoscintigrafie [3,33].
Tab. 3. Hematologická (imunochemická) kritéri a léčebné odezvy u AL-amyloidózy [30]. ![Hematologická (imunochemická) kritéri a léčebné odezvy u AL-amyloidózy [30].](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/9ee67f0cb7e08d0fdcb3dd1b2cec269a.jpeg)
Tab. 4. Kritéria zlepšení funkce orgánů po léčbě AL-amyloidózy [30]. ![Kritéria zlepšení funkce orgánů po léčbě AL-amyloidózy [30].](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/33b2e0cc49ac77aa0d90ee7215c840be.jpeg)
Tab. 5. Kritéria zhoršení orgánové funkce [30]. ![Kritéria zhoršení orgánové funkce [30].](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/040dbbe4fef6f2793eaf5c6c55940188.jpeg)
Prognostické faktory
Dlouhodobý prognostický výhled nemocných s AL-amyloidózou je nepříznivý, zejména nebyla li včas zahájena adekvátní léčba [36]. Medián celkového přežití byl v původních studiích u nemocných se závažným postižením srdce nebo selháním jater pouze 4–6 měsíců, zatímco běžná délka života byla 1–2 roky [8]. Hlavní příčinou smrti u systémové AL-amyloidózy jsou infekční komplikace a srdeční selhání (~ 50 %) [36]. Retrospektivní univariační analýza souboru 147 nemocných prokázala tyto nepříznivé prediktory celkového přežití: počet plazmocytů v obvodové krvi > 500 000/l a > 1 % cirkulujících plazmocytů, S-b2-mikroglobulinu > 2,7 mg/l, > 10 % plazmocytů v KD a dominantní závažné postižení srdce [37]. Vzhledem k tomu, že amyloidová kardiomyopatie je nejzávažnějším prognostickým ukazatelem, je rozpoznání její přítomnosti k vytipování vysoce rizikových nemocných klíčové. Za velmi citlivé (senzitivita a specificita 93 a 90 %) je považováno zvýšení hodnot NT-proBNP > 152 pmol/l (mortalita 72 vs 8 %/rok) [31] a snáze dostupné vyšetření troponinu [32]. K individuálnímu hodnocení prognózy se v současnosti používá především hodnocení dosaženého stupně poklesu hladiny S-VLŘ a indexu κ/λ po terapii. Pětileté přežití je při poklesu hladiny S-VLŘ o 50 % spojeno s podstatně delším přežitím (88 vs 39 % nemocných) [28]. U nemocných, u kterých nedošlo po ATKB k dosažení úpravy hladin S-VLŘ, se vyznačují vysokou mortalitou [32]. K nepříznivým prognostickým faktorům u AL-amyloidózy patří podle dalších autorů echokardiografický průkaz srdeční amyloidózy, vysoká celotělová nálož nebo progredující akumulace amyloidu při opakované 132I-SAP scintigrafii [28,33], plně vyjádřená autonomní neuropatie, postižení jater s hyperbilirubinemií, nedosažení suprese klonality procesu po chemoterapii a sdružení s MM [3]. Prognóza nemocných s MM je ovlivněna i přítomností určitých „germline“ genů, např. expresí λ VI IgL V6S1.
Diferenciální diagnostika AL-amyloidózy
V případě histologického průkazu amyloidózy je nutné odlišení systémové AL-amyloidózy především od formy ložiskové, AL-amyloidózy sdružené s MM nebo s jiným lymfoproliferativním stavem, ale i od ostatních typů amyloidóz, zejména od hereditární amyloidózy (obr. 1) [3]. V klinické praxi je občasně systémová AL-amyloidóza zaměňována za MGNV a je správně rozpoznána až v pozdní fázi s mnohaorgánovou manifestací nemoci.
Obr. 1. Diferenciální diagnostika AL-amyloidózy. AL – AL-amyloidóza, LŘ MIg – lehké řetězce monoklonálního imunoglobulinu, Pb – plazmatické buňky, SAP- scintigrafie – scintigrafie s použitím označené sérové amyloidové P-komponenty, HDC – horní dýchací cesty, UPT – uropoetický aparát, GIT – gastrointestinální trakt, MM – mnohočetný myelom, MW – Waldenströmova makroglobulinemie, LP-NHL – lymfoplazmocytární ne-hodgkinský lymfom, IMWG – Internati onal Myeloma Working Group, AA – sekundární, resp. reaktivní amyloidóza, RA – revmatoidní artritida, MB – Bechtěrevova choroba, VSK – vaskulitidy, RAF – reaktanty akutní fáze, ATTR – hereditární amyloidóza podmíněná mutací genů pro transthyretin, DNA – deoxyribonukleová kyselina, ELMI – elektronová mikroskopie, MGNV – monoklonální gamapatie nejistého původu, SA – senilní amyloidóza, Aβ<sub>2</sub>M – dialyzační amyloidóza, kde prekurzorem amyloidu je β<sub>2</sub>- mikroglobulin. 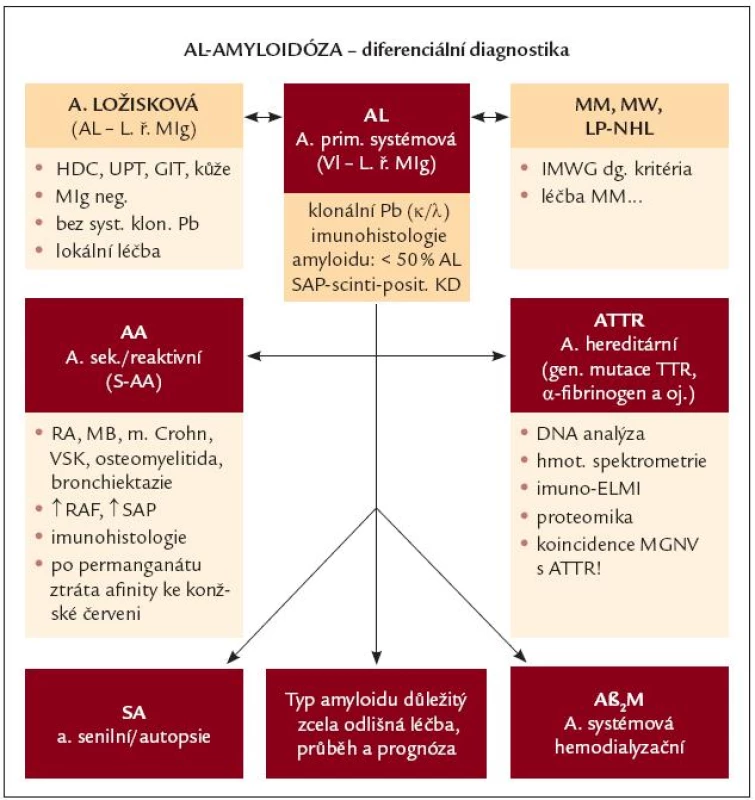
Ložisková AL-amyloidóza
Vyskytuje se nejčastěji v oblasti horních dýchacích cest, zejména v nazofaryngu, ale i v oblasti orbity, urogenitálního a GIT traktu, nebo v kožní lokalizaci. Amyloidogenní LŘ jsou vytvářeny populací klonálních lymfoplazmocytárních elementů, obklopujících nodulárně nebo ve formě souvislých difuzních infiltrátů depozita amyloidu. AL-charakter lze ověřit imunohistochemicky nebo s pomocí sekvenční či DNA analýzy fibrilárního proteinu, nikoliv ale vyšetřením klonality buněk pro jejich skutečně sporý výskyt. U převážné většiny nemocných nelze zachytit MIg v séru a/nebo v moči. Průběh je většinou relativně benigní, projevuje se lokálním zúžením horních dýchacích cest nebo krvácením (např. epistaxí), někdy však může vyústit v závažné poškození postiženého orgánu. Přechod v systémovou formu AL-amyloidózy se prakticky nevyskytuje. Léčebně se využívá lokální chirurgický nebo laserový zákrok, systémová chemoterapie se pro svou neúčinnost nedoporučuje [3,38].
Sekundární, resp. reaktivní AA-amyloidóza
Původně se vyskytovala u chronických zánětlivých stavů (osteomyelitida, lues, tuberkulóza), v současnosti se pozoruje u dlouhodobě neuspokojivě léčebně podchycených onemocnění, jakými jsou revmatoidní artritida, Crohnova choroba, ankylozující spondylartritida, případně vaskulitidy. Chronická zánětlivá aktivita vede k nadměrné jaterní produkci reaktantu akutní fáze, tj. amyloidu A, jehož fragmenty jsou přetvářeny do formy amyloidových fibril [39]. K histologickému odlišení od AL-amyloidózy přispívá inkubace s permanganátem, vedoucím na rozdíl od AL-amyloidózy ke ztrátě afinity ke konžské červeni.
Hereditární autozomálně dominantní amyloidóza
Je způsobena mutací genů pro různé proteiny (α-řetězec fibrinogenu A, transthyretin), sporadické případy mohou být zaměněny za AL-amyloidózu, neboť klinický obraz je velmi podobný, a může jít dokonce i o stavy s přítomností MIg. Samotnou přítomnost MIg tedy nelze považovat za dostatečný důvod diagnózy systémové AL-amyloidózy [40]. V hraničních situacích je proto nutná imunofluorescenční detekce monoklonálního LŘ v depozitech amyloidu, DNA analýza nebo vyšetření sekvence aminokyselin v proteinu amyloidových fibril, na vysoce specializovaných pracovištích je dostupná i identifikace genů spojených s hereditární formou amyloidózy.
Senilní amyloidóza
Je to forma amyloidózy odvozená od normálního transthyretinu, která se vyznačuje depozicí ve stěně srdečních komor u jedinců v seniorském věku. Manifestuje se obvykle městnavou srdeční slabostí, arytmií a je obvykle rozpoznána až při autopsii [4].
V diferenciální diagnostice systémové AL-amyloidózy je nutno vzít v potaz i odlišení od dalších onemocnění spojených s přítomností M-komponenty, tj. MGNV, periferní neuropatie s přítomností MIg a nemoci z depozice lehkých řetězců [3].
Léčba AL-amyloidózy
Cílem léčby je rychlé snížení tvorby amyloidogenních LŘ potlačením plazmocelulárního klonu, vedoucí spolu s redukcí tkáňových depozit amyloidu ke zlepšení funkce životně důležitých orgánů [41]. Terapie by měla vést k dosažení kompletní remise (KR), a to „hematologické“ (tab. 3) i „orgánové“ (tab. 4), se zlepšením kvality života a s podstatným prodloužením celkového přežití [30]. Vzhledem k obdobné patogeneze AL-amyloidózy a MM založené na akumulaci monoklonálních plazmocytů produkujících MIg jsou základní principy léčby obou stavů dosti podobné. V případě AL-amyloidózy je ale nutno počítat s nižší tolerancí chemoterapie a zejména VDT-ATKB a s možností zlepšení funkce orgánů již při snížení hladiny toxicky působícího monoklonálního LŘ ještě před zřetelnou resolucí amyloidu.
Konvenční chemoterapie
Tradiční standardní léčbou systémové AL-amyloidózy, nesplňující kritéria VDT-ATKB, byla terapie kombinující melfalan (0,15 mg/kg/den 1.–7. den), případně cyklofosfamid s prednisonem (0,8–1,0 mg/kg/den 1.–7. den ), tj. režimy MP nebo CP podávané dle tolerance v intervalu 6 týdnů. Po 12 měsících terapie dosáhlo léčebné odezvy 20–30 % jedinců s OS 18–25 měsíců [4,36]. V současnosti se tento typ léčby rezervuje pouze pro nemocné ve věku nad 75 let s nemožností využití intenzivnějších léčebných postupů. Kombinované chemoterapeutické režimy se začleněním dalších působků, tj. vinkristinu, BCNU, cyklofosfamidu (VMCP, VBMCP) neprokázaly oproti režimu MP přesvědčivý přínos z hlediska zvýšení léčebné odezvy i OS. Rovněž režim VAD (vinkristin, adriamycin a dexametazon), dosahující léčebné odezvy u asi 50 % nemocných, nedoznal až na výjimky rozšíření vzhledem ke kardiotoxicitě adriamycinu a zhoršení periferní i autonomní neuropatie po vinkristinu [3]. Samotnou léčbu pulzními dávkami dexametazonu po dobu 4 dnů, dosahující hematologické léčebné odezvy u asi 30–50 % nemocných, lze doporučit jen v případě závažné pancytopenie nebo v období pozdní, léčebně refrakterní fáze nemoci [3].
Snaha o zlepšení léčebných výsledků vedla k intenzifikaci dávek kortikosteroidů a k omezení variability resorpce perorálně užívaného melfalanu volbou jeho nitrožilního podání. Doporučována je dávka melfalanu 25 mg/m2 nitrožilně 1. den spolu s dexametazonem 40 mg/den p.o. v 1–3 4týdenních cyklech dle tolerance měsíčně, zajištěná profylaktickým podáním omeprazolu, případně i ciprofloxacinu a itrakonazolu [42]. Velmi dobré zkušenosti byly ale získány i s perorální modifikací tohoto schématu, používající melfalan 0,22 mg/kg/den p.o. 1.–4. den spolu s dexametazonem 40 mg p.o. 1.–4. den v intervalu 4 týdnů. Takto vyprofilizovaná léčba se podává po dobu 9 cyklů a přerušuje v případě KR nebo při selhání účinnosti či nepřijatelné toxicitě, přičemž úmrtnost v souvislosti s podanou terapií (TRM) je 4 % [43]. Takto koncipovaná léčba dosáhla KR u 1/3 nemocných, hematologickou odezvu u 60–70 % jedinců s mediánem do dosažení 4,5 měsíců a s prokazatelným zlepšením funkce postižených orgánů, přičemž doba do progrese činila 3,8 a OS 5,1 roku [44]. V případě potenciální perspektivní možnosti VDT-ATKB je doporučován nejprve sběr krvetvorných buněk.
Vysokodávková chemoterapie s autologní transplantací krvetvorných buněk
V současnosti je nejúčinnější terapií systémové AL-amyloidózy VDT-ATKB, neboť dosahuje zřetelně příznivějších výsledků nežli standardní chemoterapie režimem MP [45]. Původně vysoká TRM vedla k vypracování indikačních kritérií, vedoucích ale k podstatnému snížení zastoupení nemocných indikovaných k VDT-ATKB na 12 % [46–48]. Dle kritérií vypracovaných na Mayo klinice jsou k VDT-ATKB indikováni pouze nemocní s přítomností biopticky prokázané, symptomatické formy systémové AL-amyloidózy, s vyloučením MM, ve věku ≤ 70 let, s tloušťkou interventrikulárního septa < 15 mm, EF (ejekční frakce) levé komory > 55 %, s hodnotou S-kreatininu < 177 μmol/l a s normální hodnotou bilirubinu [49]. Jiná doporučení považují za nepříznivý prognostický faktor počet postižených orgánů, kreatininovou clearence < 30 ml/min, přítomnost NS, městnavou srdeční slabost, neuropatii nebo hepatopatii s elevací hodnoty S-AF [50]. Nemocní s ≤ 2 těmito projevy měli mnohem delší OS i délku do progrese nemoci [50]. V současnosti je na Mayo klinice doporučována VDT-ATKB pouze u vybraných nemocných s příznivou klinickou kondicí („performans status“) ≥ 2 a při nepřítomnosti závažné komorbidity, postižení ≤ 2 orgánů, při nepřítomnosti závažné amyloidové kardiomyopatie s EF > 50 % a kategorií NYHA < 2 a při GF > 50 ml/min [47,49]. Při takto vymezené indikaci k VDT-ATKB je dosahováno léčebné odezvy u 70–80 % nemocných, KR v 33–51 %, zatímco TRM poklesla z původních 30 % na 8–13 % a délka OS se prodloužila na 41–68 měsíců s tím, že > 10 let žije 23 % nemocných [47,49]. V případě postižení srdce se doporučuje použít k mobilizaci krvetvorných buněk pouze granulocytární kolonie stimulujícího faktoru (G CSF) a vypuštění cyklu předtransplantačních cyklů cytoredukčního indukčního režimu [48].
K omezení toxicity a využití léčebného potenciálu VDT-ATKB byl zkoncipován princip tzv. „risk adapted therapy“, vycházející z individuální stratifikace podle věku, tíže amyloidové kardiomyopatie (EF a NYHA) a nefropatie (GF), rozdělující nemocné do kategorie s nízkým, středním a vysokým stupněm rizika [47,51,52]. Podle stupně individuální rizikovosti se používá v přípravném režimu dávky 100, 140 nebo 200 mg/m2. Tento přístup, vedoucí obvykle ke snížení dávky melfalanu v přípravném předtransplatačním režimu, vede k podstatnému poklesu TRM, i když do jisté míry na úkor léčebné účinnosti [47,48,51]. V případě perzistence monoklonální plazmocelulární populace po tímto způsobem upravené VDT-ATKB jsou nemocní následně léčeni kombinací thalidomidu a dexametazonu. Při takto upravené terapii dosahuje KR 36 %, orgánová remise 44 % a hematologická remisi 71 %, přičemž nemocných s 2letým přežitím je 84 % a TRM pouze 4,4 % [52]. Další, obdobně koncipované studie dosáhly podobných výsledků s OS 68 měsíců, což potvrzuje účelnost tohoto individuálně modifikovaného terapeutického přístupu [51]. Pouze jediná studie, IFM 2005 („Intergroupe Francophone du Myélome“), neprokázala přínos VDT-ATKB nad konvenční léčbou režimem M-Dex [53]. Hlubší rozbor ale ukázal, že k nedostatkům studie patřila benevolentní indikační kritéria a svěření VDT-ATKB terciálním pracovištím s nedostatečnou zkušeností s nároky kladenými na transplantační léčbu. Výběr nemocných k VDT-ATKB u systémové AL-amyloidózy musí být velmi obezřetný, neboť jde o terapii vysoce selektivní, jež by měla být zajišťována pouze ve vysoce specializovaných transplantačních centrech. Pouze respektování těchto zásad s přísnou individuální indikační selekcí k VDT-ATKB je schopno přinést nemocnému s AL-amyloidózou očekávaný prospěch [54].
Imunomodulační terapie
V léčbě systémové AL-amyloidózy se neuplatnily snahy o aktivní vakcinaci, pasivní imunoterapii ani pokusy o využití interferonu α. Zato ve velice příznivém světle se ukázalo začlenění thalidomidu [55], bortezomibu a lenalidomidu v období selhání chemoterapie, v progresi nebo relapsu nemoci. Při léčbě thalidomidem by ale denní dávka neměla překročit 200 mg a měla by být spojena se současným podáváním dexametazonu [56]. Ve velmi příznivém světle se jako léčba 2. linie, tj. v případě prvotní léčebné rezistence, progrese či relapsu nemoci ukázal režim CTD (cyklofosfamid, thalidomid a dexametazon) s modifikací dávek dle věku a orgánového, zejména kardiálního postihu [54,57]. Tato léčba se jeví vhodnou v případě relapsu po terapii M-Dex i po VDT-ATKB, neboť dosahuje orgánové odezvy u 31 %, hematologické odezvy u 48 % [57]. Předběžné velmi příznivé zkušenosti byly získány i v případě léčby rezistentní nebo progredující formy AL-amyloidózy po předchozí VDT-ATKB lenalidomidem (25–15 mg/den dle tolerance po 21 dnů v kombinaci s dexametazonem), dosahující celkové léčebné odezvy u 67–75 % nemocných [58,59]. Rovněž ve velmi příznivém světle se jeví v obdobné situaci a v kombinaci s dexametazonem terapie bortezomibem, příznivé zkušenosti s dosažením rychlé hematologické odezvy byly získány i s kombinovaným režimem MD-B (melfalan, dexametazon a bortezomib).
Antifibrilární terapie
Jedním z perspektivních cílů léčby AL-amyloidózy je prevence nebo reverze toxicity oligomerických amyloidových agregátů, tedy přímým zásahem do patogenetických mechanizmů fibrilogeneze [17]. Eprodisat (Fibrillex) přerušuje vazbu glykosaminoglykanu na amyloidové fibrily, účinkuje ale spíše u AA-amyloidózy [17]. Zkoumá se rovněž účinnost R-1-[6-[R-2-carboxy - pyrrolidin 1-yl]-6-oxo-hexanoyl] pyrrolidin 2-carboxylové kyseliny (CPHPC) vážící se na akcesorní molekuly SAP-komponenty a vedoucí ke snížení jeho hladiny v séru. V případě použití nízké, nemyelosupresivní dávky 4-iodo-4-deoxydoxorubicinu (IDOX) způsobujícím disagregaci fibril in vivo i in vitro bylo dosaženo orgánové odezvy u 15 % nemocných [60].
Podpůrná léčba
Komplexní podpůrná léčba systémové AL-amyloidózy zaměřená na potlačení projevů nemoci a zlepšení funkce orgánů je integrální součástí terapie, ovlivňující do značné míry úroveň kvality i délku života. V případě městnavé srdeční slabosti se postupuje podle zavedených zásad s tím, že je kontraindikována terapie digoxinem pro jeho toxicitu způsobenou vazbou na amyloidové fibrily, relativně kontraindikována je i léčba beta blokátory a blokátory kalciového kanálu, zejména v případě vyjádřené diastolické dysfunkce [3,17,30]. Jistá opatrnost je nezbytná při použití léčby diuretiky, neboť zejména při hypoproteinemii u NS spojené s posturální hypotenzí není snižování intravaskulárního objemu žádoucí. V případě opakovaných synkopálních stavů je vhodná implantace pacemakeru, při opakování komorových arytmií je vhodná léčba amiodaronem. V situaci vyjádřené dysfunkce autonomního nervového systému s hypotenzí je nezbytná velká obezřetnost s terapií inhibitory angiotenzin konvertujícího enzymu. Hypotenzi, zhoršovanou navíc i srdeční slabostí a hypoproteinemií, lze ovlivnit nošením elastických punčoch a terapií a agonisty typu midodrinu, neuropatické bolesti lze zmírnit terapií gabapentinem. Amyloidová nefropatie je neobyčejně citlivá na podání aminoglykosidů a nitrožilních jodových kontrastních látek vedoucích ke zhoršení renální funkce, v konečné fázi renálního selhání je nutná chronická hemodialyzační léčba. Diarea, způsobená přímým postižením GIT i v rámci autonomní neuropatie, je ovlivnitelná oktreotidem, nauzea metoclopramidem či cisapridem. V případě projevů hemoragické diatézy je nezbytná substituční terapie krevními destičkami a koncentráty chybějících koagulačních faktorů, v případě nezbytnosti biopsie jater nebo ledviny se upřednostňuje transjugulární přístup. Individuálně lze provést, v případě dosažení KR po VDT-ATKB, transplantaci ledviny, výjimečně i srdce nebo jater. Značným problémem je ale získání vhodného štěpu a nebezpečí rekurence amyloidózy v transplantovaném orgánu v rámci opětovné progrese AL-amyloidózy [3,61].
Závěr
Systémová AL-amyloidóza se stala díky pokrokům v poznání patogeneze, v diagnostice, v monitorování průběhu nemoci a v situaci stále se rozšiřující palety nových léčebných postupů podstatně lépe zvladatelnou chorobou s podstatně příznivější prognózou, kdy medián celkového přežití dosáhl ve specializovaných centrech délky > 4–5 let a kdy více nežli 1/5 nemocných se může dožít > 10 let. Je ale nanejvýš důležité, aby se se záludností časné diagnostiky i možnostmi současné léčby co nejlépe seznámili především praktičtí lékaři a odborní internisté, kteří nepochybně drží ve svých rukou klíč k podstatnému zlepšení osudu nemocných s touto dříve tak obtížně léčitelnou a devastující chorobou.
Podpora grantu IGA MZ, NR 9500-3.
prof. MUDr. Vlastimil Ščudla, CSc.www.fnol.cz
e mail: vlastimil.scudla@fnol.czDoručeno do redakce: 16. 4. 2009
Zdroje
1. Adam Z, Ščudla V. Klinické projevy a diagnostika AL-amyloidózy a některých dalších typů amyloidóz. Vnitř Lék 2001; 47 : 36–45.
2. Falk RH, Skinner M. The systemic amyloidoses: an overview. Adv Intern Med 2000; 45 : 107–137.
3. Guidelines on the diagnosis and management of AL amyloidosis. Br J Haematol 2004; 125 : 681–700.
4. Gertz MA, Hayman SR. Imunoglobulin light chain amyloidosis. In: Rajkumar SV, Kyle RA. Treatment of multiple myeloma and related disorders. Cambridge: Cambridge University Press 2009 : 112–128.
5. Sanchorawala V. Light‑chain (AL) amyloidosis, diagnosis and treatment. Clin J Am Soc Nephrol 2006; 1 : 1331–1341.
6. Merlini G. AL amyloidosis: diagnosis and prognosis. Haematologica 2007; 92 (Suppl 2): 58–59.
7. Rajkumar SV, Glassock RJ, Kyle RA et al. Diagnosis of primary (AL) amyloidosis. Available from: www.uptodate.com.
8. Kyle RA, Gertz MA. Primary systemic amyloidosis: clinical and laboratory features in 474 cases. Semin Hematol 1995; 32 : 45–59.
9. Palladini G, Perfetti V, Merlini G. Therapy and management of systemic AL (primary) amyloidosis. Swiss Med Wkly 2006; 136 : 715–720.
10. Kyle RA, Linos A, Beard CM et al. Incidence and natural history of primary systemic amyloidosis in Olmsted County, Minnesota, 1950 through 1989. Blood 1992; 79 : 1817–1822.
11. Gorevic PD, Schur PH, Greene JM. An overview of amyloidosis. Available from: www.uptodate.com.
12. Rajkumar SV, Glassock RJ, Kyle RA et al. Pathogenesis and clinical features of primary (AL) amyloidosis and light and heavy chain deposition diseases. Available from: www.uptodate.com.
13. Kaplan B, Livneh A, Gallo G. Charge differences between in vivo deposits in immunoglobulin light chain amyloidosis and non‑amyloid light chain deposition disease. Br J Haematol 2007; 136 : 723–728.
14. Comenzo RL, Wally J, Kica G et al. Clonal immunoglobulin light chain variable region germline gene use in AL amyloidosis: association with dominant amyloid‑related organ involvement and survival after stem cell transplantation. Br J Haematol 1999; 106 : 744–751.
15. Kisilevsky R. The relation of proteoglycans, serum amyloid P and apo E to amyloidosis current status. Amyloid 2000; 7 : 23–25.
16. McLaurin J, Yang D, Yip CM et al. Review: modulating factors in amyloid‑beta fibril formation. J Struct Biol 2000; 130 : 259–270.
17. Seldin DC, Sanchorawala V. Adapting to AL amyloidosis. Haematologica 2006; 91 : 1591–1595.
18. Palladini G, Lavatelli F, Russo P et al. Circulating amyloidogenic free light chains and serum N‑terminal natriuretic peptide type B decrease simultaneously in association with improvement of survival in AL. Blood 2006; 107 : 3854–3858.
19. Harrison CJ, Mazzullo H, Ross FM et al. Translocations of 14q32 and deletions of 13q14 are common chromosomal abnormalities in systemic amyloidosis. Br J Haematol 2002; 117 : 427–435.
20. Kyriakides T, Marquez B, Panousopoulos A et al. Amyloid myopathy: evidence for mechanical injury to the sarcolemma. Clin Neuropathol 2002; 21 : 145–148.
21. Fautrel B, Fermand JP, Sibilia J et al. Amyloid arthropathy in the course of multiple myeloma. J Rheumatol 2002; 29 : 1473–1481.
22. Mumford AD, O’Donnell J, Gillmore JD. Bleeding symptoms and coagulation abnormalities in 337 patients with AL-amyloidosis. Br J Haematol 2000; 110 : 454–460.
23. Kyle RA, Gertz MA. Primary systemic amyloidosis: Clinical and laboratory features in 474 cases. Semin Hematol 1995; 32 : 45–59.
24. Gertz MA, Greipp PR, Kyle RA. Classification of amyloidosis by the detection of clonal excess of plasma cells in the bone marrow. J Lab Clin Med 1991; 118 : 33–39.
25. Westermark P, Benson L, Juul J et al. Use of subcutaneous abdominal fat biopsy specimen for detailed typing of amyloid fibril protein‑AL by amino acid sequence analysis. J Clin Pathol 1989; 42 : 817–819.
26. Bradwell AR. Serum free light chain analysis. 4th ed. Birmingham: The Binding Site Ltd 2006.
27. Katzmann JA, Abraham RS, Dispenzieri A et al. Diagnostic performance of quantitative kappa and lambda free light chain assays in clinical practice. Clin Chem 2005; 51 : 878–881.
28. Lachmann HJ, Gallimore R, Gillmore JD et al. Outcome in systemic AL amyloidosis in relation to changes in concentration of circulating free immunoglobulin light chains following chemotherapy. Br J Haematol 2003; 122 : 78–84.
29. Bochtler T, Hegenbart U, Cremer FW et al. Evaluation of the cytogenetic aberration pattern in amyloid light chain amyloidosis as compared with monoclonal gammopathy of undetermined significance reveals common pathways of karyotypic instability. Blood 2008; 111 : 4700–4705.
30. Gertz MA, Comenzo R, Falk RH et al. Definition of organ involvement and treatment response in immunoglobulin light chain amyloidosis (AL): a consensus opinion from the 10th International symposium on amyloid and amyloidosis, Tours, France, 18–22 April 2004. Am J Hematol 2005; 79 : 319–328.
31. Palladini G, Campana C, Klersy C et al. Serum N‑terminal pro‑brain natriuretic peptide is a sensitive marker of myocardial dysfunction in AL amyloidosis. Circulation 2003; 107 : 2440–2445.
32. Dispenzieri A, Kyle RA, Gertz MA et al. Survival in patients with primary systemic amyloidosis and raised serum cardiac troponins. Lancet 2003; 361 : 1787–1789.
33. Hawkins PN. Serum amyloid P component scintigraphy for diagnosis and monitoring amyloidosis. Curr Opin Nephrol Hypertens 2002; 11 : 649–655.
34. Hazenberg BP, van Rijswijk MH, Piers DA et al. Diagnostic performance of 123-I-labeled serum amyloid P component scintigraphy in patients with amyloidosis. Am J Med 2006; 119 : 355–365.
35. Dispenzieri A, Lacy MQ, Katzmann JA et al. Absolute values of immunoglobulin free light chains are prognostic in patients with primary systemic amyloidosis undergoing peripheral blood stem cell transplantation. Blood 2006; 107 : 3378–3383.
36. Kyle RA, Gertz MA, Greipp PR et al. A trial of three regimens for primary amyloidosis: colchicine alone, melphalan and prednisone and melphalan, prednisone and colchicine. N Engl J Med 1997; 336 : 1202–1207.
37. Pardanani A, Witzig TE, Schroeder G et al. Circulating peripheral blood plasma cells as a prognostic indicator in patients with primary systemic amyloidosis. Blood 2003; 101 : 827–830.
38. Dominguez W, Weinberg P, Claros P et al. Primary localized nasopharyngeal amyloidosis. A case report. Int J Pediatr Otorhinolaryngol 1996; 36 : 61–67.
39. Glenner GG. Amyloid deposits and amyloidosis. The b-fibrilloses (first of two parts). N Engl J Med 1980; 302 : 1283–1292.
40. Lachmann HJ, Booth DR, Booth SE et al. Misdiagnosis of hereditary amyloidosis as AL (primary) amyloidosis. N Engl J Med 2002; 346 : 1786–1791.
41. Adam Z, Ščudla V, Tomíška M. Léčba AL-amyloidózy a některých dalších typů amyloidóz. Vnitř Lék 2001; 47 : 46–52.
42. Schey SA, Kazmi M, Ireland R et al. The use of intravenous intermediate dose melphalan and dexamethasone as induction treatment in the management of de novo multiple myeloma. Eur J Haematol 1998; 61 : 306–310.
43. Palladini G, Perfetti V, Obici L et al. Association of melphalan and high‑dose dexamethasone is effective and well tolerated in patients with AL (primary) amyloidosis who are ineligible for stem cell transplantation. Blood 2004; 103 : 2936–2938.
44. Palladini G, Russo P, Nuvolone M et al. Treatment with oral melphalan plus dexamethasone produces long‑term remissions in AL amyloidosis. Blood 2007; 110 : 787–788.
45. Dispenzieri A, Kyle RA, Lacy MQ et al. Superior survival in primary systemic amyloidosis patients undergoing peripheral blood stem cell transplantation: a case-control study. Blood 2004; 103 : 3960–3963.
46. Skinner M, Sanchorawala V, Seldin DC et al. High‑dose melphalan and autologous stem-cell transplantation in patients with AL amyloidosis: An 8-year study. Ann Intern Med 2004; 140 : 85–93.
47. Comenzo RL, Gertz MA. Autologous stem cell transplantation for primary systemic amyloidosis. Blood 2002; 99 : 4276–4282.
48. Gertz MA, Lacy MQ, Dispenzieri A et al. Risk‑adjusted manipulation of melphalan dose before stem cell transplantation in patients with amyloidosis is associated with a lower response rate. Bone Marrow Transplant 2004; 34 : 1025–1031.
49. Dispenzieri A, Lacy MQ, Kyle RA et al. Eligibility for hematopoietic stem-cell transplantation for primary systemic amyloidosis is a favorable prognostic factor for survival. J Clin Oncol 2001; 19 : 3350–3356.
50. Moreau P, Leblond V, Bourquelot P et al. Prognostic factors for survival and response after high‑dose therapy and autologous stem cell transplantation in systemic AL amyloidosis: A report on 21 patients. Br J Haematol 1998; 101 : 766–769.
51. Perfetti V, Siena S, Palladini G et al. Long‑term results of a risk‑adapted approach to melphalan conditioning in autologous peripheral blood stem cell transplantation for primary (AL) amyloidosis. Haematologica 2006; 91 : 1635–1643.
52. Cohen AD, Zhou P, Chou J et al. Risk‑adapted autologous stem cell transplantation with adjuvant dexamethasone ± thalidomide for systemic light‑chain amyloidosis: results of a phase II trial. Br J Haematol 2007; 139 : 224–233.
53. Jaccard A, Moreau P, Leblond V et al. High‑dose melphalan versus melphalan plus dexametasone for AL amyloidosis. N Engl J Med 2007; 357 : 1083–1093.
54. Rajkumar SV, Glassock RJ, Kyle RA et al. Prognosis and treatment of primary (AL) amyloidosis and light and heavy chain deposition disease. Available from: www.uptodate.com.
55. Dhodapkar MV, Hussein MA, Rasmussen E et al. Clinical efficacy of high‑dose dexamethasone with maintenance dexamethasone/alpha interferon in patients with primary systemic amyloidosis: results of United States Intergroup Trial Southwest Oncology Group (SWOG) S9628. Blood 2004; 104 : 3520–3526.
56. Palladini G, Perfetti V, Perlini S et al. The combination of thalidomide and intermediate‑dose dexamethasone is an effective but toxic treatment for patients with primary amyloidosis (AL). Blood 2005; 105 : 2949–2951.
57. Wechalekar AD, Goodman HJ, Lachmann HJ et al. Safety and efficacy of risk‑adapted cyclophosphamide, thalidomide, and dexamethasone in systemic AL amyloidosis. Blood 2007; 109 : 457–464.
58. Dispenzieri A, Lacy MQ, Zeldenrust SR et al. The activity of lenalidomide with or without dexamethasone in patients with primary systemic amyloidosis. Blood 2007; 109 : 465–470.
59. Sanchorawala V, Wright DG, Rosenzweig M et al. Lenalidomide and dexamethasone in the treatment of AL amyloidosis: results of a phase 2 trial. Blood 2007; 109 : 492–496.
60. Gertz MA, Lacy MQ, Dispenzieri A et al. A multicenter phase II trial of 4’ - iodo-4’-deoxydoxorubicin (IDOX) in primary amyloidosis (AL). Amyloid 2002; 9 : 24–30.
61. Gillmore JD, Goodman HJ, Lachmann HJ et al. Sequential heart and autologous stem cell transplantation for systemic AL amyloidosis. Blood 2006; 107 : 1227–1229.
Štítky
Diabetológia Endokrinológia Interné lekárstvo
Článek Léčba hypertenze u obezityČlánek Histiocytární choroby
Článok vyšiel v časopiseVnitřní lékařství
Najčítanejšie tento týždeň
2009 Číslo Supplementum 1- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
- Intermitentní hladovění v prevenci a léčbě chorob
- Rizikové období v léčbě růstovým hormonem: přechod mladých pacientů k lékařům pro dospělé
- Statinová intolerance
- Monoklonální protilátky v léčbě hyperlipidemií
-
Všetky články tohto čísla
- Zmeny vo funkčnom renálnom náleze po maratónskom behu, po 100-kilometrovom behu a po 24-hodinovom dlhotrvajúcom behu
- Zájem pana doc. MUDr. Dušana Mrkose, CSc., o vzácné choroby předběhl o mnoho let program EU zaměřený na vzácné nemoci
- Histiocytární choroby
- Diferenciální diagnostika eozinofilie
- Léčba hypertenze u obezity
- Zahraniční styky Československé hematologické společnosti v letech 1951– 1989
- Vývoj oboru klinické hematologie dospělých v Brně do 90. let minulého století (vzpomínky klinického hematologa)
-
XXVIII. dny mladých internistů
Olomouc, 4.–5. 6. 2009 - Rozdíly mezi muži a ženami u akutního srdečního selhání
- Nová klasifikace Ph negativních chronických myeloproliferativních nemocí v přehledu
- Akutní krvácení z horní části gastro intestinálního traktu
- K významnému životnímu jubileu emeritního editora časopisu Vnitřní lékařství doc. MUDr. Dušana Mrkose, CSc.,
- Di abetik, paci ent internisty
- Indikace k vyšetření rizikových faktorů žilní trombózy
- Hemofili e z pohledu vývoje zajištění péče o nemocné
- Dětské nádory metastazující do kostní dřeně a jejich hematologický obraz
- Přetížení železem – novinky v patogenezi a léčbě
- Koloběhy života aneb doc. MU Dr. Dušan Mrkos, CSc., devadesátníkem
- Léčba chronické myeloidní leukemie (CML) v éře imatinibu
- Maligní lymfomy trávicího traktu
- Současné možnosti diagnostiky a léčby systémové AL-amyloidózy
- Problematika porúch hemostázy pri metabolickom syndróme
- Léčba chronického srdečního selhání v interní ambulanci
- Protrombotický stav pri NAFLD a jeho dôsledky
- Liečba diabetika s ischemickou chorobou srdca
- Vnitřní lékařství
- Archív čísel
- Aktuálne číslo
- Iba online
- Informácie o časopise
Najčítanejšie v tomto čísle- Diferenciální diagnostika eozinofilie
- Přetížení železem – novinky v patogenezi a léčbě
- Histiocytární choroby
- Akutní krvácení z horní části gastro intestinálního traktu
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



