-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Kandidová sepse jako komplikace u pacienta s polytraumatem
Candid sepsis as a complication in a polytrauma patient
We describe a case of a patient with traumatic rupture of the spleen and liver, which was complicated by candid sepsis. The infection was endogenous, originating from the bowel. Empirical therapy with echinocandin was started. The diagnosis was confirmed by finding Candida krusei and Candida glabrata in abdominal tube secretion culture and also in blood culture. The sepsis was successfully treated. The patient died because of complications not related to the candid sepsis.
Keywords:
traumatic rupture of spleen and liver – endogenous infection – candid sepsis – candidaemia – echinocandin
Autoři: Sas Igor; Straževská Eva; Hrdý Ondřej; Gál Roman
Působiště autorů: Klinika anesteziologie, resuscitace a intenzivní medicíny, Fakultní nemocnice Brnoa Lékařská fakulta Masarykovy univerzity, Brno
Vyšlo v časopise: Anest. intenziv. Med., 25, 2014, č. 3, s. 212-215
Kategorie: Intenzivní medicína - Kazuistika
Souhrn
Popisujeme případ pacienta s traumatickou rupturou jater a sleziny a poraněním hrudníku komplikovaný rozvojem kandidové sepse. Jednalo se o endogenní infekci se zdrojem v gastrointestinálním traktu. Léčbu jsme zahájili empiricky echinokandinem. Diagnóza byla potvrzena kultivačně v sekretu z břišního drénu i z hemokultur – Candida krusei a Candida glabrata. Sepse byla úspěšně vyléčena. Pacient zemřel na komplikace nesouvisející s kandidovou sepsí.
Klíčová slova:
traumatická ruptura jater a sleziny – endogenní infekce – kandidová sepse – kandidémie – echinokandinÚVOD
Invazivní kandidové infekce a kandidémie se vyskytují v nemocničních podmínkách stále častěji. Významně ovlivňují morbiditu a mortalitu pacientů v intenzivní péči.
V 80. letech 20. století byla incidence hematogenních kandidóz 2–5%, v 90. letech byly kandidy příčinou nozokomiálních hematogenních infekcí v 8–10 %. V současné době zaujímají kandidy mezi původci infekcí krevního řečiště čtvrté místo(6 až 11 %) a jsou zatíženy nejvyšší mortalitou (40%) [1, 2].
Nejčastějším vyvolávajícím agens invazivních kandidových infekcí a kandidémií zůstává kmen Candida albicans. V současnosti však dochází k nárůstu izolací non-albicans kmenů, zejména Candida glabrata a Candida parapsilosis, následované Candida tropicalis a Candida krusei [3]. Znalost tohoto vývoje je důležitá, neboť většina kmenů C. glabrata a všechny kmeny C. krusei jsou rezistentní k fluconazolu.
Celá řada autorů se pokoušela identifikovat nezávislé faktory schopné predikovat rozvoj invazivní kandidózy a použít těchto faktorů k tvorbě klinicky relevantního skórovacího systému, který by přispěl k rozpoznání kandidové infekce a k použití ideálního léčebného schématu. Nejznámější je tzv. Kandida skóre, kdy Leon et al. zpracovali potenciální rizikové faktory vzniku invazivní kandidózy u 1 699 nemocných na JIP. Z logistické regresní analýzy byly definovány rizikové faktory s největší predikční váhou. Při 81% senzitivitě a 74% specificitě byla stanovena hranice 2,5 bodu, při které významně (7,75krát) narůstá riziko invazivní kandidózy (tab. 1) [4].
Tab. 1. Kandida skóre u non-neutropenických nemocných 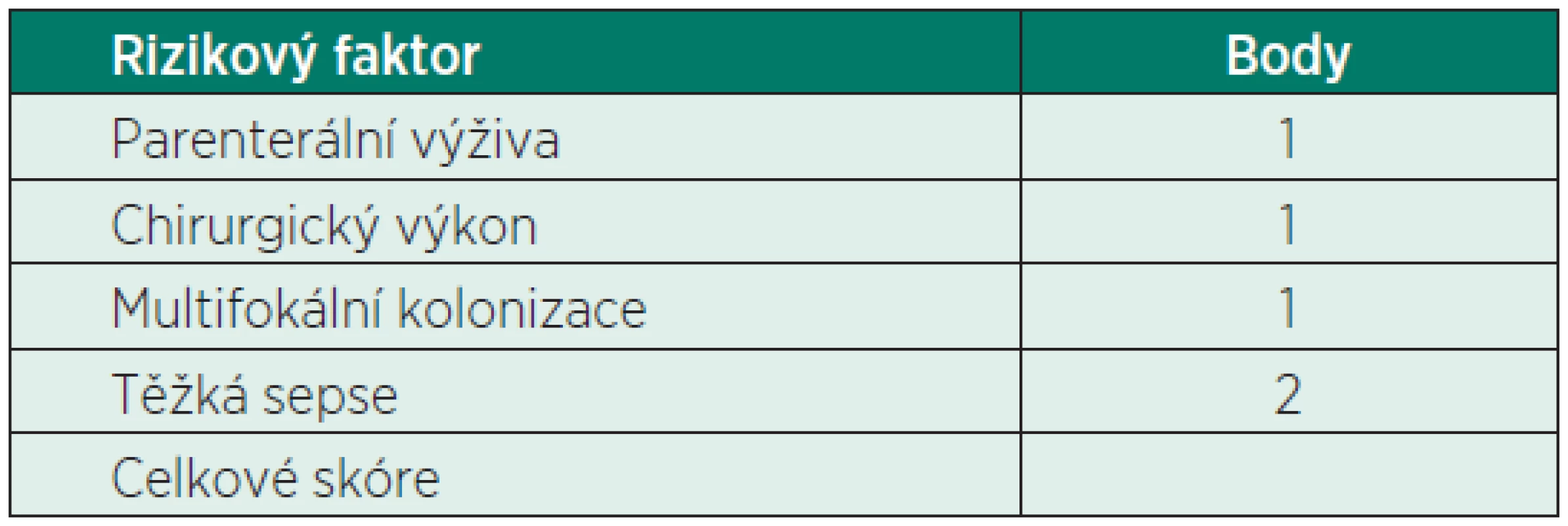
Nicméně stanovení diagnózy invazivní kandidové infekce u nemocných v intenzivní péči zůstává stále velkou výzvou a bývá často opožděné. Tento fakt můžeme vysvětlit přítomností mnoha faktorů, které ztěžují včasnou diagnostiku. Klinický průběh kandidové infekce je totiž nespecifický, nálezy z hemokultur jsou často negativní, s výjimkou pozdních fází infekce; o výtěžnosti sérologických testů se stále diskutuje [5].
POPIS PŘÍPADU
V dubnu 2012 byl na oddělení urgentního příjmu Kliniky anesteziologie, resuscitace a intenzivní medicíny Fakultní nemocnice Brno přivezen 45letý pacient po pádu ze střechy z výšky cca 5 metrů.
Podle sdělení lékaře záchranné služby byl pa-cient na místě nehody při vědomí, bledý, opocený, hypotenzní (TK 95/50 torr, TF 115/min.), stěžoval si na bolest pravého hemitoraxu, kde bylo poslechově dorzo-bazálně oslabené dýchání. Kromě oděrek nad pravým loktem nejevil žádné jiné známky zevního poranění. Bylo vysloveno podezření na poranění hrudníku, zajištěn jeden periferní žilní vstup, pacient byl analgosedován (fentanyl, midazolam), zaintubován a napojen na transportní ventilátor. Během 60minutového transportu mu bylo podáno 1000 ml krystaloidů, oběh byl podporován kontinuálním podáním noradrenalinu.
Při předání na oddělení urgentního příjmu jevil pacient známky hemoragického šoku – bledost, hypotenze (TK 70/35 torr), tachykardie (TF 160/min).
Pacientovi jsme zajistili další 2 žilní vstupy (1krát cestou v. jugularis externa a 1krát cestouv. femoralis l.sin.), zahájili hemoterapii (podáno6 jednotek erytrocytárního koncentrátu 0 Rh negat., 6 jednotek čerstvé mražené plazmy skupiny AB, 2 g fibrinogenu a 600 IU Prothromplexu) a pokračovali jsme ve volumoterapii a podpoře oběhu noradrenalinem. Souběžně jsme provedli celotělový CT scan s nálezem hemoperitonea, ruptury sleziny, ruptury jater, fraktury V.–VII. žebra a nevýznamným hemotoraxem vpravo.
Pacienta jsme akutně převezli na operační sál k operační revizi dutiny břišní. Předoperačně jsme mu podali intravenózně 1,5g ampicilinu/sulbaktamu.
Příjmové laboratorní hodnoty: hemoglobin 65 g/l, trombocyty 100 x 109/l, INR 2,1, pH 7,14, laktát 11 mmol/l, etanol 2,7 ‰, AST 2,54 µkat/l, GGT 9,58 µkat/l. APACHE II skóre 28, predikovaná nemocniční mortalita 63,9%.
Chirurg provedl splenektomii a krvácení z fisury jater ošetřil břišními rouškami, které ponechal v peritoneální dutině. Peroperačně byla zjištěna cirhóza jater, po doplnění anamnézy byl potvrzen chronický abúzus alkoholu.
Po výkonu jsme pacienta přijali na lůžkové oddělení Kliniky anesteziologie, resuscitace a intenzivní medicíny. Pokračovali jsme v hemoterapii a volumoterapii. Pacientův klinický stav i laboratorní hodnoty se postupně stabilizovaly. Celková krevní ztráta byla odhadem 6 000 ml, během výkonu jsme podali 14 jednotek erytrocytárního koncentrátu, 14 jednotek čerstvé mražené plazmy, 4 jednotky trombocytárního koncentrátu a 20,8 mg Novosevenu.
Pacienta jsme ponechali analgosedovaného(sufentanil + midazolam), na umělé plicní ventilaci a pokračovali jsme v intravenózním podávání ampicilinu/sulbaktamu v dávce 1,5 g po 6 ho-dinách.
Po 48 hodinách chirurg provedl plánovanou revizi dutiny břišní, odstranil roušky a vzhledem k tomu, že neshledal žádné známky krvácení, břišní dutinu definitivně uzavřel. V tentýž den jsme odebrali materiál na mikrobiologické vyšetření: tracheální aspirát, stěr z dutiny ústní, moč a sekret z břišního drénu. Zahájili jsme vysazování sedace.
Třetí den hospitalizace se pacient probudil do plného kontaktu, byl oběhově stabilní, bez známek krvácení. Odpojili jsme ho od ventilátoru a bez komplikací extubovali.
Pátý den hospitalizace se pacient klinicky zhoršil ve smyslu nástupu febrilií, následně i oběhové nestability (hypotenze, tachykardie), byl tekutinově dependentní, vyžadoval podporu oběhu noradrenalinem, měl kvalitativní poruchu vědomí ve smyslu dezorientace. Klinicky ani laboratorně nejevil známky krvácení, došlo však k výrazné elevaci zánětlivých parametrů: leukocyty 17,6 x 109/l, CRP 240 mg/l, PCT 6 µg/l (tab. 2). Klinický stav pacienta odpovídal těžké sepsi/septickému šoku. Neodkladně jsme zahájili terapii a diagnostiku podle Surviving Sepsis Campaing guidelines. Podávali jsme tekutiny, odebrali jsme materiál na mikrobiologické vyšetření včetně hemokultur. Vzhledem k délce hospitalizace pacienta (5 dní) jsme pomýšleli na možnost nozokomiální infekce. Výsledky předchozích mikrobiologických odběrů byly zatím předběžné. Z dutiny ústní Candida spp., ze sekretu z břišního drénu Enterococcus spp., Pseudomonas aeruginosa a Candida spp., tracheální aspirát a moč byly kultivačně negativní. Antibiotika a antimykotika jsme tedy nasadili empiricky: meropenem 2 g po 8 hodinách, ampicilin 2 g po 6 hodinách a echinokandin – kvůli hepatopatii/cirhóze pacienta jsme volili anidulafungin v úvodní dávce 200 mg a poté 100 mg po 24 hodin. Vyměnili jsme invazivní vstupy (centrální venózní katétr, arteriální katétr).
Provedli jsme rentgen hrudníku, CT břicha a hlavy, vše s negativním výsledkem.
Šestý den hospitalizace jsme upravili antibiotickou terapii s výměnou ampicilinu za linezolid, neboť kmen Enteroccocus faecium vykultivovaný ze sekretu z břišního drénu byl vankomycin rezistentní.
Bylo dokončeno určení druhů kandid – z dutiny ústní C. krusei a ze sekretu z břišního drénu C. krusei a C. glabrata. Oba tyto druhy kandid byly následně zachyceny i v hemokulturách odebraných v den rozvoje septického šoku. Domníváme se, že zdrojem kandid byl pacientův gastrointestinální trakt, který prošel během hemoragického šoku významnou hypoperfuzí. Vzhledem k druhu kandid a těžkému průběhu onemocnění jsme anidulafungin v terapii ponechali.
Průběh sepse byl komplikován akutním renálním selháním s nutností hemodialýzy. Došlo také k dekompenzací pacientovy chronické hepatopatie/cirhózy ve smyslu hyperbilirubinémie a koagulopatie. Nicméně infekci se dařilo dobře kontrolovat a pacientův klinický stav se postupně lepšil. Průběh onemocnění se zkomplikoval rozvojem těžké polyneuropatie a myopatie kriticky nemocných, která výrazně limitovala možnost odpojení pacienta od ventilátoru. Pacientovi jsme proto 15. den hospitalizace provedli tracheostomii. Sedmnáctý den hospitalizace byly zánětové markery nízké: CRP 12 mg/l, PCT 0,6 µg/l a leukocyty 8,7 x 109/l (viz tab. 2) a mikrobiologické odběry byly negativní. Vysadili jsme tedy antibiotika, anidulafungin jsme ponechali ještě 2 týdny od posledního pozitivního kultivačního nálezu.
Tab. 2. Dynamika markerů zánětu 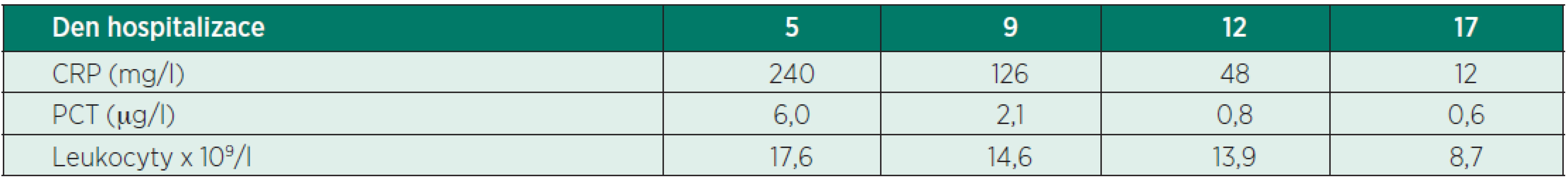
CRP – C-reaktivní protein, PCT – procalcitonin Pacienta jsme odpojili od ventilátoru 22. den hospitalizace, 24. den hospitalizace byl pacient při vědomí, orientovaný, oběhově stabilní, spontánně ventiloval přes tracheostomii, operační rána byla zhojena, rehabilitoval do sedu na lůžku. Přetrvávala hyperbilirubinémie a koagulopatie při cirhóze jater.
Na další, tedy 25. den hospitalizace jsme domluvili překlad pacienta na jednotku intenzivní péče Interní gastroenterologické kliniky FN Brno k nastavení terapie chronického jaterního onemocnění. V den překladu v ranních hodinách se pacientův stav zkomplikoval významnou hematemézou. Zdrojem krvácení byly jícnové varixy. Gastroenterolog provedl akutní endoskopické ošetření jícnových varixů ligací a sklerotizací. Po této epizodě došlo k další progresi jaterního selhání, progredovala hyperbilirubinémie i koagulopatie. Hepatolog vzhledem k anamnéze chronického ethylismu neindikoval zařazení pacienta do transplantačního programu, a tedy ani překlenutí jaterního selhání eliminační metodou. Pokračovali jsme v konzervativní terapii jaterního selhání.
Stav pacienta se 28. den hospitalizace zkomplikoval rozvojem pravostranné pneumonie. Původcem byla polyrezistentní Pseudomonas aeruginosa, citlivá pouze na kolistin, který jsme podávali intravenózně i inhalačně. Pacienta jsme museli znovu napojit na ventilátor. Tato komplikace v kombinaci s dekompenzovaným chronickým jaterním onemocněním/cirhózou byla pro pacienta fatální a přes plnou intenzivní terapii pacient 33. den hospitalizace zemřel.
DISKUSE
Adekvátní a včasná terapie invazivních mykotických infekcí je nejdůležitějším faktorem spojeným s dobrou prognózou. Parkins et al. ve své studii na 207 pacientech prokázali významně snížené riziko smrti ve skupině pacientů s adekvátní empirickou léčbou invazivní kandidózy nebo kandidémie [6].
Jedním z významných nástrojů v diagnostice kandidové infekce je i určení rizika jejího rozvoje. Možné rizikové faktory byly stanoveny na základě mnoha studií a jsou používány k identifikaci pacientů s potřebou preemptivní nebo empirické terapie. Všeobecně přijímané rizikové faktory invazivních kandidových infekcí jsou tyto: neutropenie, chemoterapie pro nádorové onemocnění, kolonizace kmeny Candida spp. (> 2 ložiska), léčba širokospektrými antibiotiky a jejich kombinacemi (> 3 antibiotika), centrální žilní katétr, hemodialýza, závažnost onemocnění (APACHE II skóre > 15), parenterální výživa, umělá plicní ventilace, chirurgický výkon, věk, diabetes, popáleniny, doba hospitalizace > 20 dní, pobyt na JIP >3 dny, transplantace orgánů nebo kostní dřeně, kortikosteroidy, imunosupresiva, opakované krevní převody, močový katétr zavedený > 7 dní [2, 7, 8].
Pacient z naší kazuistiky měl hned několik rizikových faktorů. Vstupní APACHE II skóre bylo 28, podstoupil opakovaný chirurgický výkon s masivními krevními převody, měl centrální žilní katétr, byl uměle ventilován a v době vzniku sepse byl hospitalizován na JIP 5 dní. Jeho Kandida skóre bylo 4 body – težká sepse, multifokální kolonizace (dutina ústní a sekret z břišního drénu) a operační výkon. Proto jsme již od počátku pomýšleli na možnost kandidové sepse. Kromě empirické antibiotické terapie jsme proto zahájili i empirickou terapii antimykotickou. Vzhledem k tíži klinického stavu pacienta (septický šok) jsme volili echinokandin.
V léčbě echinokandinem jsme pokračovali i po stabilizaci klinického stavu pacienta, k deeskalaci jsme nepřistoupili s ohledem na vykultivované kmeny kandid – C. glabrata a C. krusei. Léčbu echinokandinem jsme ponechali 14 dní po poslední pozitivní kultivaci tak, jak je doporučováno [9].
Díky včasné empirické terapii se podařilo kandidovou sepsi zvládnout. Ke smrti pacienta vedly dvě skutečnosti, a to dekompenzace chronického jaterního onemocnění a pozdní ventilátorová pneumonie způsobená polyrezistentním kmenem Pseudomonas aeruginosa.
ZÁVĚR
V posledních letech lze pozorovat trend k preferenci včasné empirické a preemptivní antimykotické terapie. Tento přístup snižuje morbiditu i mortalitu kriticky nemocných pacientů a zkracuje dobu pobytu na jednotkách intenzivní péče.
U pacientů s nestabilním oběhem, s předchozí léčbou azoly nebo kolonizovaných azol-rezistentními kmeny Candida spp. je preferováno použití echinokandinů. Empirická léčba flukonazolem je určena pro pacienty, kteří nejsou kriticky nemocní.
Konflikt zájmů: Autoři v minulosti přednesli sdělení, týkající se problematiky mykotických infekcí, honorované firmami Pfizer a Astellas.
Do redakce došlo dne 15. 11. 2013.
Do tisku přijato dne 1. 3. 2014.
Adresa pro korespondenci:
MUDr. Igor Sas
KARIM FN Brno
Jihlavská 20
62500 Brno
e-mail: igor.sas@fnbrno.cz
Zdroje
1. Wisplinghoff, H., Bischoff, T., Tallent, S. M., Seifert, H., Wenzel, R. P., Edmond, M. B. Nosocomial bloodstream infections in US hospitals: analysis of 24, 179 cases from a prospective nation-wide surveillance study. Clin. Infect. Dis., 2004, 39, p. 309–317.
2. Pfaller, M. A., Diekema, D. J. Epidemiology of invasive candidiasis: a persistent public health problem. Clin. Microbiol. Rev., 2007, 20, p. 133–163.
3. Shorr, A. F., Lazarus, D. R., Sherner, J. H., Jackson, W. L., Morrel, M., Fraser, V. J., Kollef, M. H. Do clinical features allow for accurate prediction of fungal pathogenesis in bloodstream infections? Potential implications of the increasing prevalence of non-albicans candidemia. Crit. Care Med., 2007, 35, p. 1077–1083.
4. Leon, C., Ruiz-Santana, S., Saavedra, P., Almirante, B., Nolla--Salas, J., Alvarez Lerma, F., Garnacho-Montero, J., Leon, M. A. A bedside scoring system (‘‘Candida score’’) for early antifungal treatment in nonneutropenic critically ill patients with Candida colonization. Crit. Care Med., 2006, 34, p. 730–737.
5. Fluckiger, U., Marchetti, O., Bille, J., Eggimann, P., Zimmerli, S., Imhof, A., Garbino, J., Ruef, C., Pittet, D., Tauber, M., Glauser, M.,Calandra, T. Treatment options of invasive fungal infections in adults. Swiss Med. Weekly, 2006, 136, p. 447–463.
6. Parkins, M. D., Sabuda, D. M., Elsayed, S., Laupland, K. B. Adequacy of empirical antifungal therapy and effect on outcome among patients with invasive Candida species infections.J. Antimicrob. Chemother., 2007, 60, p. 613–618.
7. Blumberg, H. M., Jarvis, W. R., Soucie, J. M., Edwards, J. E., Patterson, J. E., Pfaller, M. A., Rangel-Frausto, M. S., Rinaldi, M. G., Saiman, L., Wiblin, R. T., Wenzel, R. P. Risk factors for candidal bloodstream infections in surgical intensive care unit patients: the NEMIS prospective multicenter study. The National Epidemiology of Mycosis Survey. Clin. Infect. Dis., 2001, 33, p. 177–186.
8. Sobel, J. D., Rex, J. H. Invasive candidiasis: turning risk into a practical prevention policy? Clin. Infect. Dis., 2001, 33, p. 187–190.
9. Pappas, Peter G. et al. Clinical Practice Guidelines for the Management of Candidiasis: 2009 Update by the Infectious Diseases Society of America. Clinical Infectious Diseases, 2009, 48, p. 503-35. DOI 10.1086/596757
Štítky
Anestéziológia a resuscitácia Intenzívna medicína
Článok vyšiel v časopiseAnesteziologie a intenzivní medicína
Najčítanejšie tento týždeň
2014 Číslo 3- Realita liečby bolesti v paliatívnej starostlivosti v Nemecku
- MUDr. Lenka Klimešová: Multiodborová vizita je kľúč k efektívnejšej perioperačnej liečbe chronickej bolesti
- Metamizol v liečbe pooperačnej bolesti u opioid-tolerantnej pacientky – kazuistika
- e-Konzilium.cz — Masivní plicní embolie při tromboembolické nemoci
- DESATORO PRE PRAX: Aktuálne odporúčanie ESPEN pre nutričný manažment u pacientov s COVID-19
-
Všetky články tohto čísla
- Terapeutická hypotermie po zástavě oběhu - máme přestat? Ani náhodou!
- Bužií asistovaná koniotomie (BACT) na prasečím modelu – pilotní studie
- Kontinuální kaudální epidurální analgezie extrémně nedonošeného dítěte – kazuistika
- Postpunkční cefalea v porodnictví
- Úloha krátkodobých betablokátorů v anestezii a intenzivní péči
- Kandidová sepse jako komplikace u pacienta s polytraumatem
- Význam tromboelastografie (TEG) a tromboelastometrie (ROTEM) na jednotke intenzívnej starostlivosti
- Současné možnosti kontinuálního neinvazivního monitorování arteriálního tlaku
- Možnosti využití ultrazvuku u neuroaxiálních blokád
- Centrální žilní porty a jejich využití k zajištění dlouhodobého cévního přístupu
- Premedikace a lačnění
- Valsalvův manévr
- Consensus guidelines for the management of postoperative nausea and vomiting
- Mezioborové stanovisko k používání terapeutické hypotermie u pacientů po zástavě oběhu
- Použití vysokofrekvenční ventilace/oscilace u pacientů s ARDS: jen jako rescue postup!
- Souhlas k pitvě – právní a etický problém?
- Vladimír Lemon a hudba v korespondenci z let 2009–2010
- Anesteziologie a intenzivní medicína
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Postpunkční cefalea v porodnictví
- Valsalvův manévr
- Centrální žilní porty a jejich využití k zajištění dlouhodobého cévního přístupu
- Význam tromboelastografie (TEG) a tromboelastometrie (ROTEM) na jednotke intenzívnej starostlivosti
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



