-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Endosonograficky navigovaná tenkoihlová aspiračná biopsia zo solídnych pankreatických más – presnosť a impakt na liečbu u 358 pacientov
Endosonography-guided fine needle aspiration biopsy of solid pancreatic masses – accuracy and impact on the treatment of 358 patients
The aim of our study
was to evaluate the accuracy, safety and benefit of EUS-FNA in diagnosing and treating patients with unclear solid pancreatic mass. Diagnostic accuracy of EUS-FNA was evaluated through the comparison of EUS-FNA cytology with either histology of rescted specimen or clinical and radiological follow-up. The benefit was defined as impact of EUS-FNA cytology on subsequent treatment. In a cohort of 358 patients with a solid pancreatic mass, the sensitivity and specificity of EUS-FNA in diagnosing pancreatic cancer was 93% (95% CI: 89.2–95.6) and 90.1% (95% CI: 80.1–95.6), respectively. Complications ocured in 2.2% of patients. False-negative cytology was less frequent in EUS-FNA with rapid on-site cytopathology evaluation (ROSE) compared with EUS-FNA without ROSE (3.9% vs 14.3%; p = 0.006). The positive and negative impact of EUS-FNA on subsequent treatment was observed in 63.9% and 0.5% of patients, respectively. In 3.4% of patients with pancreatic cancer, EUS-FNA diagnosed either subtle malignant ascites or liver metastases (mean ± SD: 8,9 ± 3,5 mm), that were not detected on previous contrast-enhanced CT scans. We have confirmed that EUS-FNA is accuarate and safe method in diagnosing pancreas carcinoma and has positive impact on subsequent treatment in 2/3 of patients with unclear solid pancreatic mass. ROSE significantly increases the accuracy of the method.Key words:
endosonography – fine needle aspiration biopsy – pancreatic mass – pancreas carcinoma
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE „uniform requirements“ for biomedical papers.Submitted:
19. 8. 2013Accepted:
16. 9. 2013
Autori: M. Kliment 1,2; O. Urban 1,2; M. Loveček 3; M. Straka 4; D. Žiak 5; Přemysl Falt 1,2
; P. Fojtík; J. Dvořáčková 6,2
Pôsobisko autorov: Vzdělávací a výzkumný institut AGEL, o. p. s., Vítkovická nemocnice a. s., Centrum péče o zažívací trakt, Ostrava 1; Lékařská fakulta Ostravské univerzity v Ostravě 2; Chirurgická klinika, FN Olomouc 3; Chirurgické oddělení, Onkologické centrum J. G. Mendela, Nový Jičín 4; CGB Laboratoř, Patologie, FN Ostrava Ústav patologie, FN Ostrava 5; Ústav patologie, FN Ostrava 6
Vyšlo v časopise: Gastroent Hepatol 2013; 67(5): 431-437
Kategória: Digestivní endoskopie: původní práce
Súhrn
Cieľom práce bolo zhodnotiť presnosť, bezpečnosť a prínos EUS-FNA v diagnostike a liečbe pacientov s nejasnou solídnou ložiskovou léziou pankreasu. Presnosť metódy bola zhodnotená porovnaním výsledku EUS-FNA cytológie s konečnou diagnózou, stanovenou na základe histológie resekátu alebo klinického a rádiologického sledovania. Prínos sme zhodnotili ako vplyv výsledku cytológie na ďalšiu liečbu pacientov. V súbore 358 pacientov so solídnou pankreatickou masou mala EUS-FNA senzitivitu 93 % (95% CI: 89,2–95,6) a špecificitu 90,1 % (95% CI: 80,1–95,6) v diagnostike karcinómu pankreasu. Komplikácie sa vyskytli u 2,2 % pacientov. Falošnenegatívna cytológia bola menej častá pri vykonaní EUS-FNA s rýchlym on-site cytologickým zhodnotením náterov (ROSE) v porovnaní s EUS-FNA bez ROSE (3,9 % vs 14,3 %; p = 0,006). V našej kohorte pacientov mala EUS-FNA pozitívny impakt na liečbu u 63,9 % a negatívny impakt u 0,5 % pacientov. U 3,4 % pacientov s karcinómom pankreasu bol pomocou EUS-FNA diagnostikovaný malígny ascites alebo metastázy v pečeni (priemer ± SD: 8,9 ± 3,5mm) nedetekované predchádzajúcim kontrastným CT vyšetrením. Potvrdili sme, že EUS-FNA je dostatočne presná a bezpečná metóda v diagnostike karcinómu pankreasu a má pozitívny impakt na liečbu 2/3 pacientov s nejasnou solídnou masou pankreasu. ROSE významne zvyšuje presnosť metódy.
Kľúčové slová:
endosonografia – tenkoihlová aspiračná biopsia – pankreatická masa – karcinóm pankreasuAdenokarcinóm pankreasu je štvrtou najčastejšou príčinou úmrtia na malígne ochorenie v západnej Európe a Severnej Amerike [1]. Napriek pokročilým zobrazovacím technikám je väčšina prípadov diagnostikovaná v štádiu pokročilého ochorenia znemožňujúcom kuratívnu terapiu, čo vedie k nepriaznivej prognóze s celkovým päťročným prežívaním < 5 % [2]. Aj v prípade včasnej diagnostiky a liečby zostáva prognóza nepriaznivá s päťročným prežívaním 20–50 % [2,3]. Endosonograficky navigovaná tenkoihlová aspiračná biopsia (EUS-FNA) je v poslednom období používaná ako presná a bezpečná modalita na získanie tkanivovej diagnózy u pacientov s podozrením na karcinóm pankreasu [4]. U 5–11 % pacientov podstupujúcich operáciu pankreasu pre podozrenie na karcinóm sa nakoniec histologicky potvrdí benígna diagnóza [5]. Predoperačná tkanivová diagnóza môže nielen potvrdiť benígne ochorenie alebo zriedkavú neopláziu, ale zároveň pred operáciou uistiť starších pacientov a ich rodiny o malignite a nutnosti chirurgickej liečby. Tkanivový odber u pacientov s neresekovateľnou chorobou je jednoznačne prínosný, keďže umožní následnú paliatívnu chemoterapiu, zaradenie pacientov do klinických štúdií, ako aj zavedenie samo-expandibilného metalického stentu (SEMS) na permanentnú biliárnu drenáž. Nie je jasné, ako EUS-FNA ovplyvní ďalší management pacientov so solídnou pankreatickou masou a či je získanie tkanivovej diagnózy prínosné u všetkých týchto pacientov. Prospektívne sme zhodnotili diagnostickú presnosť, bezpečnosť a impakt EUS-FNA na ďalšiu liečbu pacientov so solídnou masou pankreasu.
Metodika
Súbor pozostáva z 358 pacientov s nejasnou solídnou masou pankreasu, u ktorých bola vykonaná EUS-FNA s použitím lineárneho echoendoskopu (Olympus GF UCT 140 AL) a aspiračnej ihly (EZShot NA-200H-8022, Olympus) s priemerom 22-Gauge na pracovisku autora v období štyroch rokov. Zaradení boli pacienti so suspektným malígnym nádorom pankreasu na CT, MR, abdominálnej USG alebo pacienti s ERCP nálezom stenózy oboch duktov (double duct sign). Vyraďovacie kritériá boli: vek < 18 rokov, neschopnosť pacienta dať informovaný súhlas, vysoké riziko krvácania po EUS-FNA vzhľadom na hypokoagulačný stav (international normalized ratio > 1,5), trombocytopéniu < 50 000/mm3 alebo intrepozíciu veľkej cievy medzi koniec ihly a pankreatickú masu. Všetci pacienti podpísali informovaný súhlas s vyšetrením a následne boli vyšetrení jedným z dvoch skúsených endosonografistov (M.K., O.U.). Vyšetrenie bolo realizované v analgosedácii s použitím 2–10 mg Midazolamu a 1–2 ml Fentanylu intravenózne s priebežnou aplikáciou frakcionovane.
Technika EUS-FNA, rýchle on-site cytologické zhodnotenie náteru (ROSE)
Pod EUS kontrolou bola aspiračná ihla zavedená do cieľovej štruktúry – pankreatickej masy. V prípade detekcie inej patologickej štruktúry bola najprv vykonaná EUS-FNA z tej patologickej štruktúry, ktorej malígne postihnutie diagnostikovalo najpokročilejšie štádium ochorenia. Ako jeden vpich bol označený jeden odber materiálu, teda jedna inzercia ihly do cieľovej štruktúry s vykonaním 5–10 pohybov ihly vo vnútri štruktúry pod EUS kontrolou. Materiál z každého vpichu bol aplikovaný na podložné sklíčka a do skúmavky s formalínom, ktorá slúžila na vyšetrenie materiálu v cytobloku. V prípade dostupnosti cytopatológa bolo počas EUS vykonané rýchle on--site cytopatologické zhodnotenie náterov (ROSE) s použitím rýchleho farbenia (MGG Quick stain), pričom odber bol opakovaný do potvrdenia adekvátnej celularity náteru cytopatológom. Pri EUS-FNA bez ROSE závisel počet vpichov od rozhodnutia endosonografistu po makroskopickom zhodnotení náterov. V závislosti od obsahu krvi v aspiráte a celularity náteru bol nasledujúci odber vykonaný s/bez aplikácie negatívneho tlaku v ihle. Z lymfatických uzlín (LU) alebo suspektných neuroendokrinných nádorov (NET) bola EUS-FNA vykonaná primárne bez negatívneho tlaku v ihle vzhľadom na ich bohatú vaskularizáciu.
U pacientov s lokálne pokročilým alebo metastatickým karcinómom pankreasu a prítomnou pankreatickou bolesťou bola počas EUS-FNA vykonaná EUS-navigovaná celiakálna neurolýza (EUS-CPN) jednorázovou (instiláciou 20 ml 92% etylalkoholu a 10 ml 0,25% Bupivacainu medzi truncus celiacus a aortu) alebo bilaterálnou (5 ml 0,25% Bupivacainu a 10 ml 92% alkoholu po oboch stranách truncus celiacus) technikou.
Cytologická diagnóza bola stanovená po zhodnotení všetkých náterov a cytobloku v laboratóriu. Cytologické potvrdenie malígnych, suspektne malígnych alebo buniek NET bolo hodnotené ako pozitívne z hľadiska neoplázie. Pokiaľ boli v náteroch a cytobloku prítomné len normálne, reaktívne zmenené duktálne/acinárne epitélie alebo zápalové bunky, bola stanovená benígna cytologická diagnóza. Nátery s neadekvátnou celularitou boli klasifikované ako nereprezentatívne. Konečná diagnóza bola stanovená na základe histológie z chirurgického resekátu alebo iniciálnej cytológie a klinického a rádiologického sledovania počas ≥ 6 mesiacov. Porovnaním cytologickej a konečnej diagnózy bola vypočítaná presnosť a operačné charakteristiky EUS-FNA.
Komplikácie, liečba a sledovanie pacientov
Všetci pacienti boli po EUS-FNA hospitalizovaní v nemocnici ≥ 24 hod s cieľom diagnostikovať a liečiť včasné komplikácie. Informácia o neskorých komplikáciách bola získaná telefonickým kontaktom s pacientom alebo odosielajúcim lekárom. História pacientov a výsledky vyšetrení boli prezentované na multidisciplinárnej konferencii, kde bolo prijaté konečné rozhodnutie o ďalšej liečbe. Rozhodnutie o chirurgickej explorácii a type operácie bolo na odosielajúcom chirurgovi v závislosti od známok resekability, potreby gastroenteroanastomózy (GEA) alebo hepatikojejunoanastomózy (HJA) a prítomnosti závažných komorbidít. Každý pacient s iniciálnou benígnou cytológiou bez nasledujúcej chirurgickej liečby absolvoval kontrolné CT vyšetrenie brucha, USG alebo EUS 3–6 mesiacov po iniciálnej EUS-FNA. Pacienti liečení paliatívnou chemorádioterapiou (CHRT) absolvovali kontrolné CT vyšetrenie brucha po ukončení liečby.
Impakt EUS-FNA na liečbu pacientov
Impakt EUS-FNA cytológie bol považovaný za pozitívny, ak na základe výsledku EUS-FNA cytológie nasledovala liečba adekvátna konečnej diagnóze u daného pacienta. Išlo o nasledovné klinické situácie:
- a) Chirurgická resekcia, CHRT, EUS-CPN alebo permanentná biliárna drenáž pomocou SEMS v prípade konečnej diagnózy malígneho ochorenia pankresu.
- b) Zabránenie nepotrebnej chirurgickej liečbe/explorácii vďaka negatívnemu výsledku EUS-FNA cytológie v prípade benígnej konečnej diagnózy a neprítomnej inej indikácie k chirurgickej liečbe.
Impakt EUS-FNA cytológie bol považovaný za negatívny, ak nastalo oneskorenie liečby vďaka falošne negatívnemu výsledku alebo nadliečenie vďaka falošne pozitívnemu výsledku EUS-FNA.
Štatistická analýza
Spojité premenné sú prezentované ako priemer so štandardnou odchýlkou (SD) alebo medián s rozsahom 1.–3. kvartilu (IQR), kategorické premenné sú prezentované ako percentá. Senzitivita, špecificita, pozitívna prediktívna hodnota (PPH), negatívna prediktívna hodnota (NPH) a presnosť s 95% intervalom spoľahlivosti (CI) boli vypočítané porovnaním dát získaných pomocou EUS-FNA (cytológia) s dátami pochádzajúcimi z chirurgickej liečby (histológia) alebo klinického a rádiologického sledovania (konečná diagnóza). Diagnostická presnosť bola vypočítaná ako pomer počtu pacientov so zhodujúcou sa cytologickou a konečnou diagnózou k celkovému počtu pacientov v súbore. Rozdiel v kategorickej premennej pre falošne negatívnu cytológiu s použitím a bez použitia ROSE bol analyzovaný pomocou Fisherovho exaktného testu, pričom p hodnota < 0,05 bola považovaná za štatisticky významnú. Na zachovávanie a základnú analýzu dát bol použitý software Microsoft Excel 2003 (Microsoft Corporation, Redmond WA, USA). Štatistická analýza bola vykonaná použitím programu SPSS verzie 14.0 (SPSS Inc., Chicago, IL). Od všetkých pacientov bol získaný informovaný súhlas schválený etickou komisiou Vítkovickej nemocnice.
Výsledky
Sledovaný súbor tvorí 358 pacientov (priemerný vek ± SD: 62,2 ± 10,8 rokov, 59,7 % muži), ktorí absolvovali EUS-FNA zo solídnej pankreatickej masy (priemerná veľkosť ± SD: 31,2 ± 10,8 mm, rozsah: 8–80 mm). Primárna diagnostika pred EUS bola realizovaná pomocou CT u 334 (93,3 %), MR u dvoch (0,6 %) a ultrasonografie (USG) u šiestich (1,7 %) pacientov a zodpovedajúce nálezy sú uvedené v tab. 1. U 16 (4,4 %) pacientov predchádzala EUS len ERCP s nálezom suspektného nádoru pankreasu (stenóza intrapankreatickej časti choledochu alebo double-duct sign).
Tab. 1. CT, MR a USG nálezy pred EUS-FNA . Tab. 1. CT, MR and USG findings before EUS-FNA. 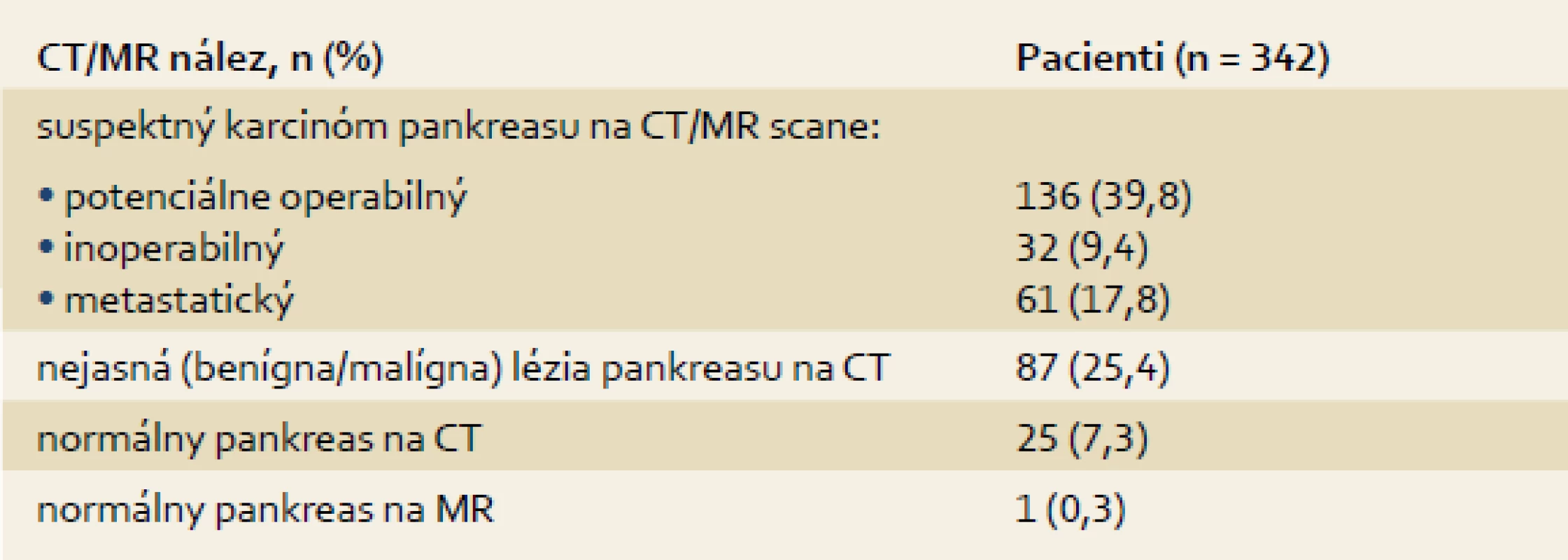
Klinické charakteristiky pacientov sú uvedené v grafe 1. Zastúpenie jednotlivých typov konečných diagnóz je uvedené v grafe 2. Výsledky cytológie a korelácia medzi cytologickou a konečnou diagnózou sú zobrazené v tab. 2.
Graf 1. Klinické charakteristiky pacientov (n = 358). Graph 1. Clinical characteristics of patients (n = 358). 
Graf 2. Konečná diagnóza pacientov so solídnou masou pankreasu (n = 358). Graph 2. Final diagnosis in patients with solid pancreatic mass (n = 358). 
Tab. 2. Výsledky cytológie a korelácia medzi cytologickou a konečnou diagnózou. Tab. 2. Cytology results and correlation between cytology and final diagnosis. 
* falošne negatívna cytológia (n = 20); ** falošne pozitívna cytológia (n = 7; výsledok histológie resekátu: chronická pankreatitída: 4 pričom 1 pacient s PanIN-I, PanIN-II léziami, inflamatórny myofibroblastický tumor: 1 pacient) * false-negative cytology (n = 20); ** false positive cytology (n = 7; histology of resected specimen: chronic pancreatitis: 4 including 1 patient with PanIN-I, PanIN-II lesions, inflammatory myofibroblastic tumor: 1 patient) Operačné charakteristiky EUS-FNA v diagnostikovaní malígneho nádoru pankreasu boli: senzitivita 93,0 % (95% CI: 89,2–95,6), špecificita 90,1 % (95% CI: 80,1–95,6), pozitívna prediktívna hodnota 97,4 % (95% CI: 94,6–98,9), negatívna prediktívna hodnota 76,1 % (95% CI: 65,4–84,5) a presnosť 92,5 % (95% CI: 89,2–94,8).
EUS-FNA z extrapankreatickej štruktúry bola vykonaná u 60 (16,8 %) pacientov. Celkovo u 25 z 270 (9,3 %) pacientov s konečnou diagnózou adenokarcinóm, ktorí absolvovali CT (n = 268) alebo MR (n = 2) brucha pred EUS-FNA, nebolo zobrazené žiadne ložisko v pankrease na kontrastných CT scanoch alebo v MR obraze (priemerná veľkosť pankreatickej masy v EUS obraze: 22,56 ± 5,43 mm). Výskyt falošne negatívnej cytológie bol 3,97 % (12 z 302) v skupine s ROSE a 14,3 % (8 z 56) v skupine bez ROSE, (p = 0,006, Fisherov exaktný test).
Komplikácie sa vyskytli u deviatich (2,2 %) pacientov, z nich jedna (0,9 %) ľahká edematózna akútna pankreatitída s predĺžením hospitalizácie o tri dni. Ostatné boli nevýznamné a zahrňovali bolesť brucha u troch (0,84 %) pacientov, krvácanie počas EUS-FNA bez nutnosti liečby u troch (0,84 %) pacientov a epizódu horúčky u jedného (0,28 %) pacienta.
Liečba pacientov podľa konečnej diagnózy je zobrazená v grafe 3. Pacienti, ktorí absolvovali viaceré liečebné modality, sú započítaní len v jednej modalite. Z 287 pacientov s konečnou diagnózou neoplázie pankreasu bola u 55 (19,2 %) vykonaná chirurgická resekcia. Chirurgickú exploráciu (Expl) s eventuálnou paliatívnou spojkovou operáciou absolvovalo naviac 53 (18,5 %) pacientov.
Graf 3. Liečba pacientov podľa konečnej diagnózy (n = 358). Graph 3. Treatment of patients according to final diagnosis (n = 358). 
U 3,4 % (9/268) pacientov s karcinómom pankreasu bol pomocou EUS-FNA diagnostikovaný malígny ascites alebo metastázy v pečeni (priemer ± SD: 8,9 ± 3,5 mm) nedetekované predchádzajúcim kontrastným CT vyšetrením.
EUS-FNA mala pozitívny impakt na liečbu u 180 z 287 (62,7 %) pacientov s konečnou diagnózou neoplázie pankreasu (49 absolvovalo chirurgickú resekciu, 93 bolo liečených len paliatívnou CHRT, deväť samotnou EUS-CPN, u 16 pacientov bolo jedinou liečbou zavedenie biliárneho SEMS, u 13 pacientov sa predišlo nepotrebnej chirurgickej explorácii cytologickou verifikáciou: lymfatických metastáz u piatich, malígneho ascitu u troch a metastáz v pečeni u piatich pacientov).
U 49 pacientov s konečnou benígnou diagnózou (CP) sa na základe EUS-FNA cytológie predišlo nepotrebnej chirurgickej explorácii, čo sme hodnotili ako pozitívny impakt na liečbu. Negatívny impakt by teoreticky mala EUS-FNA u všetkých pacientov s falošne negatívnou (n = 20) a falošne pozitívnou (n = 7) cytológiou (celkovo 27 z 358; 7,5 %). Keďže u všetkých pacientov sa rozhodovalo o ďalšom postupe na základe výsledkov všetkých vyšetrení klinického stavu a niektorí pacienti absolvovali chirurgickú liečbu pre vysoké podozrenie na malignitu aj napriek falošne negatívnej cytológii alebo pre klinické symptómy pri falošne pozitívnej cytológii, sa negatívny impakt prakticky prejavil len u dvoch (0,5 %) pacientov s oneskorením chirurgickej liečby.
Z celej kohorty 358 pacientov mala EUS-FNA pozitívny a negatívny impakt na nasledujúcu liečbu u 229 (63,9 %) a dvoch (0,5 %) pacientov so solídnou pankreatickou masou. Pokiaľ by sa liečba riadila výlučne výsledkom cytológie, EUS-FNA by mala negatívny impakt na liečbu u 27 (7,5 %) pacientov.
Diskusia
V publikovaných prácach zaoberajúcich sa EUS-FNA solídnych pankreatických más dosahuje senzitivita 82–96 % a špecificita 88–100 % [6,7]. Riziko falošne negatívnej cytológie s oneskorením stanovenia diagnózy a premeškaním možnosti kuratívnej liečby je hlavnou nevýhodou EUS-FNA. Falošne negatívna cytológia môže byť spôsobená nesprávnym zacielením nádoru, aspiráciou acelulárneho materiálu z nekrózy v centrálnej časti veľkých nádorov alebo aspiráciou krvi z bohato vaskularizovaných nádorov. Zabrániť uvedenému je možné realizáciou viacerých vpichov, odberom materiálu z periférnych častí nádoru a realizáciou ROSE. U 9,3 % pacientov s karcinómom pankreasu v našom súbore nezobrazilo predchádzajúce kontrastné CT alebo MR žiadne ložisko v pankrease. Podľa literárnych údajov dosahuje senzitivita EUS v diagnostike nádorov pankreasu s priemerom do 20 mm 90–100 %, na rozdiel od CT a MR, ktoré majú senzitivitu len 40–67 % a 33 % [8]. V jednej z publikovaných prác tvorili karcinómy hlavy pankreasu nedetekované pomocou CT až 30 % z celkového počtu 70 resekovaných karcinómov hlavy pankreasu, pričom 88 % z 21 karcinómov hlavy pankreasu nezobrazených na CT bolo vizualizovaných ako solídna masa v EUS zobrazení [9].
V našom súbore bol výskyt falošne negatívnej cytológie signifikantne vyšší v skupine bez ROSE. Publikované práce rovnako potvrdili, že EUS-FNA zo solídnych más pankreasu vykonaná s ROSE má vyššiu presnosť a nižší výskyt falošne negatívnej cytológie ako EUS-FNA bez ROSE [10].
V celej kohorte sa vyskytla falošne pozitívna cytológia u siedmich (1,9 %) pacientov, pričom šesť z nich podstúpilo chirurgickú resekciu. U mladého pacienta s prebiehajúcou akútnou pankreatitídou bola na CT scanoch zobrazená solídna masa v kaude pankreasu. EUS-FNA cytológia bola suspektná z prítomnosti NET, avšak histologické vyšetrenie resekátu po distálnej pankreatektómii potvrdilo inflamatórny myofibroblastický tumor (IMT) v kaude pankreasu. Je kontroverzné, či táto klinická entita je benígne alebo potenciálne malígne ochorenie [11]. V skupine s falošne pozitívnou cytológiou mali ďalší štyria pacienti cytologicky prítomné suspektne malígne bunky, z nich traja podstúpili chirurgickú resekciu s histologickým nálezom chronickej pankreatitídy u všetkých a súčasne s PanIN-2 léziami u jedného z nich. Štvrtý pacient nebol operovaný z dôvodu komorbidít a kontrolné EUS vyšetrenie s časovým odstupom potvrdilo parciálnu regresiu ložiska pankreasu. U ďalších dvoch pacientov bol výsledok cytológie interpretovaný ako jednoznačne potvrdzujúci prítomnosť malígnych buniek karcinómu, avšak histologické vyšetrenie resekátu potvrdilo chronickú pankreatitídu s prebiehajúcou akútnou exacerbáciou u jedného a autoimunitnú pankreatitídu u druhého. Ani po opakovanom zhodnotení cytologických náterov s vedomím histologického záveru cytopatológ neprehodnotil svoje závery u uvedených dvoch pacientov. Hoci viaceré štúdie zaoberajúce sa EUS-FNA pankreatických más potvrdili 100 % špecificitu metódy [12,13], iní autori tiež referovali o falošnej pozitivite [14]. Žiadny z pacientov s falošne pozitívnou cytológiou v našom súbore nemal fatálnu ani inú komplikáciu chirurgickej liečby. Piati zo šiestich operovaných pacientov s falošne pozitívnou cytológiou boli symptomatickí pred chirurgickou liečbou s ústupom symptómov po resekcii.
V našom súbore sa vyskytli komplikácie EUS-FNA u 2,2 % pacientov. Publikované práce tiež potvrdili vysoký bezpečnostný profil tejto metódy s výskytom komplikácií < 3 % [15], vrátane akútnej pankreatitídy u 0,9 % pacientov [16,14].
Malígny ascites nedetekovaný predchádzajúcim kontrastným CT vyšetrením bol pomocou EUS-FNA potvrdený u štyroch z 268 (1,5 %) pacientov s konečnou malígnou diagnózou. Príčinou ascitu u pacientov s karcinómom pankreasu môže byť prítomnosť peritoneálnych metastáz alebo portálnej hypertenzie v prípade invázie nádoru do portálneho venózneho systému. Podľa publikovaných prác je EUS citlivejšia ako CT [17] a USG [18] v detekcii ascitickej tekutiny. Viaceré práce ukázali, že detekcia malígneho ascitu pomocou EUS-FNA u pacientov s karcinómom pankreasu je asociovaná s nepriaznivou prognózou [19], čo môže mať vplyv na rozhodovanie o selekcii typu biliárneho drénu (metalický vs plastový) u pacientov s disseminovaným karcinómom hlavy pankreasu a obštrukčným ikterom.
Existuje všeobecne akceptované odporúčanie, že pacienti s pravdepodobnou diagnózou karcinómu pankreasu, negatívnymi kritériami inoperability a bez významných komorbidít by nemali strácať čas čakaním na EUS vyšetrenie vrátane výsledku cytológie a podstupovať riziko eventuálne falošne negatívnej cytológie [20]. Niektorí autori majú naviac obavy zo seedingu malígnych buniek v punkčnom kanáli pri EUS-FNA, obzvlášť pri nádoroch v tele a kaude pankreasu. Autor súhlasí s týmto odporúčaním, doplňuje avšak niekoľko poznámok:
- Realizovaním niekoľkých EUS vyšetrení denne je táto metóda na pracovisku autora široko dostupná s krátkou čakacou dobou na vyšetrenie, čím je pravdepodobnosť omeškania diagnózy nízka.
- Vzhľadom na prítomnosť cytopatológa on-site počas EUS-FNA je predbežná cytologická diagnóza stanovená ihneď a konečná diagnóza v krátkom časovom intervale.
- Riziko falošnej negativity je reálne zvažované individuálne u každého pacienta a konečné rozhodnutie o ďalšej liečbe nestojí iba na výsledku cytológie, ale na všetkých dostupných informáciách o pacientovi.
- Podľa aktuálne publikovaných prác nie je predoperačná EUS-FNA asociovaná so zvýšeným rizikom gastrických alebo peritoneálnych metastáz u pacientov po resekcii karcinómu pankreasu a tiež neskracuje prežívanie týchto pacientov [21].
Aj napriek vyššie spomenutým argumentom sa v súčasnosti na pracovisku autora EUS-FNA z pankreatickej masy predoperačne štandardne nevykonáva u pacientov bez asociovaných významných komorbidít súhlasiacich s primárne chirurgickou liečbou, pokiaľ je prítomný typický EUS nález hypoechogénnej masy v pankrease a nie sú prítomné EUS/CT známky inoperability.
Limitácie práce
Existuje niekoľko limitácií tejto práce:
- Histologická diagnóza, zlatý štandard pre stanovenie konečnej diagnózy, bola k dispozícii len u 34,9 % (125 z 358) pacientov. U zvyšných 233 (74,1 %) pacientov bola konečná diagnóza stanovená na základe iniciálnej cytológie, klinického a rádiologického sledovania počas mediánu 12 mesiacov.
- Rozhodnutie o vykonaní ROSE počas EUS-FNA nebolo náhodné, ale záviselo na dostupnosti cytopatológa, preto môžu byť výsledky porovnávajúce EUS-FNA s a bez ROSE skreslené. Na porovnanie uvedených dvoch techník tiež nebola vypočítaná veľkosť oboch súborov potrebných na dosiahnutie štatistickej významnosti rozdielu a analýza bola vykonaná post hoc.
Záverom konštatujeme, že výsledky našej práce potvrdili vysokú senzitivitu a špecifictu EUS-FNA v diagnostike karcinómu pankreasu. Naviac u 9,3 % pacientov s karcinómom pankreasu bola diagnóza stanovená len na základe EUS po predchádzajúcom negatívnom CT alebo MRI vyšetrení. EUS-FNA tiež umožnila diagnostiku drobného malígneho ascitu alebo hepatálnych metastáz, ktoré sú pod rozlišovacou schopnosťou CT. Pozitívny impakt EUS-FNA na liečbu bol pozorovaný u 2/3 pacientov s nejasnou solídnou masou pankreasu.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
Doručeno: 19. 8. 2013
Přijato: 16. 9. 2013
MUDr. Martin Kliment, PhD.
Centrum péče o zažívací trakt
Vítkovická nemocnice a. s.
Zalužanského 1192/15
703 84 Ostrava-Vítkovice
martin.kliment@nemvitkovice.cz
Zdroje
1. Jemal A, Siegel R, Ward E et al. Cancer statistics, 2007. CA Cancer J Clin 2007; 57(1): 43–66.
2. Ghaneh P, Costello E, Neoptolemos JP. Biology and management of pancreatic cancer. Gut 2007; 56(8): 1134–1152.
3. Li D, Xie K, Wolff R et al. Pancreatic cancer. Lancet 2004; 363(9414): 1049–1057.
4. Harewood GC, Wiersema MJ. Endosonography-guided fine needle aspiration biopsy in the evaluation of pancreatic masses. Am J Gastroenterol 2002; 97(6): 1386–1391.
5. Van Gulik TM, Reeders JW, Bosma A et al. Incidence and clinical findings of benign, inflammatory disease in patients resected for presumed pancreatic head cancer. Gastrointest Endosc 1997; 46(5): 417–423.
6. Voss M, Hammel P, Molas G et al. Value of endoscopic ultrasound guided fine needle aspiration biopsy in the diagnosis of solid pancreatic masses. Gut 2000; 46(2): 244–249.
7. Kliment M, Urban O, Cegan M et al. Endoscopic ultrasound-guided fine needle aspiration of pancreatic masses: the utility and impact on management of patients. Scand J Gastroenterol 2010; 45(11): 1372–1379.
8. Müller MF, Meyenberger C, Bertschinger P et al. Pancreatic tumors: evaluation with endoscopic US, CT, and MR imaging. Radiology 1994; 190(3): 745–751.
9. Loveček M, Kliment M, Skalický P et al. Význam endosonografie v předoperačním managementu nemocných s karcinomem hlavy pankreatu. Rozhl Chir 2012; 91(11): 608–613.
10. Nasuti JF, Gupta PK, Baloch ZW. Diagnostic value and cost-effectiveness of on-site evaluation of fine-needle aspiration specimens: review of 5,688 cases. Diagn Cytopathol 2002; 27(1): 1–4.
11. Dishop MK, Warner BW, Dehner LP et al. Successful treatment of inflammatory myofibroblastic tumor with malignant transformation by surgical resection and chemotherapy. J Pediatr Hematol Oncol 2003; 25(2): 153–158.
12. Raut CP, Grau AM, Staerkel GA et al. Diagnostic accuracy of endoscopic ultrasound-guided fine-needle aspiration in patients with presumed pancreatic cancer. J Gastrointest Surg 2003; 7(1): 118–126.
13. Giovannini M, Seitz JF, Monges G et al. Fine-needle aspiration cytology guided by endoscopic ultrasonography: results in 141 patients. Endoscopy 1995; 27(2): 171–177.
14. Eloubeidi MA, Varadarajulu S, Desai S et al. A prospective evaluation of an algorithm incorporating routine preoperative endoscopic ultrasound-guided fine needle aspiration in suspected pancreatic cancer. J Gastrointest Surg 2007; 11(7): 813–819.
15. Wiersema MJ, Vilmann P, Giovannini M et al. Endosonography-guided fine-needle aspiration biopsy: diagnostic accuracy and complication assessment. Gastroenterology 1997; 112(4): 1087–1095.
16. Eloubeidi MA, Gress FG, Savides TJ et al. Acute pancreatitis after EUS-guided FNA of solid pancreatic masses: a pooled analysis from EUS centers in the United States. Gastrointest Endosc 2004; 60(3): 385–389.
17. DeWitt J, LeBlanc J, McHenry L et al. Endoscopic ultrasound-guided fine needle aspiration cytology of solid liver lesions: a large single-center experience. Am J Gastroenterol 2003; 98(9): 1976–1981.
18. Lee YT, Ng EK, Hung LC et al. Accuracy of endoscopic ultrasonography in diagnosing ascites and predicting peritoneal metastases in gastric cancer patients. Gut 2005; 54(11): 1541–1545.
19. DeWitt J, Yu M, Al-Haddad MA et al. Survival in patients with pancreatic cancer after the diagnosis of malignant ascites or liver metastases by EUS-FNA. Gastrointest Endosc 2010; 71(2): 260–265.
20. Dumonceau JM, Polkowski M, Larghi A et al. Indications, results, and clinical impact of endoscopic ultrasound (EUS)-guided sampling in gastroenterology: European Society of Gastrointestinal Endoscopy (ESGE) Clinical Guideline. Endoscopy 2011; 43(10): 897–912.
21. Ngamruengphong S, Xu C, Woodward TA et al. Risk of gastric or peritoneal recurrence, and long-term outcomes, following pancreatic cancer resection with preoperative endosonographically guided fine needle aspiration. Endoscopy 2013; 45(8): 619–626.
Štítky
Detská gastroenterológia Gastroenterológia a hepatológia Chirurgia všeobecná
Článok vyšiel v časopiseGastroenterologie a hepatologie
Najčítanejšie tento týždeň
2013 Číslo 5- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Kombinace metamizol/paracetamol v léčbě pooperační bolesti u zákroků v rámci jednodenní chirurgie
- Antidepresivní efekt kombinovaného analgetika tramadolu s paracetamolem
- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
- Fixní kombinace paracetamol/kodein nabízí synergické analgetické účinky
-
Všetky články tohto čísla
- Gastrointestinální onkologie
- Kvíz – postižení jater s normálními jaterními testy
- Metodika adresného zvaní občanů do českého programu screeningu nádorů tlustého střeva a konečníku
- Vliv klinických a molekulárních faktorů na odhad rekurence kolorektálních adenomů u dlouhodobě sledovaných pacientů
- Postavenie neoadjuvantnej terapie v multimodálnej liečbe karcinómu rekta – klinické výsledky
- Hereditárny difúzny karcinóm žalúdka
- Cílená léčba karcinomu pankreatu – minulost či budoucnost?
- Lymfomy tenkého střeva
- Stav onkochirurgické péče a vzdělávání v onkochirurgii v České republice
- Multidisciplinární přístup v diagnostice a léčbě karcinomu žaludku
- 1 000 transplantací jater v IKEM
- Prvních 1 000 transplantací jater v IKEM
- Transplantace jater pro chronickou hepatitidu C, význam protivirové léčby
- Transplantace jater pro primární sklerozující cholangitidu
- Méně časté indikace k ortotopické transplantaci jater
- Vývoj postupů v léčbě akutního selhání jater
- Endosonograficky navigovaná tenkoihlová aspiračná biopsia zo solídnych pankreatických más – presnosť a impakt na liečbu u 358 pacientov
- Správná odpověď na kvíz
- Příprava tlustého střeva u pacientů s idiopatickými střevními záněty před endoskopickými nebo kolografickými (CT/MR) vyšetřeními – stanovisko IBD pracovní skupiny
-
XXII. jarní setkání Loket 2013 – Neoplazie žaludku
3. postgraduální kurz společnosti pro gastrointestinální onkologii - Životní jubileum prof. Miroslava Zavorala
- Picoprep – očistný prostředek s dvojím účinkem
- Autodidaktický test: gastrointestinální onkologie
- Gastroenterologie a hepatologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Picoprep – očistný prostředek s dvojím účinkem
- Lymfomy tenkého střeva
- Transplantace jater pro primární sklerozující cholangitidu
- Hereditárny difúzny karcinóm žalúdka
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



