-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Lymfomy tenkého střeva
Small intestine lymphomas
Primary malignant tumours of the small intestine are rare; they only represent around 2% of all malignant tumours in the gastrointestinal system. Small intestine lymphomas represent less than one fifth of them. They create a quite heterogeneous group of mainly B-cell type non-Hodgkin`s lymphomas. Their more difficult diagnostics ensues from their localisation with a need to use specialised endoscopy, imaging and immunohistochemical methods. Determination of the diagnosis is usually delayed due to the non-specific symptoms of the disease. Quite frequently we can experience complications. A spontaneous perforation of the small intestine requiring an urgent surgical solution occurs in 9% of patients. Capsule endoscopy and balloon enteroscopy, which have so far been the gold standard of the diagnostics of small intestine diseases, have an irreplaceable role in the diagnostics. Co-operation of a gastroenterologist, a pathologist and a hemato-oncologist is necessary as regards early diagnostics and therapy for these diseases as well as for further follow-up care of patients with a small intestine lymphoma.
Key words:
lymphoma – double-balloon enteroscopy – capsule endoscopy
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE „uniform requirements“ for biomedical papers.Submitted:
30. 8. 2013Accepted:
2. 10. 2013
Autoři: P. Sopirjaková 1; D. Belada 2; M. Kopáčová 1; S. Rejchrt 1; J. Bureš 1; I. Tachecí 1
Působiště autorů: II. interní gastroenterologická klinika, LF UK a FN Hradec Králové 1; IV. interní hematologická klinika, LF UK a FN Hradec Králové 2
Vyšlo v časopise: Gastroent Hepatol 2013; 67(5): 377-380
Kategorie: Gastrointestinální onkologie: přehledová práce
Souhrn
Primární maligní tumory tenkého střeva jsou vzácné, představují asi 2 % všech zhoubných nádorů gastrointestinálního traktu. Z nich lymfomy tenkého střeva tvoří méně než jednu pětinu. Tvoří poměrně heterogenní skupinu nehodgkinských lymfomů, převážně B-buněčného typu. Obtížnější diagnostika vyplývá z lokalizace s nutností použít specializované endoskopické, zobrazovací a imunohistochemické metody. Stanovení diagnózy bývá opožděné pro nespecifické projevy onemocnění. Častěji pozorujeme komplikace. Spontánní perforace tenkého střeva vyžadující urgentní chirurgické řešení se vyskytuje až u 9 % nemocných. V diagnostice mají své nezastupitelné místo kapslová endoskopie a balonová enteroskopie, které jsou zlatým standardem diagnostiky chorob tenkého střeva. Spolupráce gastroenterologa, patologa a hematoonkologa je nezbytná jak pro včasnou diagnostiku a terapii těchto chorob, tak i pro další dispenzarizaci nemocných s lymfomem tenkého střeva.
Klíčová slova:
lymfom – dvojbalonová enteroskopie – kapslová endoskopiePrimární maligní tumory tenkého střeva jsou vzácné, představují méně než 2 % všech gastrointestinálních malignit, z nich lymfomy tvoří 15–20 %. Tenké střevo (ve 20–30 %) je po žaludku (60–75 %) druhou nejčastější lokalitou postiženou primárním gastrointestinálním (GIT) lymfomem, následovanou tračníkem (6–12 %) a jícnem (méně než 1 %). Celá skupina primárních gastrointestinálních lymfomů patří mezi vzácná onemocnění, ze všech gastrointestinálních malignit tvoří 1–4 %. Zároveň jsou ale nejčastějšími extranodálními lymfomy (30–40 %) [1–3]. Sekundární postižení GIT nehodgkinskými lymfomy je relativně časté (10 % pacientů v době stanovení diagnózy, 60 % nemocných zemřelých na nehodgkinské lymfomy [4,5].
Pro definování primárního GIT lymfomu byla dříve používaná striktní Dawsonova kritéria z roku 1961 [6], která ale vymezovala pouze lokalizovaná onemocnění (stadia I a II). Primární gastrointestinální lymfomy jsou extranodální lymfomy, které se v pokročilém stadiu mohou šířit do uzlin a extralymfatických orgánů. Proto je dnes používaná definice dle Lewina z roku 1978 [7]. Pro její naplnění je podstatné dominantní postižení trávicího traktu s odpovídající klinickou symptomatologií bez předcházející periferní lymfadenopatie. Rozlišení, zda se jedná o primární GIT lymfom či generalizaci uzlinové choroby, se tedy odvíjí od klinického průběhu onemocnění a výsledků endoskopických a zobrazovacích diagnostických metod.
Rizikovými faktory pro rozvoj primárního střevního lymfomu jsou preexistující střevní onemocnění jako celiakie, Crohnova choroba, chronické infekce (HIV, Campylobacter jejuni, virus hepatitidy B, HTLV-1, borelie, chlamydie, EB-virus, cytomegalovirus), autoimunitní choroby, IgA deficit a iatrogenní imunosuprese, zvláště u pacientů léčených po orgánové transplantaci cyklosporinem A. Za samostatný rizikový faktor se dnes nově považuje nízký socioekonomický status (immuno-proliferative small intestinal disease – IPSID) [2,8,9].
Klinické symptomy lymfomů tenkého střeva jsou nespecifické, dominují bolesti břicha, nauzea, zvracení, průjem, váhový úbytek. Prvním projevem onemocnění může být také ileus, perforace či krvácení do GIT, které si často vynutí urgentní chirurgický zákrok [2,3,8,9]. Perforací je komplikován průběh onemocnění u 9 % pacientů s lymfomem tenkého střeva, přičemž u 55 % z nich se tak stane v souvislosti s chemoterapií, častěji u agresivních subtypů [10]. „B“ symptomy (subfebrilie nebo horečky, noční poty, hubnutí) se vyskytují méně často než u nodálního onemocnění, dle různých studií u 13–25 % pacientů, a to častěji u T-buněčných lymfomů [9,11].
V době kapslové endoskopie a balonové (hluboké) enteroskopie s možností odběrů bioptických vzorků se odsunula potřeba chirurgické intervence pouze na řešení komplikací onemocnění. Tyto endoskopické metody jsou zlatým standardem v diagnostice chorob tenkého střeva [2,3]. Endoskopický vzhled lymfomů je pestrý, od nodulárního vzhledu sliznice přes sliznici se zvýšenou vaskulární cévní kresbou po polypy, vředy a stenózy (obr. 1–4) [12–16]. Zobrazovací radiologické metody (CT, PET/CT či MR), trepanobiopsie, laboratorní, imunofenotypizační a molekulárně-genetická vyšetření jsou neméně důležité k určení diagnózy, vstupního stagingu i prognózy onemocnění [2,9].
Obr. 1. EATL (s enteropatií asociovaný T-buněčný lymfom) u 76leté nemocné s celiakií. Endoskopicky mnohočetné ulcerace s polypoidní infiltrací sliznice ilea – dvojbalonová enteroskopie. Fig. 1. EATL (with enteropathy associated T-cell lymphoma) in 76-year-old patient with celiac disease. Multiple ulcers with endoscopically polypoid mucosa infiltration of the ileum – double -balloon enteroscopy. 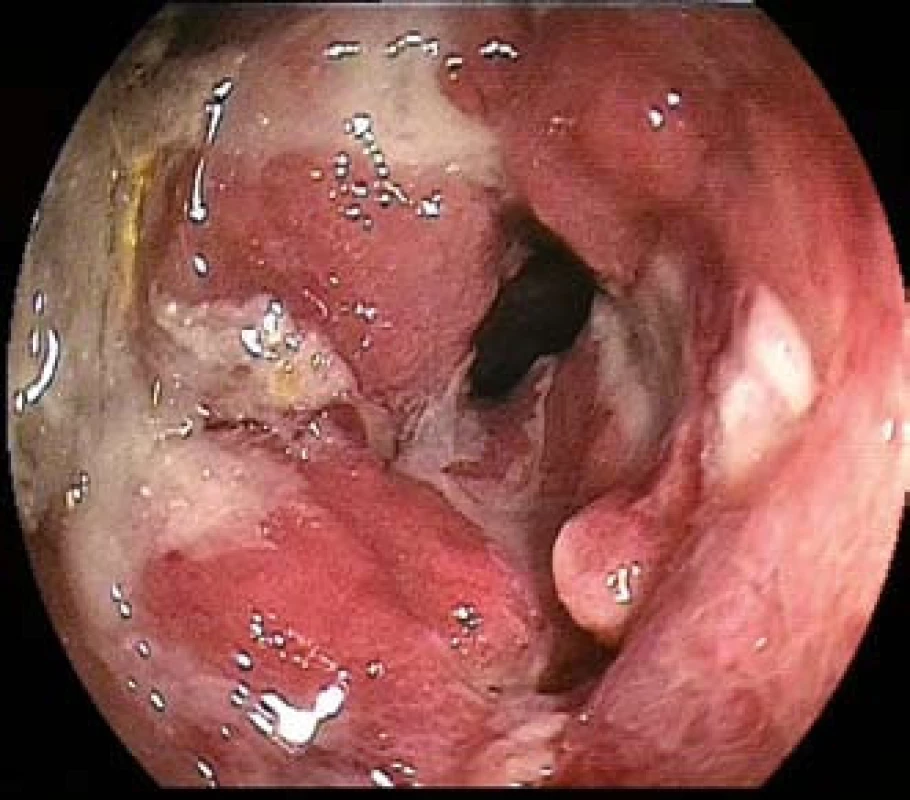
Obr. 2. Difuzní velkobuněčný B-buněčný lymfom jejuna u 58letého pacienta s recentně diagnostikovanou celiakií. Dvojbalonová enteroskopie prokazuje mnohočetné ulcerace tenkého střeva. Fig. 2. Diffuse large B-cell lymphoma of the jejunum of 58-year-old patient recently diagnosed with celiac disease. Double-balloon enteroscopy shows multiple ulcers of the small intestine. 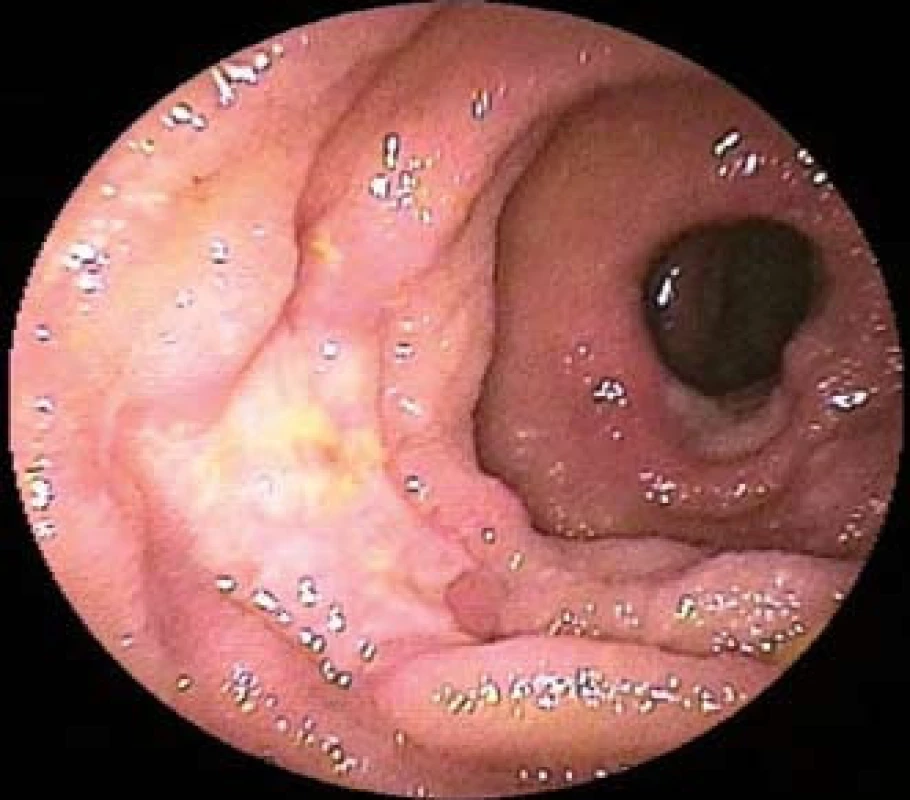
Obr. 3. MALT lymfom jejuna u 43letého pacienta s Crohnovou chorobou. Gastroskop zavedený do oblasti duodenojejunálního přechodu prokazuje infiltraci slizničních řas s zřetelnou patologickou neovaskularizací. Fig. 3. MALT lymphoma of the jejunum in 43-year-old patient with Crohn's disease. Gastroscope introduced in duodeno-jejunal transition shows infiltration mucosal folds with distinct pathological neo-vascularization. 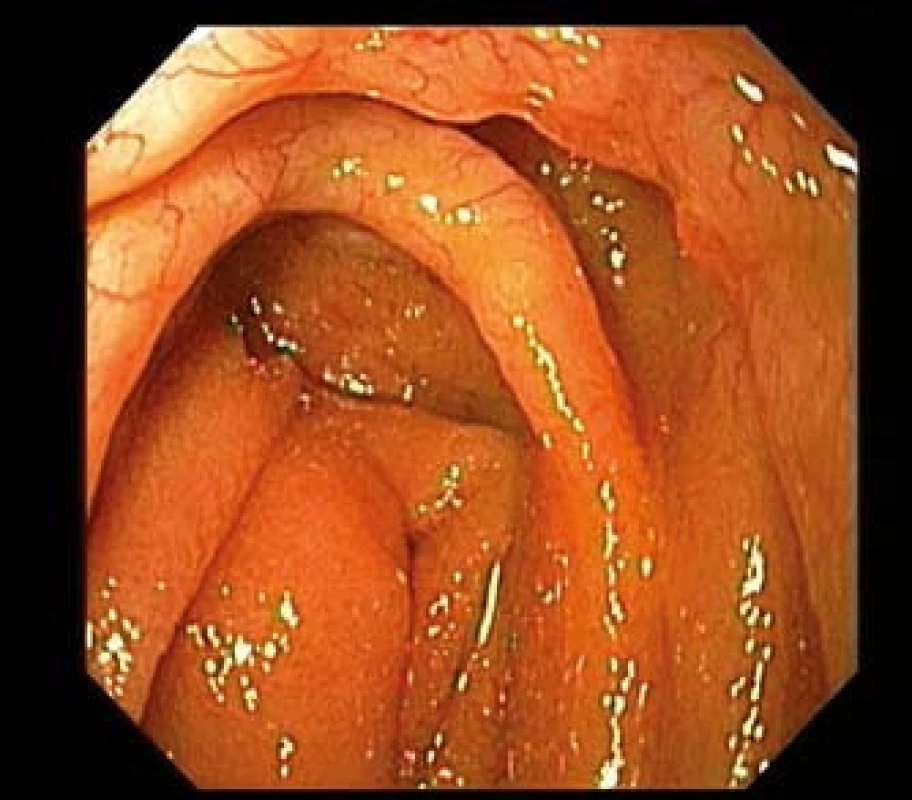
Obr. 4. MALT lymfom jejuna u 70leté pacientky s mikrocytární anemií. Dvojbalonová enteroskopie. Fig. 4. MALT lymphoma of the jejunum in 70-year-old patient with microcytic anemia. Double-balloon enteroscopy. 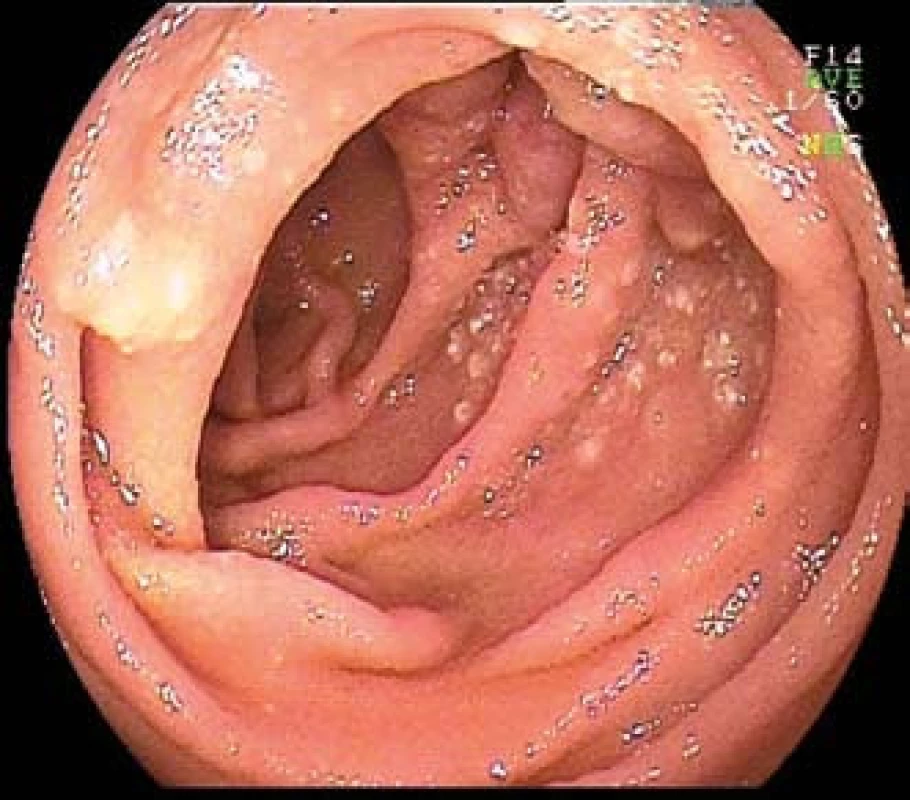
Ke stagingu primárních GIT lymfomů je používána modifikovaná Musshoffova Ann Arbor klasifikace, v poslední úpravě z konference v Luganu v roce 1993, tzv. Blackledge klasifikace (tab. 1) [8,9,11].
Tab. 1. Blackledge klasifikace lymfomů tenkého střeva. Tab. 1. Blackledge classification of lymphoma of the small intestine. 
Prognózu onemocnění, stejně jako u nodálních lymfomů, vyjadřuje mezinárodní prognostický index (international prognostic index – IPI), který zohledňuje věk, stadium onemocnění, výkonnostní stav, hladinu laktátdehydrogenázy a počet postižených extranodálních orgánů. Jako další nepříznivé prognostické faktory střevních lymfomů jsou uváděny: velikost tumoru nad 8 cm, T-buněčný typ, přítomnost „B“ symptomů a perforace [2,3,8,9].
Primární lymfomy tenkého střeva jsou heterogenní skupinou téměř výhradně zastoupenou nehodgkinskými lymfomy, častěji B-buněčného typu (v 70 %). Difuzní velkobuněčný lymfom a extranodální B-buněčný lymfom marginální zóny typu MALT jsou vůbec nejčastějšími primárními střevními lymfomy. Burkittův lymfom je onemocněním hlavně dětského věku Středního východu a Afriky (endemická forma). Je asociován s EBV a HIV infekcí. V našich podmínkách se vyskytuje jeho sporadická forma. Imunoproliferační choroba (IPSID) nebo také nemoc těžkých řetězců je vázaná na infekci Campylobacter jejuni, infiltruje proximální část tenkého střeva plazmocyty, které produkují těžké řetězce imunoglobulinu A. Endemicky se vyskytuje v oblasti Středního východu. Lymfom z plášťových buněk (mantle cell lymphoma) často imituje střevní polypózu s postižením terminálního ilea a jejuna. Folikulární lymfom střeva je vzácný, postihující hlavně terminální ileum a perivaterskou oblast. Endoskopicky imponuje jako drobné polypy či nodulovaná sliznice. T-buněčné lymfomy jsou zastoupeny ve 30 % případů primárních lymfomů tenkého střeva a nejčastějším z nich je T-buněčný lymfom asociovaný s enteropatií (EATL). Jiné typy nesdružené s enteropatií (anaplastický lymfom, periferní T-buněčný lymfom a NK/T lymfom) jsou vzácné [1,2,9,17,18].
Patogeneze střevních lymfomů je nejlépe známá u EATL vznikajícího v terénu celiakie. První zmínka o koincidenci těchto onemocnění je z roku 1962. Od té doby byly publikovány četné práce zaměřené na vztah mezi celiakií a T-buněčným lymfomem, který je dle současné WHO klasifikace označován jako EATL (s enteropatií asociovaný T-buněčný lymfom) (obr. 1). Dle výsledků nejrozsáhlejí prospektivní studie monitorující incidenci lymfomu u pacientů s celiakií, provedené v letech 1964–1995 švédskými autory [19], vyplývá, že lymfom je vzácnou komplikací tohoto onemocnění. U 11 650 sledovaných pacientů s celiakií byl v tomto období lymfom diagnostikován u 56 nemocných. Poměr T-buněčných NHL k B-buněčným NHL byl 70 % ke 30 %. Nejčastějším subtypem byl EATL, z celkového počtu všech lymfomů však tvořil pouze 30 %. Primárně střevní původ lymfomu byl stejně častý jako mimostřevní [19]. Obdobné populační studie byly provedeny také ve Finsku [20], Anglii [21] a Nizozemsku [22]. Riziko vzniku lymfomu je zvýšené u neléčené celiakie, a to 3–5krát. Striktní bezlepková dieta toto riziko snižuje po pěti letech na riziko běžné populace [19]. EATL je často diagnostikován po 50. roce života, ne výjimečně současně s nerozpoznanou celiakií či krátce po stanovení diagnózy celiakie. Patogeneze vzniku lymfomu souvisí s refrakterní celiakií (5–10 % pacientů), která je definována jako přetrvávání symptomů a intestinální atrofie při dodržování striktní bezlepkové diety a dělí se na dva typy. U refrakterní celiakie 1. typu jsou ve sliznici ve zvýšeném počtu přítomny polyklonální T-lymfocyty s normálním imunofenotypem, tj. povrchová exprese CD3+ CD8+ s převahou αβ T-buněčného receptoru. Počet intraepiteliálních T-lymfocytů nesoucích γδ T-buněčný receptor nepřekračuje 40 %. Chybění povrchové exprese znaku CD3, CD8 s přesunem exprese CD3 intraepiteliálně a převahou γδ T-buněčného receptoru jsou typické znaky tzv. aberantních T-lymfocytů, které jsou charakteristické pro refrakterní celiakii 2. typu, a to v poměru nad 20 %. Klonální expanze aberantních lymfocytů vede ke vzniku EATL, ke kterému dospěje 50 % pacientů s refrakterní celiakií 2. typu v průběhu pěti let. Proto je refrakterní celiakie 2. typu často označována jako „a window to lymphoma“ [23,24]. V patogenezi vzniku B-lymfomu u pacientů s celiakií se předpokládá, že vzniká v důsledku dlouhodobého chronického zánětu. Polovina pacientů s lymfomem a celiakií má primárně mimostřevní postižení, což je v důsledku diseminace klonálních lymfocytů cévním řečištěm [25–27].
Léčba lymfomů tenkého střeva, tak jako ostatních lymfomů, je v kompetenci hematoonkologa. Základem léčby je chemoterapie, biologická léčba (imunoterapie) anti-CD20 u lymfomů B původu, radioterapie či jejich kombinace. Transplantace autologních kmenových buněk v terapii EATL je dosud předmětem klinických studií [5]. Chirurgická léčba se v současnosti uplatňuje při komplikacích onemocnění jako ileus, perforace či krvácení do trávicího traktu [3,9].
Lymfomy tenkého střeva jsou vzácná onemocnění trávicího traktu s nespecifickou symptomatologií. Role gastroenterologa spočívá v diagnostice a ve spolupráci s hematoonkologem, ve sledování pacienta a v hodnocení efektu léčby.
Práce vznikla v rámci výzkumného projektu UK: PRVOUK 37-08.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
Doručeno: 30. 8. 2013
Přijato: 2. 10. 2013
MUDr. Paula Sopirjaková
II. interní gastroenterologická klinika
FN Hradec Králové
Sokolská 581, 500 05 Hradec Králové
sopirpau@fnhk.cz
Zdroje
1. Domizio P, Owen RA, Stepherd NA et al. Primary lymphoma of the small intestine. A clinicopathological study of 119 cases. Am J Surg Pathol 1993; 17(5): 429–442.
2. Ghimire P, Wu GY, Zhu L. Primary gastrointestinal lymphoma. World J Gastroenterol 2011; 17(6): 697–707.
3. Wang GB, Xu GL, Luo GY et al. Primary intestinal non-Hodgkin’s lymphoma in China. World J Gastroenterol 2011; 17(41): 4625–4631.
4. Freedman AS. Clinical presentation and diagnosis of primary gastrointestinal lymphomas [online]. Wellesley: UpToDate 2013 : 21.2.
5. Freedman AS. Management of gastrointestinal lymphomas [online]. Wellesley: UpToDate 2013 : 21.2.
6. Dawson IM, Cornes JS, Morson BC. Primary malignant lymphoid tumours of the intestinal tract. Report of 37 cases with a study of factors influencing prognosis. Br J Surg 1961; 49 : 80–89.
7. Lewin KJ, Ranchod M, Dorfman RF. Lymphomas of the gastrointestinal tract: a study of 117 cases presenting with gastrointestinal disease. Cancer 1978; 42(2): 693–707.
8. Aledavood A, Nasiri MR, Memar B et al. Primary gastrointestinal lymphoma. J Res Med Sci 2012; 17(5): 487–490.
9. Tomíška M, Vášová I, Adam Z et al. Primární lymfomy zažívacího traktu: I. klasifikace, patogeneze a diagnostika. Klin Onkol 2002; 15 : 47–57.
10. Vaidya R, Habermann TM, Donohue JH et al. Bowel perforation in intestinal lymphoma: incidence and clinical features. Ann Oncol 2013; 24(9): 2439–2443.
11. Koch P, del Valle F, Berdel WE et al. Primary gastrointestinal non-Hodkin´s lymphoma: I. Anatomic and histologic distribution, clinical features and survival data of 371 patients registered in the German Multicenter Study GIT NHL 01/92. J Clin Oncol 2001; 19(18): 3861–3873.
12. Bureš J, Rejchrt S et al. Vyšetření tenkého střeva a enteroskopický atlas. Praha: Grada Publishing 2001.
13. Cyrany J, Pintér M, Tycová V et al. Trimodality imaging of colonic lymphoma. Endoscopy 2009; 41 (Suppl 2): E1–E2.
14. Kopácová M, Rejchrt S, Tycová V et al. Tumorous neo-vascularization: a newly recognized endoscopic feature of intestinal non-Hodgkin lymphoma. Endoscopy 2007; 39 (Suppl 1): E95.
15. Sopirjaková P, Podhola M, Kopácová M et al. Case 1-2011: small intestinal diffuse large B-cell lymphoma in a 58-year-old patient with coeliac disease. Acta Medica (Hradec Kralove) 2011; 54(1): 25–28.
16. Tachecí I et al. Kapslová endoskopie. Hradec Králové: Nucleus 2008.
17. Foss HD, Stein H. Pathology of intestinal lymphomas. Recent Results Cancer Res 2000; 156 : 33–41.
18. Grajo JR, Kayton ML, Steffensen TS et al. Presentation of ileal Burkitt lymphoma in children. J Radiol Case Rep 2012; 6(8): 27–38.
19. Smedby KE, Akerman M, Hildebrand H et al. Malignant lymphomas in coeliac disease: evidence of increased risks for lymphoma types other than enteropathy-type T cell lymphoma. Gut 2005; 54(1): 54–59.
20. Viljamaa M, Kaukinen K, Pukkala E et al. Malignancies and mortality in patients with coeliac disease and dermatitis herpetiformis: 30-year population-based study. Dig Liver Dis 2006; 38(6): 374–380.
21. Anderson LA, McMillan SA, Watson RG et al. Malignancy and mortality in a population-based cohort of patients with coeliac disease or „gluten sensitivity“. World J Gastroenterol 2007; 13(1): 146–151.
22. Verbeek WH, Van De Water JM, Al-Toma A et al. Incidence of enteropathy – associated T-cell lymphoma: a nation-wide study of a population-based registry in The Netherlands. Scand J Gastroenterol 2008; 43(11): 1322–1328.
23. Mulder CJ, Wahab PJ, Moshaver B et al. Refractory coeliac disease: a window between coeliac disease and enteropathy associated T cell lymphoma. Scand J Gastroenterol Suppl 2000; 232 : 32–37.
24. Nijeboer P, van Wanrooij RL, Tack GJ et al. Update on the diagnosis and management of refractory coeliac disease. Gastroenterol Res Pract 2013; 2013: 518483.
25. Howdle PD, Jalal PK, Holmes GK et al. Primary small-bowel malignancy in the UK and its association with coeliac disease. QJM 2003; 96(5): 345–353.
26. Malamut G, Afchain P, Verkarre V et al. Presentation and long-term follow-up of refractory celiac disease: comparison of type I with type II. Gastroenterology 2009; 136(1): 81–90.
27. Schuppan D, Junker Y, Barisani D. Celiac disease: from pathogenesis to novel therapies. Gastroenterology 2009; 137(6): 1912–1933.
Štítky
Detská gastroenterológia Gastroenterológia a hepatológia Chirurgia všeobecná
Článok vyšiel v časopiseGastroenterologie a hepatologie
Najčítanejšie tento týždeň
2013 Číslo 5- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Kombinace metamizol/paracetamol v léčbě pooperační bolesti u zákroků v rámci jednodenní chirurgie
- Antidepresivní efekt kombinovaného analgetika tramadolu s paracetamolem
- I „pouhé“ doporučení znamená velkou pomoc. Nasměrujte své pacienty pod křídla Dobrých andělů
- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
-
Všetky články tohto čísla
- Gastrointestinální onkologie
- Kvíz – postižení jater s normálními jaterními testy
- Metodika adresného zvaní občanů do českého programu screeningu nádorů tlustého střeva a konečníku
- Vliv klinických a molekulárních faktorů na odhad rekurence kolorektálních adenomů u dlouhodobě sledovaných pacientů
- Postavenie neoadjuvantnej terapie v multimodálnej liečbe karcinómu rekta – klinické výsledky
- Hereditárny difúzny karcinóm žalúdka
- Cílená léčba karcinomu pankreatu – minulost či budoucnost?
- Lymfomy tenkého střeva
- Stav onkochirurgické péče a vzdělávání v onkochirurgii v České republice
- Multidisciplinární přístup v diagnostice a léčbě karcinomu žaludku
- 1 000 transplantací jater v IKEM
- Prvních 1 000 transplantací jater v IKEM
- Transplantace jater pro chronickou hepatitidu C, význam protivirové léčby
- Transplantace jater pro primární sklerozující cholangitidu
- Méně časté indikace k ortotopické transplantaci jater
- Vývoj postupů v léčbě akutního selhání jater
- Endosonograficky navigovaná tenkoihlová aspiračná biopsia zo solídnych pankreatických más – presnosť a impakt na liečbu u 358 pacientov
- Správná odpověď na kvíz
- Příprava tlustého střeva u pacientů s idiopatickými střevními záněty před endoskopickými nebo kolografickými (CT/MR) vyšetřeními – stanovisko IBD pracovní skupiny
-
XXII. jarní setkání Loket 2013 – Neoplazie žaludku
3. postgraduální kurz společnosti pro gastrointestinální onkologii - Životní jubileum prof. Miroslava Zavorala
- Picoprep – očistný prostředek s dvojím účinkem
- Autodidaktický test: gastrointestinální onkologie
- Gastroenterologie a hepatologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Picoprep – očistný prostředek s dvojím účinkem
- Lymfomy tenkého střeva
- Transplantace jater pro primární sklerozující cholangitidu
- Hereditárny difúzny karcinóm žalúdka
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



