-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Multidisciplinární přístup v diagnostice a léčbě karcinomu žaludku
Multidisciplinary approach in diagnostics and treatment of gastric cancer
The incidence of gastric cancer has been declining globally but mortality remains high. The only curative approach is surgery. Endoscopic mucosal resection can be used in early clinical stages. Only a multidisciplinary approach involving a surgeon, a gastroenterologist, and an oncologist can produce the comprehensive strategy in locally advanced gastric cancer. Gastrectomy with the lymph node dissection in combination with chemotherapy and radiotherapy prolongs overall survival. Palliative chemotherapy involving Fluoropyrimidine and Cisplatin is indicated in a metastatic setting. The addition of trastuzumab to chemotherapy is the standard of care in HER2-positive oesophageal and gastric adenocarcinomas and leads to an improved overall survival from 10 months to 13 months.
Key words:
gastric cancer – multimodal treatment – chemotherapy
Autoři: R. Obermannová 1; J. Novák 1,2; I. Novotný 3; L. Němec 4; R. Vyzula 1
Působiště autorů: Klinika komplexní onkologické péče, MOU, Brno 1; Úsek národního onkologického registru, MOÚ, Brno 2; Gastroenterologická ambulance, MOÚ, Interní gastroenterologická klinika FN Brno 3; Chirurgické oddělení, MOÚ, Brno 4
Vyšlo v časopise: Gastroent Hepatol 2013; 67(5): 390-395
Kategorie: Gastrointestinální onkologie: přehledová práce
Souhrn
Karcinom žaludku je onemocnění s celosvětově klesající incidencí, avšak vysokou mortalitou. Chirurgická léčba je v současné době stále jediným kurativním řešením. U časných stadií je alternativou endoskopická resekce. Léčba lokálně pokročilého karcinomu žaludku je komplexní, základem je multidisciplinární tým složeným z chirurga, gastroenterologa a onkologa. Operace s odstraněním odpovídajícího počtu spádových lymfatických uzlin v kombinaci s chemoterapií a radioterapií vede k statisticky významnému prodloužení přežití. V léčbě metastatického onemocnění se uplatňuje paliativní chemoterapie na bázi fluoropyrimidinu a cisplatiny. Trastuzumab, monoklonální protilátka proti HER2-neu, je indikován v kombinaci s chemoterapií u HER2-pozitivního karcinomu distálního jícnu a žaludku, touto kombinací bylo dosaženo prodloužení přežití z 10 na 13 měsíců.
Klíčová slova:
karcinom žaludku – multimodální léčba – chemoterapieKarcinom žaludku je onemocnění s celosvětově klesající incidencí, přesto zůstává čtvrtým nejčastějším zhoubným nádorem. Dle údajů ÚZIS ČR za rok 2010 (publikováno v roce 2013) onemocní v ČR 18,5 mužů a 11,8 žen/100 000 obyvatel.
Nejčastější anatomickou lokalizací karcinomu žaludku je v regionu „západních zemí“ oblast malé kurvatury, kardie a gastroezofageální junkce (GEJ). Zatímco výskyt distálního karcinomu žaludku v Evropě klesá, incidence nádoru kardie stagnuje a narůstá incidence nádorů GEJ a distálního jícnu. Pozdní záchyt, převaha nepříznivého histologického typu difuzního karcinomu, je v zemích s nižší incidencí, kam řadíme i ČR, příčinou špatné prognózy. Adenokarcinom žaludku je onemocnění staršího věku, medián věku u mužů je 69 let, u žen pak 74 let [1]. V mladším věku převažuje histologický typ agresivního difuzního karcinomu. Zvláštní jednotkou je pak hereditární difuzní karcinom žaludku, autozomálně dominantně dědičný tumor charakterizovaný zárodečnou mutací v E-cadherin genu (CDH1) [2]. Ačkoli došlo v posledních dekádách k zlepšení diagnostiky, pětileté přežití stagnuje na 25,7 %. Adenokarcinom je nejčastějším histologickým typem nádoru vyskytujícím se v žaludku (95 %), méně častým je lymfom, GIST (gastrointestinální stromální tumor) nebo NET – neuroendokrinní tumor.
Etiopatogeneze karcinomu žaludku
Etiologické vlivy jsou rozdílné v případě distálního typu adenokarcinomu, karcinomu kardie a nádoru difuzního typu. Adenokarcinom distálního typu vzniká v souvislosti se zevními environmentálními vlivy. Z dietních vlivů se na vzniku podílí zvýšený příjem soli, konzervovaných a uzených potravin, alkoholu, kouření, dále nízký příjem čerstvého ovoce a zeleniny a vysoký BMI. Také druh krevní skupiny hraje roli v incidenci karcinomu žaludku. Osoby s krevní skupinou A mají o 20 % vyšší riziko vzniku nádoru [3]. Pravidelné užívání NSAID (nesteriodních antiflogistik) je inverzně asociováno se vznikem distálního adenokarcinomu [4]. Podle teorie Correy et al [5] je vznik karcinomu postupný, od prekancerózy až k invazivnímu karcinomu. Základní výchozí změnou jsou zánětlivé změny a personifikovaný agens Helicobacter pylori (HP). Recentní data ukázala, že perzistující HP zvyšuje cca 3× riziko karcinomu žaludku. Význam eradikce infekce v redukci rizika zatím není znám. Mimo HP je popsán i vliv infekce virem Ebstein-Baarové. Tento herpes virus se podílí na vzniku cca 10 % karcinomů žaludku. Infekt vyvolává zánět, k preexistujícímu zánětu pak přistupují shora uvedené dietní vlivy. Dalším vlivem podílejícím se na etiopatogenezi je reflux žlučových kyselin. Všechny změny vedou postupně k rozvoji atrofické gastritidy až intestinální metaplazie a dysplazie jako předstupně intestinálního adenokarcinomu. [6]. Z genetických změn u sporadického karcinomu žaludku hraje nejvýznamnější roli inaktivace p53 (ať již delecí či supresí) a dále COX-2. Zatímco u nádoru distálního jícnu se považuje za významný patogenetický vliv reflux žaludečních šťáv, patogeneze nádoru kardie se pravděpodobně shoduje s vlivy u vlastního nádoru žaludku. V případě difuzního karcinomu žaludku je etiologie mnohem méně objasněna, předpokládá se spíše genetický vliv. Nejčastější genetickou abnormalitou je mutace genu pro E-cadherin (CDH1). Tato mutace je asociována s hereditárním difuzním karcinomem žaludku manifestujícím se v nízkém věku. Somatická mutace regulačního genu na 16q vede k 70% celoživotnímu riziku vzniku karcinomu.
Histopatologická klasifikace a hodnocení rozsahu onemocnění (staging)
Histologický (morfologický) typ a hloubka invaze primárního nádoru jsou u karcinomu žaludku nejvýznamnějšími prognostickými faktory.
Morfologická typizace se provádí podle Mezinárodní klasifikace nemocí pro onkologii [7]. U nádorů žaludku patologové často používají WHO klasifikaci nádorů zažívacího traktu [8], která je téměř identická s klasifikací MKNO-O-3. V praxi se můžeme setkat také s dřívější klasifikací podle Lauréna [9], která vedle skupiny neklasifikované rozděluje karcinomy žaludku na typ intestinální a difuzní (tab. 1).
Tab. 1. Histologická klasifikace karcinomů žaludku. Tab. 1. Histological classification of a stomach cancers [9]. ![Histologická klasifikace karcinomů žaludku.
Tab. 1. Histological classification of a stomach cancers [9].](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/73cfbffe12d5ad7a79f1e0e1e2b9cad5.png)
Tab. 2. Léčebné modality u nemocných s karcinomem žaludku. Tab. 2. A therapeutical modalities in patients with gastric cancer. 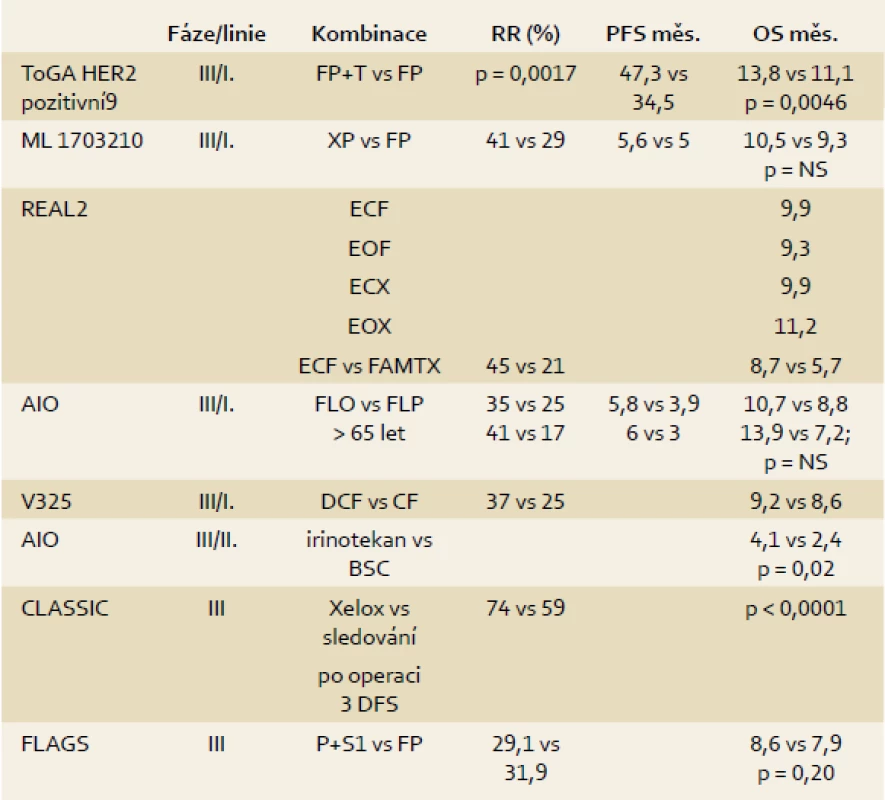
Prediktivním faktorem se u karcinomu žaludku jeví molekulární marker Her2/neu, který je podrobně prostudován a léčebně využíván u karcinomu prsu.
Rozsah zhoubného nádorového postižení se hodnotí podle TNM klasifikace [10], která se v podstatě shoduje s klasifikací AJCC [11]. Podle rozsahu nádoru v primární lokalizaci, rozsahu metastáz ve spádových mízních uzlinách a ve vzdálených orgánech se onemocnění rozděluje do stadií I–IV. U karcinomu žaludku a karcinomu gastroezofageální junkce je kritériem rozsahu primárního nádoru míra invaze do žaludeční stěny. Kritériem metastatického postižení regionálních mízních uzlin je jejich počet, přičemž histopatologické vyšetření resekátu by mělo zahrnovat nejméně 16 mízních uzlin.
Diagnostika
Základní diagnostickou metodou je endoskopie, vyšetření s nejvyšší senzitivitou a specificitou (senzitivita u časných stadií okolo 70 %). Chromoendoskopie (kombinace endoskopie s barvením časných slizničních lézí), NBI (narrow banding imaging), ZOOM endoskopie a endoskopie s vysokým rozlišením s cílem identifikace časných slizničních změn se stále častěji uplatňují v běžné endoskopické praxi a nejen v zemích s vysokou incidencí tohoto onemocnění. Jsou přínosné v identifikaci a v rozhodování o způsobu řešení časného karcinomu před eventuálním kurativním endoskopickým výkonem (endoskopickou submukózní resekcí – EMR, nebo endoskopickou submukózní direkcí – ESD). Nedílnou součástí diagnostiky karcinomu žaludku je endosonografické vyšetření, které je zásadní v upřesnění předoperační TNM klasifikace, hloubky invaze a postižení okolních lymfatických uzlin. Samozřejmostí je stagingové CT vyšetření hrudníku, břicha a pánve. Při podezření na metastatické onemocnění je předoperačně indikováno i PET/CT vyšetření, jehož přínos je limitován u mucinózního a difuzního karcinomu, hraje však roli v posouzení případného peritoneálního rozsevu. Diagnostická laparoskopie s peritoneálním washingem je indikována v případě lokálně pokročilého karcinomu při podezření na peritoneální rozsev. Toto invazivní vyšetření však ještě není akceptováno na všech pracovištích [12]. Nádorové markery CEA, Ca 19-9 a Ca 72-4 mají význam ve sledování dynamiky onemocnění v průběhu léčby a při dispenzarizaci.
Léčebné modality u karcinomu žaludku
Chirurgická léčba představuje v současné době jediné kurativní řešení.
Endoskopické metody
Endoskopická resekce je metoda, při níž je s kurativním záměrem odstraněn nádor. Výkon je prováděn v rozsahu sliznice a části přilehlé submukózy. Je-li řez proveden diatermkoagulační kličkou, jedná se o endoskopickou submukózní resekci (EMR), je-li proveden speciálním diatermokoagulačním nožem, jde o endoskopickou submukózní disekci. Tyto metody vyžadují značné zkušenosti a erudici endoskopického týmu. Indikační kritéria jsou přísná, zahrnují nádory menší než 20 mm, nádory příznivého makroskopického typu, dobře až středně diferencované, bez vaskulární invaze, bez průkazu lymfadenopatie. Většina autorů preferuje endoskopickou léčbu u karcinomů intramukózních a u nádorů postihujících horní třetinu submukózy [13]. S hloubkou invaze nádoru do submukózy vzrůstá riziko postižení lymfatických uzlin. Randomizované studie srovnávající standardní operační techniku s endoskopickými metodami zatím nebyly provedeny.
Chirurgická léčba
Jako jediná terapeutická metoda má u karcinomu žaludku kurabilní potenciál. U lokoregionálně pokročilých nádorů je základním chirurgickým postupem provedení gastrektomie – obvykle totální, výběrově subtotální (v případě distálně lokalizovaných tumorů menší velikosti, bez přítomnosti suspektních perigastrických uzlin a s přihlédnutím k histologické typizaci nádoru). Rekonstrukce se poté většinou provádí našitím exkludované kličky jejuna na jícen tak, jak poprvé popsal César Roux již v roce 1893. Výkon se standardně doplňuje odstraněním spádových lymfatických uzlin. Ty se dělí do tří kompartmentů (D1, D2 a D3) a jejich případná nádorová infiltrace výrazně zhoršuje prognózu onemocnění; v případě negativního nálezu na uzlinách je pravděpodobnost pětiletého přežití pacientů 60–70 %, v případě jejich pozitivity je pravděpodobnost pětiletého přežití pouze 20–35 % (důkazem pozdní manifestace karcinomu žaludku je též fakt, že v době stanovení diagnózy bývá postiženo nádorovou infiltrací 50–70 % spádových lymfatických uzlin). Z výše popsaných důvodů se v současnosti považuje perigastrická lymfadenektomie za nedílnou součást radikální gastrektomie a její neprovedení za postup non lege artis. Lymfadenektomie má kromě kurativního efektu též význam pro odhad prognózy a plánování následné léčby.
Rozsah lymfadenektomie zůstává stále diskutovaným problémem; radikalitu lymfadenektomie je nutno konfrontovat s mírou rizika pooperačních komplikací, jejichž četnost s extenzivitou výkonu narůstá. Na mnoha evropských pracovištích se stále standardně odstraňují pouze uzliny prvního kompartmentu (podél obou žaludečních křivin), což se označuje jako D1 lymfadenektomie.
Naproti tomu asijská pracoviště, a s nimi stále více pracovišť evropských (tedy i českých), ale považují za operační standard D2 lymfadenektomii, kdy se provádí disekce mízních uzlin podél a. hepatica communis, a. gastrica sin., truncus coeliacus a a. lienalis až ke slezinnému hilu. Určitým kompromisem je provedení tzv. modifikované radikální lymfadenektomie (nazývané též D1,5 lymfadenektomie), při níž se vynechává disekce uzlin podél a. lienalis a v hilu sleziny.
Nádorová infiltrace uzlin třetího kompartmentu se považuje již za metastatické postižení (M1), a D3 lymfadenektomie se proto v Evropě běžně neprovádí. Je předmětem zájmu asijských chirurgů, ale benefit tohoto superradikálního operačního výkonu dosud jednoznačně prokázán nebyl.
Systémová onkologická léčba
V léčbě lokálně pokročilého karcinomu žaludku používáme chemoterapii, radioterapii, v případě metastatického onemocnění pak i biologickou léčbu. Léčebné postupy v onkologii jsou dány doporučeními vznikajícími na základě výsledků randomizovaných multicentrických studií fáze III.
Adjuvantní léčbou rozumíme zajišťovací terapii, kterou aplikujeme u určitých stadií po radikální resekci nádoru s cílem zničení mikroskopické reziduální choroby a minimalizace rizika pozdější diseminace onemocnění.
Neoadjuvantní léčbou rozumíme léčbu podávanou předoperačně, jejím cílem je zmenšení nádorové masy a dále zamezení diseminace viabilních nádorových buněk v průběhu operace.
Paliativní chemoterapie, případně v kombinaci s biologickou léčbou, je vyhrazena pro pacienty po neradikálním chirurgickém výkonu nebo pro pacienty s metastatickým onemocněním.
Základními cytostatiky používanými u karcinomu žaludku je 5-fluorouracil (často v kombinaci s leukovorinem), dále deriváty platiny (cisplatina a oxaliplatina), epirubicin, taxany a irinotekan. Z biologické léčby v praxi používáme u pacientů s amplifikací genu pro HER2/neu trastuzumab, monoklonální protilátku proti transmembránovému tyrozinkinázovému receptoru HER2/neu patřícímu do rodiny HER proteinů. K amplifikaci dochází cca u 12 % intestinálních karcinomů, zatímco v případě difuzního karcinomu je Her2/neu amplifikován u méně než 2 % nádorů.
Nedílnou součástí onkologické léčby ať kurativní nebo paliativní je podpůrná terapie. Pacienti s karcinomem žaludku jsou ve vysokém riziku malnutrice již v době diagnostiky onemocnění, a proto je zásadní součástí onkologické léčby péče o výživu. Ideální je nutriční screening u všech pacientů s tímto onemocněním a jako součást týmu přítomnost nutričního terapeuta.
Léčba dle stadia onemocnění
Iniciální stadia, Tis,T1,2 N0M0
U iniciálních stadií, tzn. Tis,T1,2 N0, není indikována zajišťovací onkologická léčba.
Lokálně pokročilé onemocnění, T2-4,N1-3M0 (obr. 1)
Obr. 1. Léčba podle stadia onemocnění. Fig. 1. Therapy based on the disease staging. 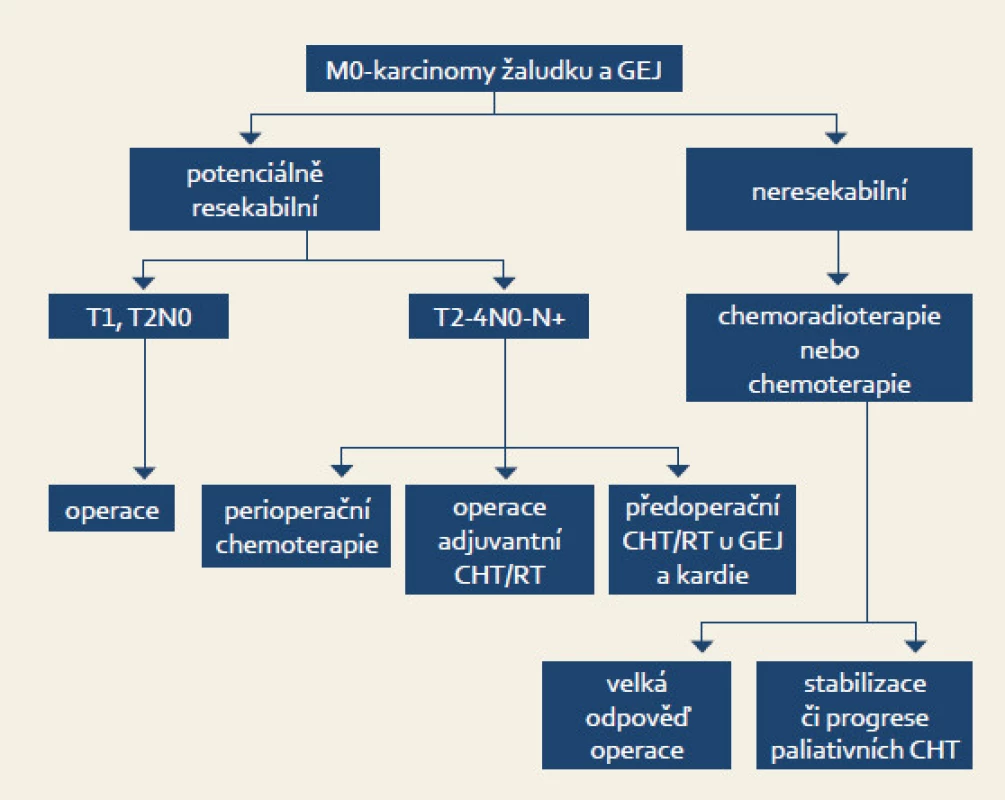
U lokálně pokročilých operabilních stadií byl historicky osvědčeným přístupem pouze operační výkon. V současné době však existují medicínská data pro použití tří léčebných modalit:
- adjuvantní chemoradioterapie
- perioperační chemoterapie (neoadjuvantní chemoterapie – operace – adjuvantní chemoterapie)
- adjuvantní chemoterapie
V roce 2001 byla publikována stěžejní adjuvantní studie Intergroup 0116 [14], na jejímž základě dodnes léčíme adjuvantní konkomitantní chemoradioterapií. Update po deseti letech prokázal zlepšení celkového přežití – medián OS 36 vs 27 měsíců; p = 0,0005. S ohledem na toxicitu konkomitantní léčby se však již nyní preferuje modifikovaný infuzní režim s fluorouracilem. Problémem však zůstává akutní toxicita radioterapie, která je aplikována na oblast lůžka žaludku, tedy na oblast dutiny břišní. Nežádoucí účinky původního konkomitantního režimu byly důvodem pro hledání jiné, méně toxické modality léčby. Tou se jeví použití perioperační chemoterapie.
Přínos perioperační chemoterapie prokázaly tři velké evropské studie fáze III [15–17]. V praxi nejčastěji používáme léčebné schéma: tři předoperační cykly režimem ECF (epirubicin, cisplatina, 5-fluorouracil), radikální operace, pooperačně další tři cykly chemoterapie. Tato léčba vede k statisticky významnému prodloužení doby do progrese (HR 0,66; p < 0,0001), usnadnění operability a statisticky významnému prodloužení pětiletého přežití 36 vs 23 % pro chemoterapii (p = 0,009).
Samostatná adjuvantní chemoterapie se používá hlavně v Asii. Nadějné výsledky má poslední publikovaná studie f. III CLASSIC [18]. Adjuvantní chemoterapie vedla po D2 lymfadenektomii k významnému snížení rizika recidivy, proto byla studie předčasně ukončena. Pro doplnění je třeba zmínit, že favorizovanou léčbou v případě nádoru distálního jícnu a kardie je neoadjuvantní konkomitantní chemoradioterapie [12,19,20].
Paliativní léčba
Paliativní chemoterapie zlepšuje kvalitu života a OS ve srovnání s BSC (nejlepší podpůrná léčba). Základním chemoterapeutickým režimem v první linii je kombinace založená na 5-fluorouracilu, případně jeho tzv. orálního prodrug-kapecitabinu, a cisplatině nebo oxaliplatině. Trojkombinace (s epirubicinem) je rezervována pro pacienty v dobrém fyzickém stavu. Přidání docetaxelu přineslo prodloužení OS a kvality života. Nevýhodou režimu je jeho vysoká toxicita [21]. Oxaliplatina je zaměnitelná s cisplatinou, substituce oxaliplatinou vedla ke snížení počtu trombembolických příhod u pacientů starších 65 let [22]. Trastuzumab v kombinaci s kapecitabinem nebo fluorouracilem a cisplatinou vedl ve studii f. III k prodloužení přežití u pacientů s amplifikací HER2/neu [23].
V rámci II. linie používáme cytostatika irinotekan, paclitaxel a docetaxel [24,25]. Použití další linie by mělo být individualizováno dle celkového stavu pacienta a chemosenzitivity onemocnění.
Nedílnou součástí paliativní léčby jsou paliativní výkony: zavedení endoluminálního stentu při obstrukci, paliativní resekce v případě obstrukce trávicí trubice nebo krvácení, nutnost zajištění výživy (operační gastrostomie, jejunostomie, paliativní spojkové operace), peritoneální drenáž.
Symptomatická léčba je samozřejmostí jak v případě probíhající paliativní chemoterapie, tak i následně po ukončení aktivní onkologické léčby.
Nové léky u karcinomu žaludku
Vyjma úspěšných biologických léků jako je trastuzumab v I. a II. linii či ramucirumab (jedná se o protilátku proti VEGF – vaskuárnímu endoteliálnímu růstovému faktoru – zatím není stanovena úhrada) ve II. linii byly s negativním výsledkem testovány ve studiích f. II, III bevacizumab, cetuximab a erlotinib (léky efektivní u kolorektálního karcinomu a karcinomu plic). Lapatinib, HER2/neu tyrozinkinázový inhibitor, byl testován ve dvou studiích f. III LOGIC a TyTAN. Předběžné výsledky jsou zatím zklamáním. S1 je perorální složený přípravek obsahující tegafur, gimestat a kyselinu oxoniovou. Byl vyvinut a v praxi je již roky rutinně používán v Asii, převážně v Japonsku, jak v adjuvanci, tak v paliativním podání. V Evropě jeho účinnost prokázala studie f. III FLAGS [26], na jejímž základě je registrován i k podání v I. linii paliativní chemoterapie v kombinaci s cisplatinou.
Závěr
Léčba karcinomu žaludku vyžaduje multidisciplinární přístup. Nosnou terapeutickou modalitou časných stadií zůstává stále chirurgická léčba. V rámci lokálně pokročilého onemocnění se terapeutický postup odvíjí od lokalizace tumoru a histologického typu. Konkomitantní neoadjuvantní chemoradioterapie je indikována u nádoru distálního jícnu a GEJ. Perioperační chemoterapie a modifikovaná konkomitantní chemoradioterapie jsou preferovaným terapeutickým postupem u lokálně pokročilého karcinomu žaludku. V paliativním podání používáme na prvním místě kombinaci 5-fluorouracilu a derivátu platiny či kombinaci s trastuzumabem při amplifikaci HER2//neu. I přes použití multimodální léčby je prognóza pacientů s metastatickým onemocněním nepříznivá, medián přežití však dosáhl hranice 13 měsíců. Nedílnou součástí komplexní terapie je kvalitní symptomatická léčba včetně péče o výživu.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
Doručeno: 15. 8. 2013
Přijato: 6. 9. 2013
MUDr. Radka Obermannová
Klinika komplexní onkologické péčeMasarykův onkologický ústavŽlutý kopec 7, 653 00 Brno
obermannova@mou.cz
Zdroje
1. SEER. SEER Stat Facts Sheets: Stomach Cancer [online]. Available from: http://www.seer.cancer.gov/statfacts/html/stomach.html.
2. Huntsman DG, Carneiro F, Lewis FR et al. Early gastric cancer in young, asymptomatic carriers of germ-line E-cadherin mutations. N Engl J Med 2001; 344(25): 1904–1909.
3. Edgren G, Hjalgrim H, Rostgaard K et al. Risk of gastric cancer and peptic ulcers in relation to ABO blood type: a cohort study. Am J Epidemiol 2010; 172(11): 1280–1285.
4. Wu CY, Wu MS, Kuo KN et al. Effective reduction of gastric cancer risk with regular use of nonsteroidal anti-inflammatory drugs in Helicobacter pylori-infected patients. J Clin Oncol 2010; 28(18): 2952–2957.
5. Correa P. Human gastric carcinogenesis: a multistep and multifactorial proces – first American Cancer Society award lecture on cancer epidemiology and prevention. Cancer Res 1992; 52(24): 6735–6740.
6. Kumar RK, Raj SS, Shankar EM et al. Gastric carcinoma: a review on epidemiology, current surgical and chemotherapeutic options [online]. Available from: http://dx.doi.org/10.5772/45896.
7. Mezinárodní klasifikace nemocí pro onkologii: MKN-O-3 ČV. 3. vyd. Praha: Ústav zdravotnických informací a statistiky ČR 2004.
8. WHO classification of tumours of the digestive system. 4th ed. Lyon: IARC Press 2010.
9. Lauren P. The two histological main types of gastric carcinoma: diffuse and so-called intestinal-type carcinoma. An attempt at a histo-clinical classification. Acta Pathol Microbiol Scand 1965; 64 : 31–49.
10. TNM klasifikace zhoubných novotvarů. 7. vyd. Praha: Ústav zdravotnických informací a statistiky ČR 2011.
11. Edge SB, Byrd DR, Compton CC et al. AJCC cancer staging handbook. 7th ed. New York: Springer 2010.
12. Ajani JA, Bentrem DJ, Besh S et al. Gastric cancer, version 2.2013: featured updates to the NCCN Guidelines. J Natl Compr Canc Netw 2013; 11(5): 531–546.
13. Šimša J et al. Endoskopická léčba. In: Šimša J (eds). Karcinom žaludku. 1. vyd. Praha: Maxdorf 2012 : 77–87.
14. Macdonald JS, Benedetti J, Smalley S et al. Chemoradiation of resected gastric cancer: A 10-year follow-up of the phase III trial INT0116 (SWOG 9008) J Clin Oncol 2009; 27 (20 Suppl): 4515.
15. Cunningham D, Allum WH, Stenning SP et al. Perioperative chemotherapy versus surgery alone for resectable gastroesophageal cancer. N Engl J Med 2006; 355(1): 11–20.
16. Boige V, Pignon JP, Saint-Aubert et al. Final results of a randomized trial comparing preoperative 5-FU to surgery alone in adeno-carcinoma of the stomach and Loir esofagus: FNLCC ACCORD07-FFCD 9703 trial. J Clin Oncol 2007; 25 (18 Suppl): 4510.
17. Van Cutsem E, Van de Velde C, Roth A et al. Expert opinion on management of gastric and gastro-oesophageal junction adenocarcinoma on behalf of the European Organisation for Research and Treatment of Cancer (EORTC) – gastrointestinal cancer group. Eur J Cancer 2008; 44(2): 182–194.
18. Bang YJ, Kim YW, Yang HK et al. Adjuvant capecitabine and oxaliplatin for gastric cancer after D2 gastrectomy (CLASSIC): a phase 3 open-label, randomised controlled trial. Lancet 2012; 379(9813): 315–321.
19. Petera J, Dvořák J, Melichar B et al. Chemoradioterapie v neoadjuvantní léčbě karcinomu žaludku. Klin Onkol 2002; 15(6): 216–218.
20. ESMO Clinical Recommendations. Ann Oncol 2010.
21. Van Cutsem E, Moiseyenko VM, Tjulandin S et al. Phase III study of docetaxel and cisplatin plus fluorouracil compared with cisplatin and fluorouracil as first-line therapy for advanced gastric cancer: a report of the V325 Study Group. J Clin Oncol 2006; 24(31): 4991–4997.
22. Okines AF, Norman AR, McCloud P et al. Meta-analysis of the REAL-2 and ML17032 trials: evaluating capecitabine-based combination chemotherapy and infused 5-fluorouracil-based combination chemotherapy for the treatment of advanced oesophago-gastric cancer. Ann Oncol 2009; 20(9): 1529–1534.
23. Bang YJ, Van Cutsem E, Feyereislova A et al. Trastuzumab in combination with chemotherapy versus chemotherapy alone for treatment of HER2-positive advanced gastric or gastro-oesophageal junction cancer (ToGA): a phase 3, open-label, randomised controlled trial. Lancet 2010; 376(9742): 687–697.
24. Ueda S, Hironaka S, Yasui H et al. Randomized phase III study of irinotecan (CPT-11) versus weekly paclitaxel (wPTX) for advanced gastric cancer (AGC) refractory to combination chemotherapy (CT) of fluoropyrimidine plus platinum (FP): WJOG4007 trial. J Clin Oncol 2012; 30 (Suppl): 4002.
25. Ford H, Marshall A, Wadsley J et al. A randomized phase III study of docetaxel versus active symptom control in advanced esophagogastric adenocarcinoma. J Clin Oncol 2012; 30 (Suppl 34): LBA4.
26. Ajani JA, Rodriguez W, Bodoky G et al. Multicenter phase III comparison of cisplatin/S-1 with cisplatin/infusional fluorouracil in advanced gastric or gastroesophageal adenocarcinoma study: the FLAGS trial. J Clin Oncol 2010; 28(9): 1547–1553.
Štítky
Detská gastroenterológia Gastroenterológia a hepatológia Chirurgia všeobecná
Článok vyšiel v časopiseGastroenterologie a hepatologie
Najčítanejšie tento týždeň
2013 Číslo 5- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Kombinace metamizol/paracetamol v léčbě pooperační bolesti u zákroků v rámci jednodenní chirurgie
- Antidepresivní efekt kombinovaného analgetika tramadolu s paracetamolem
- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
- Srovnání analgetické účinnosti metamizolu s ibuprofenem po extrakci třetí stoličky
-
Všetky články tohto čísla
- Gastrointestinální onkologie
- Kvíz – postižení jater s normálními jaterními testy
- Metodika adresného zvaní občanů do českého programu screeningu nádorů tlustého střeva a konečníku
- Vliv klinických a molekulárních faktorů na odhad rekurence kolorektálních adenomů u dlouhodobě sledovaných pacientů
- Postavenie neoadjuvantnej terapie v multimodálnej liečbe karcinómu rekta – klinické výsledky
- Hereditárny difúzny karcinóm žalúdka
- Cílená léčba karcinomu pankreatu – minulost či budoucnost?
- Lymfomy tenkého střeva
- Stav onkochirurgické péče a vzdělávání v onkochirurgii v České republice
- Multidisciplinární přístup v diagnostice a léčbě karcinomu žaludku
- 1 000 transplantací jater v IKEM
- Prvních 1 000 transplantací jater v IKEM
- Transplantace jater pro chronickou hepatitidu C, význam protivirové léčby
- Transplantace jater pro primární sklerozující cholangitidu
- Méně časté indikace k ortotopické transplantaci jater
- Vývoj postupů v léčbě akutního selhání jater
- Endosonograficky navigovaná tenkoihlová aspiračná biopsia zo solídnych pankreatických más – presnosť a impakt na liečbu u 358 pacientov
- Správná odpověď na kvíz
- Příprava tlustého střeva u pacientů s idiopatickými střevními záněty před endoskopickými nebo kolografickými (CT/MR) vyšetřeními – stanovisko IBD pracovní skupiny
-
XXII. jarní setkání Loket 2013 – Neoplazie žaludku
3. postgraduální kurz společnosti pro gastrointestinální onkologii - Životní jubileum prof. Miroslava Zavorala
- Picoprep – očistný prostředek s dvojím účinkem
- Autodidaktický test: gastrointestinální onkologie
- Gastroenterologie a hepatologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Picoprep – očistný prostředek s dvojím účinkem
- Lymfomy tenkého střeva
- Transplantace jater pro primární sklerozující cholangitidu
- Hereditárny difúzny karcinóm žalúdka
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



