-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Transplantace jater pro primární sklerozující cholangitidu
Liver transplantation for primary sclerosing cholangitis
Primary sclerosing cholangitis (PSC) is a chronic, progressive cholestatic liver disease of unknown origin. PSC is closely associated with inflammatory bowel disease, mainly ulcerative colitis (UC). PSC presents a significantly increased risk of hepatobiliary and colorectal neoplastic changes. PSC gradually leads to cirrhosis with a significant portal hypertension. No effective medical therapy is available and treatment with a high dosage of ursodeoxycholic acid could even lead to a number of adverse effects. Liver transplantation (OLTx) is the only curative option currently available to improve survival. In this study, a retrospective analysis was performed for all patients who underwent OLTx for PSC over a 20-year period in the Institute for Clinical and Experimental Medicine (IKEM), Prague.
Results:
A total of 102 patients underwent OLTx for PSC with a mean age of 37 years (14–68). Inflammatory bowel disease (IBD) was confirmed in 64 patients (62.8%) pre-LT. Except for three cases with Crohn’s disease, all patients suffered from UC. Cumulated 1-, 5-, 10 - and 15-year patient survival rates were 94.1%, 93.0%, 93.0% and 82.3% respectively. Recurrent PSC was determined in 28 patients (33.7%) with three who needed retransplantation. In six patients, cholangiocarcinoma was incidentally detected in explanted livers and three died due to advanced carcinoma. The course of ulcerative colitis (UC) was mild or in remission in 34/61 (55.7%) patients followed in our centre after OLTx without relevant clinical symptoms. The remaining 27 patients (44.3%) suffered from clinically active disease. Colectomy was performed in four patients due to refractory disease. On the other hand, UC newly developed in 13 patients after OLTx with a mild course of disease.Conclusion:
The outcome for patients with PSC who have undergone transplantation is excellent. PSC frequently recurs in the hepatic allograft but retransplantation is seldom necessary. The course of UC after OLTx for PSC is frequently active despite immunosuppressive treatment. Detection of dysplastic changes and CRC confirm the usefulness of regular colonoscopic evaluations. New onset of UC can develop after OLTx. Incidentally found cholangiocarcinoma remains a difficult treatment problem with a low survival rate.Key words:
liver transplantation – primary sclerosing cholangitis – ulcerative colitis – cholangiocarcinoma – colorectal cancer
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE „uniform requirements“ for biomedical papers.Submitted:
21. 8. 2013Accepted:
16. 9. 2013
Autoři: P. Drastich 1
; L. Bajer 1; P. Wohl 1; D. Kamenář 1; J. Špičák 1; E. Honsová 2; P. Trunečka 3
Působiště autorů: Klinika hepatogastroenterologie, IKEM, Praha 1; Pracoviště klinické a transplantační patologie, IKEM, Praha 2; Transplantcentrum, IKEM, Praha 3
Vyšlo v časopise: Gastroent Hepatol 2013; 67(5): 413-420
Kategorie: Hepatologie: původní práce
Souhrn
Primární sklerozující cholangitida (PSC) je chronické cholestatické jaterní onemocnění s progresivním průběhem a neznámou etiopatogenezí. Průběh PSC je v těsném vztahu s výskytem idiopatického střevního zánětu (IBD), především pak s ulcerózní kolitidou (UC). Pacienti jsou zatíženi vysokým rizikem neoplastických změn, a to především v hepatobiliární oblasti a v kolon. V terminálním stadiu se PSC vyvíjí v cirhózu s výraznou portální hypertenzí. Dosud neexistuje efektivní medikamentózní léčba a podávání kyseliny ursodeoxycholové ve vysokých dávkách může být zatíženo vysokým výskytem nežádoucích účinků. Jaterní transplantace představuje v současnosti jediný kurativní přístup. Do retrospektivní analýzy jsme zařadili všechny nemocné s PSC, kteří podstoupili jaterní transplantaci (TXJ) během posledních 20 let v IKEM.
Výsledky:
Celkem se jednalo o 102 nemocných s mediánem věku při TXJ 37 let (14–68). IBD bylo potvrzeno u 64 nemocných (62,8 %) před TXJ. Kromě tří případů s Crohnovou chorobou se vždy jednalo o UC. Kumulativní přežívání bylo v 1, 5, 10 a 15 letech; 94,1 %, 93,0 %, 93,0 % a 82,3 %. Rekurence PSC (rPSC) byla potvrzena u 28 pacientů (33,7 %), u tří z nich vedla rPSC k retransplantaci. V šesti případech byl nalezen cholangiocelulární karcinom v jaterním explantátu, 50 % z těchto nemocných pak zemřelo na nádorovou progresi. Průběh ulcerózní kolitidy byl mírný nebo bylo onemocnění v remisi u 34/61 (55,7 %) nemocných sledovaných v IKEM po TXJ. U zbývajících 27 pacientů (44,3 %) probíhal střevní zánět aktivně. Čtyři nemocní podstoupili kolektomii v důsledku refrakterního průběhu kolitidy. De novo ulcerózní kolitida byla zjištěna u 13 nemocných po TXJ, a to vždy s mírným průběhem.Závěr:
Výsledky transplantační léčby nemocných s PSC jsou vynikající. V jaterním štěpu dochází často k rekurenci jaterního onemocnění, které si někdy vyžaduje i provedení retransplantace. Průběh UC po TXJ může být aktivní, a to i přes imunosupresivní léčbu. Pravidelná kolonoskopická vyšetření (interval 1–2 roky) jsou nezbytná k detekci častých kolorektálních neoplazií. Po TXJ může dojít i k výskytu de novo IBD. Nález cholangiocelulárního karcinomu v jaterním štěpu (incidentalom) představuje závažný problém a negativně ovlivňuje přežití.Klíčová slova:
transplantace jater – primární sklerozující cholangoitida – ulcerózní kolitida – cholangiocelulární karcinom – kolorektální karcinomPrimární sklerozující cholangoitida (PSC) je chronické cholestatické jaterní onemocnění neznámé etiologie charakterizované zánětlivým postižením intra - a/nebo extrahepatálního žlučového stromu s probíhající destrukcí, progresivní fibrózou a stenózami žlučovodů. Onemocnění bylo poprvé detailně popsáno Delbetem v roce 1924 a bylo považováno za raritní, do roku 1970 bylo kazuisticky popsáno pouze 100 případů. Rozvoj nových vyšetřovacích metod, jako jsou ERCP a později i MRCP, vedlo k poznání, že se jedná o mnohem častější chorobu. Multifokální striktury žlučového stromu způsobují laboratorní cholestázu a na zobrazovacích metodách charakteristický vzhled „růžence“.
Etiopatogeneze PSC není v současnosti známa i přes velký pokrok učiněný v poslední době. Důležitou roli hrají genetické vlivy a sourozenci nemocných s PSC nesou 9 - až 39násobné riziko rozvoje tohoto onemocnění ve srovnání s obecnou populací, navíc jsou zatíženi i vyšším rizikem vzniku ulcerózní kolitidy (UC) [1]. Genetická vnímavost je spojena s určitými HLA znaky (např. B8, DR2, DR3, DR4, DRw52a). Na základě rozboru genomových asociačních studií (GWAS) bylo prokázáno zapojení i non-HLA genů při vzniku nemoci (BCL2L11, MST1). Dalším faktorem uplatňujícím se v patogenezi jsou autoimunitní rysy onemocnění, až u 90 % nemocných nacházíme specifický typ pANCA. Důležitou roli hrají i složky přirozené imunity. Těsná asociace mezi PSC a UC vede k hypotéze, že střevní bakterie nebo jiné substance mohou migrovat ze zánětlivé střevní sliznice a způsobit chronický zánět a cholangoitidu [2]. Mezi další hypotézy vyplývající z těsné asociace PSC s idiopatickými střevními záněty (IBD) patří představa, že za zánětlivé změny v oblasti žlučového stromu jsou zodpovědné paměťové buňky generované ve střevě. Tato hypotéza je podpořena expresí VAP 1 (vaskulární adhezní protein) a MAdCAM-1(mukosální adresinová buněčná adhezní molekula-1) v oblasti střeva a jater. Některé studie se zaměřují i na složení žluče. Zajímavé je, že varianty ABCB4 genu (MDR3), které se uplatňují v patogenezi některých intrahepatálních cholestáz, ovlivňují i progresi PSC [3].
PSC může klinicky probíhat, ale zároveň i progredovat poměrně nenápadně nebo s typickými rekurentními epizodami cholangoitidy provázenými bolestí v pravém podžebří, teplotou a ikterem. Typický průběh PSC je spojen s rozvojem jaterní cirhózy, která bývá provázena výraznou portální hypertenzí. Prevalence PSC je udávána v jedné studii ze Švédska 16,2/100 000 obyvatel (muži 23,7/100 000, ženy 8,9/100 000) se stoupajícím trendem v poslední době, v recentní studii z Nizozemska byla prevalence PSC menší, a to 6,0/100 000 obyvatel [4,5]. Z ČR nejsou známy přesné údaje, jen v IKEM je však v současnosti sledováno cca 200 nemocných před transplantací jater i po ní. Poměr výskytu PSC u mužů a žen je 2 : 1 a nejčastěji se diagnostikuje ve věku kolem 40 let. Medián přežití od stanovení diagnózy do transplantace jater, popřípadě úmrtí, je 13–21 let [5]. Pro PSC platí i geografické rozložení onemocnění, typicky se vyskytuje v severní Evropě, v Severní Americe a na Novém Zélandu, nejmenší frekvence onemocnění se pak pozoruje v Jižní Americe, v Asii a Africe. Geografický výskyt je podobný s rozložením IBD, se kterými je PSC tak těsně asociováno, až lze s jistou nadsázkou uvést, že kolonoskopické vyšetření potvrzuje diagnózu PSC.
Diagnostika PSC je poměrně jednoduchá při provedeném ERCP nebo MRCP s bioptickým potvrzením, které je však nezbytné jen v některých případech, mezi které patří tzv. „PSC malých žlučovodů“ s normálním obrazem žlučovodů, laboratorním obrazem cholestázy a typickým histologickým obrazem. Toto onemocnění zahrnuje pouze 5 % nemocných a bývá spojeno s pomalejší progresí onemocnění. Dalším důvodem provedení jaterní biopsie je podezření na tzv. overlap (překryvný) syndrom, u kterého se vyskytují rysy autoimunity (autoimunitní hepatitida) při typickém vzhledu PSC na zobrazovacích metodách. Pokud je diagnostikován overlap syndrom, pak je léčebný přístup odlišný od pacientů s PSC používáním imunosupresiv v léčebném armamentáriu. Asi u 15 % nemocných lze nalézt změny na pankreatickém vývodu podobné těm u chronické pankreatitidy, ale zřídkakdy jsou tyto změny spojeny s typickými symptomy chronické pankreatitidy. V diferenciální diagnostice PSC je třeba vyloučit sekundární sklerozující cholangoitidu, parazitární postižení a ischemické léze, ale je nutno myslet i na portální biliopatii, nodulární regenerativní hyperplazii v důsledku medikamentózní léčby azathioprinem nebo 6-thioguaninem, sarkoidózu jater a cholangiopatii u AIDS. Léčba azathioprinem, často používaná u pacientů s PSC k léčbě aktivní UC, může být zatížena vysokým rizikem toxického vlivu na játra a pankreas. V nedávno publikované italské studii bylo toto riziko až desetinásobné ve srovnání s nemocnými s IBD bez PSC (41,7 % vs 4 %) [6]. Vzhledem k obtížnému posouzení jaterní toxicity u nemocných s PSC je vždy nutno léčbu azathioprinem v této skupině nemocných pečlivě zvážit. U 10–20 % pacientů s PSC nacházíme zvýšenou hladinu sérového imunoglobulinu G4, u těchto nemocných bývá průběh jaterního onemocnění agresivnější a vede k jaterní transplantaci za kratší dobu [7].
Z konkomitantního výskytu IBD se především jedná o UC, která se vyskytuje u 25–90 % PSC pacientů. Studie využívající i mikroskopické vyšetření sliznice kolon uvádějí prevalenci UC blížící se 90 %. Mírný a klidový průběh IBD může mít často i subklinickou podobu. Na druhé straně se PSC vyskytuje jen u cca 5–7 % UC pacientů, zvláště podezřelí jsou nemocní s vyššími hodnotami ALP. Asociace PSC s Crohnovou nemocí (CD) je podstatně nižší (< 20 %) než s UC, diagnostické nepřesnosti nejsou dle našich zkušeností řídké a střevní onemocnění bývá často později překlasifikováno na UC. Idiopatický střevní zánět při PSC představuje specifický unikátní fenotyp označovaný jako PSC-IBD (PSC-UC či PSC-CD). Většinou nacházíme pankolitidu s klidným klinickým, ale i histologickým průběhem (proto vždy nutné biopsie), a pokud je přítomna aktivita, tak nejvýrazněji v pravostranném kolon, málokdy se pozoruje přítomnost zánětlivých polypů, někdy se popisuje vyšší frekvence tzv. back--wash ileitidy [8]. Pankolitida je pozorována u 94 % PSC-UC a kolitida u 96 % PSC-CD [9]. Jistou zvláštností pro UC při PSC bývá normální makroskopický vzhled rekta a i když tento specifický nález není podpořen všemi studiemi, je krátké vyšetření tlustého střeva (sigmoideoskopie) u těchto pacientů hrubou chybou. Nejenže se mohou přehlédnout výrazné zánětlivé změny v orálních částech, ale i kolorektální karcinom. Pacienti s PSC a UC jsou zatíženi 5 - až 10násobným rizikem kolorektálního karcinomu (KRK) s typickým výskytem v pravostranném kolon a v mladším věku ve srovnání s pacienty s UC bez přítomnosti jaterní choroby [5]. Mezi další rizikové faktory KRK patří i dlouhodobě probíhající onemocnění střeva s extenzivním postižením, s přetrvávající aktivitou a familiární výskyt KRK. Nedysplastická střevní sliznice nemocných s UC a PSC je charakterizována vyšší expresí tumor supresorového genu p53 ve srovnání s nemocnými bez PSC, což může svědčit o vyšší náchylnosti k neoplastickým změnám [10]. Na základě současných vědomostí by mělo být provedeno kolonoskopické vyšetření u všech pacientů v intervalu 1–2 let. U pacientů, kteří museli podstoupit transplantaci jater, byl zaznamenán signifikantně mírnější průběh UC, menší frekvence kolektomií, nižší počet relapsů choroby a kratší doba, po kterou bylo nevyhnutelné užívání kortikosteroidů [11]. Ve skupině, která transplantaci jater nepodstoupila, byl naproti tomu častěji proveden chirurgický zákrok a výskyt karcinomu tlustého střeva byl signifikantně vyšší. S jistou nadsázkou se dá uvést, že klinicky progresivní průběh primární sklerozující cholangitidy vyžadující transplantaci jater je spojen s mírnějším průběhem UC. Na druhé straně je nutno zmínit studii pocházející z Mayo kliniky, kde jedna třetina nemocných, která vyžadovala provedení kolektomie s ileoanální anastomózou, zemřela nebo vyžadovala provedení jaterní transplantace během 2,6 let sledování [12]. Samotná ileoanální anastomóza je pak u nemocných s PSC spojena s rizikem chronické pouchitidy a dysplastických změn. Podávání mesalazinu vykazuje preventivní vliv na rozvoj KRK i dysplastických změn kolon u pacientů s UC. U PSC-IBD nemocných nejsou výsledky studií jednoznačné, přesto nelze používání mesalazinu v této indikaci považovat za chybu.
Již zmíněný neoplastický potenciál PSC se týká nejen rizika kolorektálního karcinomu, ale především cholangiocelulárního karcinomu (CCK), který vede k úmrtí až u 15 % nemocných. Vznik onemocnění je náhlý, lze ho jen obtížně předvídat, průběh je agresivní, incidence a mortalita na tento typ karcinomu jsou v podstatě totožné. K podezření na rozvoj CCK vede zhoršení klinického stavu s rozvojem nových stenóz na žlučovodech spojené s nárůstem některých nádorových markerů, jako je CA 19-9 a v menší míře i CEA. Ve screeningu se využívá sonografie a MRCP spolu s MR vyšetřením břicha. K potvrzení diagnózy je pak vhodné ERCP vyšetření s rozborem tkáně dosažené brush-cytologií nebo biopsií doplněné i o FISH (fluorescenční in situ hybridizace) vyšetření. PSC je rovněž spojena s vyšším rizikem tumoru žlučníku (10–30krát vyšší ve srovnání s běžnou populací) a hepatocelulárního karcinomu [13].
Žádná léčba, která se v současnosti používá u nemocných s PSC, neprokázala dostatečnou efektivitu a transplantace jater (TXJ) zůstává jediným kurativním přístupem [14]. Podávání kyseliny ursodeoxycholové (UDCK) je spojeno spíše se zlepšením laboratorních hodnot než histologického obrazu. Na druhé straně je nutno uvést, že normalizace ALP, jehož zvýšení často na počátku vede k diagnostice PSC, je spojeno s lepší prognózou nemocných [15]. V nedávno publikované retrospektivní studii však došlo k normalizaci ALP nezávisle na léčbě UDCK. Naopak podávání vysokých dávek UDCK (25–30 mg/kg) je spojeno s vysokým rizikem závažných nežádoucích příhod, jako jsou vyšší výskyt jícnových a žaludečních varixů, úmrtí a nutnost provedení transplantace [16]. I když se tyto závažné nežádoucí účinky podle některých studií objevují pouze u nemocných v časnější fázi onemocnění a s normální hladinou bilirubinu [17], je v současnosti léčba vysokými dávkami UDCK kontraindikována. Kombinace dilatace dominantních žlučových stenóz a podávání UDCK má dubiózní efekt na dlouhodobou prognózu. Krátkodobé zlepšení prognózy při náhlém prohloubení obstrukčního ikteru nebo při recidivujících cholangitidách je však zřejmé. Rozporuplný je vliv UDCA na kolorektální karcinogenezi. Pardi et al v roce 2003 publikovali studii o pozitivním chemopreventivním působení UDCK, tento vliv však nebyl potvrzen v dalších studiích ani s použitím vyšších dávek UDCK [18,19], ale podle recentní metaanalýzy z Mayo kliniky lze UDCK v malých dávkách považovat za účinné chemopreventivní agens se signifikantním protektivním vlivem na rozvoj pokročilé kolorektální neoplazie (KRK nebo high-grade dysplazie) [20]. Řešení kostní nemoci při dlouhodobé cholestáze a symptomatická léčba pruritu jsou v klinické praxi samozřejmostí.
Výsledky
Základní údaje
V letech 1995–2013 podstoupilo transplantaci jater (TXJ) v IKEM Praha celkem 102 nemocných s diagnózou PSC (10,2 % ze všech transplantací). V této skupině převažovali muži v 74,5 % (76) a ženy představovaly 25,5 % (26) (tab. 1). Medián věku nemocných při TXJ byl 37 let (14–68). Idiopatický střevní zánět byl před transplantací prokázán u 64 nemocných (62,8 %), u 47 mužů a 17 žen. Většinou se jednalo o UC (61 případů), u tří nemocných byla prokázána CD. U 52 nemocných s UC (85,3 %) probíhala pankolitida, a to s mírným stupněm zánětu, nebo se jednalo o onemocnění v remisi, u devíti nemocných (14,8 %) byl střevní zánět hodnocen jako aktivní s maximálním vyjádřením aktivity v pravostranném kolon. V předtransplantačním období podstoupili dva pacienti resekční výkon na střevě. V prvním případě se jednalo o totální kolektomii pět let před transplantací pro adenokarcinom tlustého střeva. Druhý pacient podstoupil pravostrannou hemikolektomii s resekcí terminálního ilea pro krvácení po polypektomii zánětlivých polypů dva roky před TXJ. Celkem u 13 pacientů (12,7 %) byl zjištěn overlap syndrom PSC a autoimunitní hepatitidy (AIH), v jednom případě se pak PSC sdružovala s deficitem α-1-antitrypsinu. U 79 transplantačních chirurgických výkonů (77,5 %) byla zvolena hepatikojejunoanastomóza a ve 23 případech (22,5%) byla založena choledochocholedochoanastomóza. V trvalém ambulantním sledování zůstává v IKEM 83 pacientů; deset z nich zemřelo a devět pacientů je sledováno ve Slovenské republice – o těch nemáme úplné informace.
Tab. 1. Demografická data. Tab. 1. Demographic data. 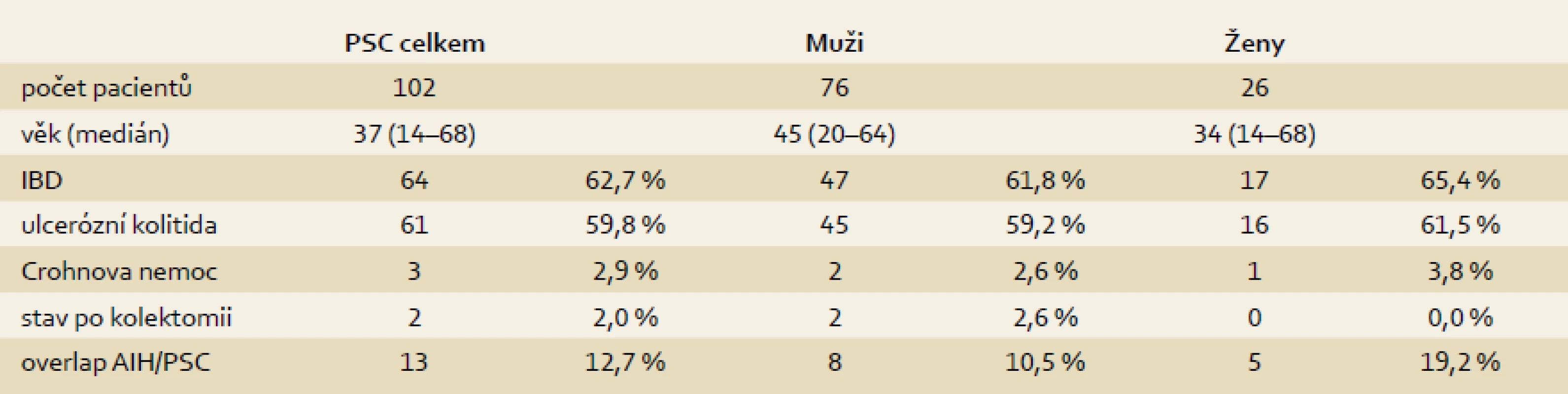
Přežívání pacientů
Ze 102 pacientů jich přežívá 92. Roční, pětileté, desetileté a patnáctileté přežití je v našem souboru 94,1 %, 93,0 %, 93,0 %, resp. 82,3 % (graf 1). Nejčastější příčinou úmrtí byla generalizace cholangiocelulárního karcinomu (3) s průměrnou dobou přežití 12,7 (± 6,3) měsíců od transplantace. Jeden pacient s metastatickým rozsevem karcinomu žlučníku zemřel na nádorovou kachexii 18 měsíců po TXJ. Mezi příčiny úmrtí dalších nemocných patří adenokarcinom tlustého střeva (1), karcinom ovarií (1), plicní embolie (1), ischemická CMP (1), posthemoragická nekróza štěpu (1) a selhání štěpu při protrahovaných rejekcích (1).
Graf 1. Kumulativní přežívání (dle Kaplan-Meiera) pacientů po TXJ. Graph 1. Cumulative survival (Kaplan-Meier) of patients after OLTx. 
Akutní celulární rejekce a rekurence PSC
Alespoň jedna epizoda akutní celulární rejekce (ACR) byla prokázána u 28 (33,7 %) sledovaných pacientů s dobrou reakcí na navýšení imunosupresivní léčby nebo pulz kortikoidů, v jednom případě však vedla protrahovaná ACR k úmrtí. Rekurence základního onemocnění ve štěpu, alespoň stupně 1 dle Mayo kritérií, byla biopticky verifikována u 28 (33,7 %) pacientů, u tří vedla k nutnosti retransplantace 5–10 let po TXJ (tab. 2). V době retransplantace měli dva nemocní mírnou aktivitu kolitidy (jeden omezenou pouze na rektum, druhý s pankolitidou) a u jednoho z nich nebyl nikdy prokázán střevní zánět. Ve skupině nemocných s overlap syndromem byla nalezena rekurence PSC u 3/13 (23,1 %) nemocných a rekurence AIH u 2/13 (15,4 %). Další dva pacienti podstoupili retransplantaci pro selhání jaterního štěpu při trombóze a. hepatica, resp. levé jaterní žíly.
Tab. 2. ACR a rekurence PSC. Tab. 2. Acute cellular rejection PSC recurrence. 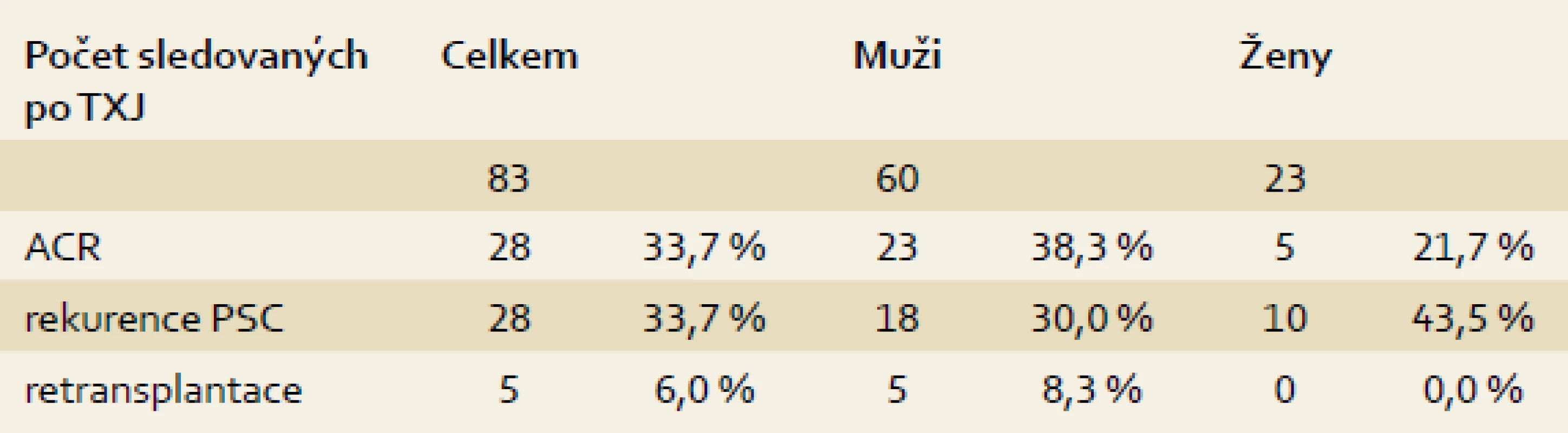
Incidentalomy
Nález zhoubného novotvaru v jaterním explantátu byl v našem souboru popsán u sedmi pacientů, v jednom případě se jednalo o karcinom žlučníku, u šesti zbylých pak o cholangiocelulární karcinom (CCK) u pěti mužů a jedné ženy. Tři z těchto pacientů přežívají 1–6,5 let po TXJ bez známek recidivy, u jednoho z nich pak byla v potransplantačním období provedena proktokolektomie s ileostomií pro nález high-grade dysplazie sliznice kolon (graf 2).
Graf 2. Incidentalomy – hepatobiliární neoplazie. Graph 2. Incidentalomas – hepatobiliary neoplasia. 
Průběh idiopatického střevního zánětu
Z celkového souboru pacientů podstoupilo na našem pracovišti kolonoskopické vyšetření před transplantací i po ní (více než 12 měsíců od TXJ) 69 nemocných (ostatní jsou anebo byli endoskopicky sledováni na jiném pracovišti, zemřeli anebo jsou po TXJ recentně). Z těchto nemocných se 61 (88,4 %) léčilo s IBD, a to 58 (84,1 %) pro ulcerózní kolitidu, u tří pacientů (4,4 %) pak bylo střevní zánětlivé onemocnění klasifikováno jako CD. Makroskopický obraz kolitidy byl zhodnocen dle endoskopického Mayo skóre (dle největší zaznamenané tíže) jako těžký u osmi pacientů (13,1 %), u 19 jako středně těžký (31,2 %), jako mírný u 15 (24,6 %), v 19 případech bylo popsáno stadium remise (31,2 %) (tab. 3). Low-grade dysplazie (LGD) byla nalezena u 4/61 (6,6 %) pacientů a high-grade dysplazie (HGD) byla detekovaná u 2/61 (3,3 %) nemocných (graf 3). De novo IBD se vyskytlo u 13/61 pacientů (21,3 %), vždy se jednalo o mírné projevy ulcerózní kolitidy (tab. 3).
Tab. 3. Průběh IBD po TXJ. Tab. 3. The course of IBD after OLTx. 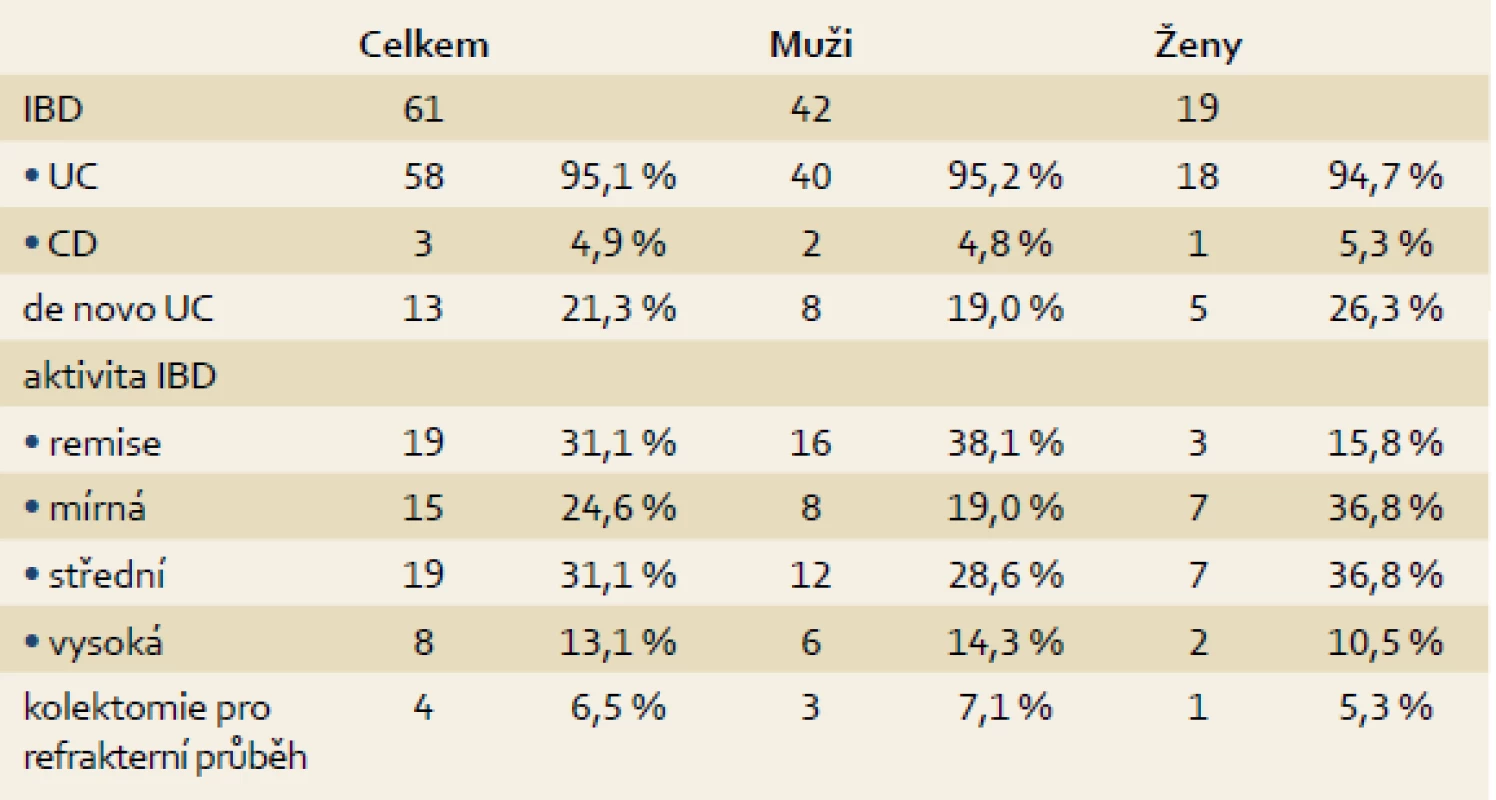
Kolorektální karcinom
Adenokarcinom tlustého střeva se po transplantaci vyskytl u tří mužů. Jeden z nich prodělal proktokolektomii s následnou zajišťovací chemoterapií 11 let po TXJ pro nízce diferencovaný adenokarcinom kolon descendens, podobně jako 67letý nemocný, který podstoupil stejný výkon pro adenokarcinom lienální flexury v roce 2011 s odstupem čtyř let po transplantaci. Jeden z našich pacientů, trvale sledovaný na Slovensku, však 11 let po TXJ na adenokarcinom tlustého střeva zemřel (graf 3).
Graf 3. Kolorektální neoplazie u pacientů po TXJ pro PSC. Graph 3. Colorectal neoplasia in patients after OLTx for PSC. 
Resekce kolon
Resekční výkon různého rozsahu na tlustém střevě po TXJ podstoupilo ještě dalších pět pacientů. Ve třech případech (dva muži a jedna žena) byla provedena totální kolektomie pro vysoce aktivní ulcerózní kolitidu, v jednom případě ileocekální resekce pro tubulovilózní adenom s high-grade dysplazií v terénu středně těžké kolitidy a jeden nemocný podstoupil subtotální kolektomii pro toxické megakolon s následnou proktektomií s dvouletým odstupem pro signifikantní postižení Crohnovou chorobou.
Diskuze
PSC představuje třetí nejčastější indikaci k transplantaci jater v IKEM, jedná se o 10,2 % všech transplantací a tento údaj je plně srovnatelný s daty získanými z ELTR (European Liver Transplant Registry) [21]. Důvodem k provedení transplantace je nejen terminální fáze jaterního onemocnění, ale i rekurentní cholangoitida a klinické stavy svázané s cholestázou (zejména pruritus a kostní choroba). Navíc související vysoký neoplastický potenciál zařazuje PSC mezi velmi problematická onemocnění z hlediska správného načasování k transplantaci. Sledování pacientů s PSC v centru s možností jaterní transplantace je pak logickým přístupem v léčbě těchto nemocných.
Přežití štěpu jater i samotného příjemce se v posledních dvou desetiletích významně zlepšilo a dosahuje cca 80 % po pěti letech sledování [22]. V našem centru je přežití v 1, 5, 10 i 15 letech vyšší ve srovnání s ELTR. Nepochybně jsou výborné výsledky transplantační léčby v této skupině ovlivněny i faktem, že se jedná o mladší nemocné bez zásadních komorbidit (ve srovnání s nemocnými s etylickou jaterní cirhózou (ETOH) a HCV).
Na druhé straně je v posledních letech zřejmé, že PSC může v jaterním štěpu rekurovat (rPSC) až u pětiny nemocných, což může být spojeno se ztrátou jaterního štěpu a negativním vlivem na přežití nemocného [23]. Rekurence PSC představuje závažný medicínský problém s narůstající kohortou nemocných při málo známé epidemiologii, patogenezi i léčbě [3]. Riziko rekurence PSC je sníženo u nemocných s provedenou kolektomií před TX, což jen přispívá k představě o vzájemném imunologickém propojení mezi střevem a játry u PSC-IBD nemocných, a proto by kolektomie měla být vždy zvážena i u nemocných, u kterých je plánována retransplantace v důsledku rPSC [24]. U našich nemocných jsme však neprokázali aktivní střevní onemocnění u těch s rPSC vyžadujících retransplantaci. Diagnostika rPSC je založena na radiologickém, biochemickém a histologickém vyšetření. Správná diagnóza rPSC je stále považována za problematickou vzhledem k obtížnosti odlišit rPSC od ostatních stavů vedoucích k podobnému nálezu na žlučovodech, jako jsou duktopenické rejekce, anastomotické striktury, stavy spojené s ischemií v povodí hepatické arterie a AB0 inkompatibilita. Diagnostickou svízel představuje častá přítomnost ascendentní cholangoitidy u nemocných s provedenou hepatikojejunoanastomózou. Vyšší výskyt rPSC (33,7 %) v našem souboru může být způsoben i faktem, že jako hlavní kritérium rekurence jsme v naší retrospektivní analýze zvolili výsledek histologického vyšetření.
Paradoxně i přes imunosupresivní léčbu, která by hypoteticky měla vést k utlumení či kontrole aktivity střevního zánětu, může být klinický průběh UC po transplantaci jater velmi agresivní. Ve srovnání s předtransplantačním obdobím se to týká až 30–40 % nemocných [25,26], a to i přesto, že u PSC pacientů podstupujících TXJ bývá aktivita UC před TX nižší ve srovnání s PSC nemocnými bez nutnosti transplantace. Mezi spouštěče aktivity střevního onemocnění po TXJ lze nalézt CMV infekci, kouření, nerovnováhu subtypů T-lymfocytů v důsledku imunosupresivní léčby, rychlé vysazení kortikoidů a změny ve střevní mikrobiotě [26]. Imunosupresivní léčba po TXJ je v posledních 10 letech založena na podávání takrolimu, který však v porovnání s cyklosporinem A může vést ke zhoršení průběhu IBD [27]. Podávání azathioprinu prokazuje protektivní efekt na vzplanutí aktivity IBD po TX, jeho dávka (1–2 mg/kg) používaná u transplantovaných nemocných je však nižší ve srovnání s dávkou běžně používanou u IBD nemocných (2–2,5 mg/kg) [27]. Časné vysazení kortikoidů bývá u některých nemocných spojeno s relapsem zánětu, a proto podáváme malé dávky kortikoidů dlouhodobě, popřípadě je trvale v medikaci ponecháváme. V našem souboru při retrospektivní analýze nemůžeme vliv jednotlivých imunosupresivních režimů na aktivitu IBD dostatečně zodpovědně posoudit. Někdy může být za vzplanutím kolitidy nechtěné přerušení léčby mesalazinem po TX jater. V potransplantačním období se medikace zpravidla zcela změní a na mesalazin se často zapomíná. V některých případech se k léčbě aktivní UC používá i biologická léčba anti-TNFα. Literární informace jsou jen sporadické a vždy na malém počtu nemocných. Použití infliximabu a adalimumabu může být užitečné, ale na druhé straně je tuto volbu nutno pečlivě zvážit vzhledem k vyššímu riziku infekčních příhod a potransplantační lymfoproliferace [28]. V našem souboru jsme zatím k léčbě infliximabem nepřistoupili, většina nemocných byla úspěšně léčena intenzifikací standardní medikamentózní léčby. Pokud však byla aktivita UC u našich nemocných po TXJ spojena s refrakterním průběhem (a většinou i s velkým výskytem zánětlivých polypů), přistoupili jsme ke kolektomii ve čtyřech případech, z toho u jednoho nemocného se jednalo o toxické megakolon při CD. V literatuře se frekvence kolektomií po TX pro refrakterní průběh nebo závažné vzplanutí IBD pohybuje kolem 10 % [29]. Samotná ileoanální anastomóza může být po TXJ provedena bezpečně a v našem souboru jsme nepozorovali žádné významné komplikace. Vzácností není ani de novo IBD, která se vyskytuje u 14–30 % nemocných [29]. Vyšší incidence de novo IBD je popisována u všech pacientů po transplantaci solidních orgánů. Patofyziologický podklad tohoto paradoxního fenoménu není znám, podíl CMV infekce ani změny ve střevní mikrobiotě nelze vyloučit. U pacientů s PSC se však v některých případech nepochybně jedná i o dříve nepoznanou UC. V našem souboru se jednalo o de novo UC u 13 pacientů (21,3 %). Většinou UC probíhá i po transplantaci klidně, s minimální aktivitou, bez klinických příznaků, jak potvrzujeme v našem souboru.
Údaje o vyšším riziku kolonických neoplastických změn po transplantaci jater jsou v literatuře rozporuplné, v každém případě však platí výše uvedená rizika. Otázkou je, zda TXJ představuje další nezávislé riziko pro vznik KRK. V našem souboru jsme našli čtyřikrát low-grade dysplazii a dvakrát high-grade dysplazii. Kolorektální karcinom se objevil u tří nemocných a v jednom případě byl dokonce i příčinou úmrtí. Alarmující výskyt kolorektálních neoplazií plně ospravedlňuje pravidelná kolonoskopická vyšetření v 1 - až 2ročním intervalu.
U nemocných s PSC po TX jater se objevuje zvýšené riziko akutních celulárních rejekcí (ACR) a pravděpodobně až 50 % nemocných prodělá epizodu ACR během prvních týdnů po TXJ [3]. Navíc může imunologická reakce při ACR zvýšit riziko vzniku rPSC ve štěpu přítomností většího podílu reaktivních lymfocytů. Mechanizmy spojující ACR a riziko rPSC však nejsou v současnosti známy. Výskyt ACR byl v našem souboru nižší (33,7 %), než jsou literární údaje, jednou z možností vysvětlení je i fakt, že všichni pacienti jsou v IKEM po transplantaci léčeni i podáváním UDCK, u které byl prokázán příznivý efekt na výskyt ACR [30].
Trombóza a. hepatica patří mezi zásadní časné komplikace transplantační léčby, její frekvence je zvýšena u PSC--IBD nemocných, zvláště těch s aktivním průběhem střevního zánětu [31]. V našem souboru však nepřesahoval výskyt trombózy a. hepatica průměr celého souboru transplantovaných nemocných.
U 13 pacientů (12,7 %) byla TXJ provedena pro overlap syndrom, který bývá spojen s vyšším rizikem rekurence primární choroby, ale bez vlivu na přežití [32], v IKEM jsme vyšší riziko rekurence PSC ani AIH neprokázali.
Výsledky transplantace jater u nemocných s CCK, a to i incidentálním, jsou mimořádně špatné a většina pacientů umírá časně na recidivu karcinomu. Proto je tato indikace spojena pouze s klinickými studiemi a v běžném transplantačním programu představuje CCK dosud kontraindikaci. V klinické praxi se však nevyhneme incidentalomům i přes pečlivý screening CCK v předtransplantačním období. V našem souboru se jednalo o šest pacientů. Z toho tři zemřeli časně po transplantaci a tři žijí bez známek recidivy maligního onemocnění 1–6,5 let po TXJ.
Závěr
Transplantace jater představuje jediné kurativní řešení terminální fáze PSC. Výsledky transplantační léčby jsou v této skupině nemocných mimořádně příznivé. Problémem je možnost rekurence základního onemocnění provázené u některých nemocných i ztrátou jaterního štěpu. Další výzvou je řešení specifického idiopatického střevního zánětu, který je se základním onemocněním těsně asociován a může po transplantaci probíhat agresivně a vznikat i de novo. Nezbytná jsou pravidelná kolonoskopická vyšetření pro nepochybné riziko vzniku kolorektálních neoplazií. Nález incidentálního cholangiocelulárního karcinomu v jaterním explantátu negativně ovlivňuje přežití nemocných.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
Doručeno: 21. 8. 2013
Přijato: 16. 9. 2013
doc. MUDr. Pavel Drastich, Ph.D.
Klinika hepatogastroenterologie, IKEM
Vídeňská 1958/9, 140 01 Praha 4
padr@ikem.cz
Zdroje
1. Bergquist A, Montgomery SM, Bahmanyar S et al. Increased risk of primary sclerosing cholangitis and ulcerative colitis in firts-degree relatives of patients with primary sclerosing cholangitis. Clin Gastroenterol Hepatol 2008; 6(8): 939–943.
2. Lee YM, Kaplan MM. Primary sclerosing cholangitis. N Engl J Med 1995; 332(14): 924–933.
3. Fosby B, Karlsen TH, Melum E. Recurrence and rejection in liver transplantation for primary sclerosing cholangitis. World J Gastroenterol 2012; 18(1): 1–15.
4. Lindkvist B, Benito de Valle M, Gullberg B et al. Incidence and prevalence of primary sclerosing cholangitis in a defined adult population in Sweden. Hepatology 2010; 52(2): 571–577.
5. Boonstra K, Weersma RK, van Erpecum KJ et al. Population-based epidemiology, malignancy risk and outcome of primary sclerosing cholangitis. Hepatology 2013. [In press].
6. Pallavicino F, Pellicano R, Reggiani S et al. Inflammatory bowel diseases and primary sclerosing cholangitis: hepatic and pancreatic side effects due to azathioprine. Eur Rev Med Pharmacol Sci 2013; 17(1): 84–87.
7. Mendes FD, Jorgensen R, Keach J et al. Elevated serum IgG4 concentration in patients with primary sclerosing cholangitis. Am J Gastroenterol 2006; 101(9): 2070–2075.
8. Drastich P, Kamenar D, Spicak J. Ulcerative colitis in patients with primary sclerosing cholangitis (PSC-UC) – a specific subgroup of inflammatory bowel disease. Gastroenterology 2006; 130 (Suppl 2): A214.
9. Boonstra K, van Erpecum KJ, van Nieuwkerk KM et al. Primary sclerosing cholangitis is associated with distinct phenotype of inflammatory bowel disease. Inflamm Bowel Dis 2012; 18(12): 2270–2276.
10. Wohl P, Hucl T, Drastich P. Epithelial markers of colorectal carcinogenesis in ulcerative colitis and primary sclerosing cholangitis. World J Gastroenterol 2013; 19(14): 2234–2241.
11. Navaneethan U, Venkatesh PG, Mukewar S et al. Progressive primary sclerosing cholangitis requiring liver transplantation is associated with reduced need for colectomy in patients with ulcerative colitis. Clin Gastroenterol Hepatol 2012; 10(5): 540–546.
12. Treeprasertsuk S, Björnsson E, Sinakos E et al. Outcome of patients with primary sclerosing cholangitis and ulcerative colitis undergoing colectomy. World J Gastrointest Pharmacol Ther 2013; 4(3): 61–68.
13. Razumilava N, Gores GJ, Lindor KD. Cancer surveillance in patients with primary sclerosing cholangitis. Hepatology 2011; 54(5): 1842–1852.
14. Karlsen TH, Schrumpf E, Boberg KM. Update on primary sclerosing cholangitis. Dig Liver Dis 2010; 42(6): 390–400.
15. Stanich PP, Björnsson E, Gossard AA et al. Alkaline phosphatase normalization is associated with better prognosis in primary sclerosing cholangitis. Dig Liver Dis 2011; 43(4): 309–313.
16. Lindor KD, Kowdley KV, Luketic VA et al. High-dose ursodeoxycholic acid for the treatment of primary sclerosing cholangitis. Hepatology 2009; 50(3): 808–814.
17. Imam MH, Sinakos E, Gossard AA et al. High-dose ursodeoxycholic acid increases risk of adverse outcomes in patients with early stage primary sclerosing cholangitis. Aliment Pharmacol Ther 2011; 34(10): 1185–1192.
18. Pardi DS, Loftus EV Jr, Kremers WK et al. Ursodeoxycholic acid as a chemopreventive agent in patients with ulcerative colitis and primary sclerosing cholangitis. Gastroenterology 2003; 124(4): 889–893.
19. Lindström L, Boberg KM, Wikman O et al. High dose ursodeoxycholic acid in primary sclerosing cholangitis does not prevent colorectal neoplasia. Aliment Pharmacol Ther 2012; 35(4): 451–457.
20. Singh S, Khanna S, Pardi DS et al. Effect of ursodeoxycholic acid use on the risk of colorectal neoplasia in patients with primary sclerosing cholangitis and inflammatory bowel disease: a systemic review and meta-analysis. Inflamm Bowel Dis 2013; 19(8): 1631–1638.
21. Patkowski W, Skalski M, Zieniewicz K et al. Orthotopic liver transplantation for cholestatic diseases. Hepatogastroenterology 2010; 57(99–100): 605–610.
22. Adam R, Hoti E. Liver transplantation: the current situation. Semin Liver Dis 2009; 29(1): 3–18.
23. Alabraba E, Nightingale P, Gunson B et al. A re-evaluation of the risk factors for the recurrence of primary sclerosing cholangitis in liver allografts. Liver Transpl 2009; 15(3): 330–340.
24. Marelli L, Xirouchakis E, Kalambokis G et al. Does the severity of primary sclerosing cholangitis influence the clinical course of associated ulcerative colitis? Gut 2011; 60(9): 1224–1228.
25. Drastich P, Bajer L, Wohl P et al. Ulcerative colitis after orthotopic liver transplantation for primary sclerosing cholangitis - a single center experience. Gastroenterology 2013; 144 (Suppl 1): S628.
26. Papatheodoridis GV, Hamilton M, Mistry PK et al. Ulcerative colitis has an aggressive course after orthotopic liver transplantation for primary sclerosing cholangitis. Gut 1998; 43(5): 639–644.
27. Haagsma EB, Van den Berg AP, Kleibeuker JH et al. Inflammatory bowel disease after liver transplantation: the effect of different immunosuppressive regimens. Aliment Pharmacol Ther 2003; 18(1): 33–44.
28. Mohabbat AB, Sandborn WJ, Loftus EV Jr et al. Anti-tumour necrosis factor treatment of inflammatory bowel disease in liver transplant recipients. Aliment Pharmacol Ther 2012; 36(6): 569–574.
29. Singh S, Loftus EV Jr, Talwalkar JA. Inflammatory bowel disease after liver transplantation for primary sclerosing cholangitis. Am J Gastroentrol 2013; 108(9): 1417–1425.
30. Clavien PA, Sharara AI, Camargo CA Jr et al. Evidence that ursodeoxycholic acid prevents steroid-resistant rejection in adult liver transplantation. Clin Transplant 1996; 10(6 Pt 2): 658–662.
31. Joshi D, Bjarnason I, Belgaumkar A et al. The impact of inflammatory bowel disease post-liver transplantation for primary sclerosing cholangitis. Liver Int 2011; 33(1): 53–61.
32. Bhanji RA, Mason AL, Girgis S et al. Liver transplantation for overlap syndromes of autoimmune liver diseases. Liver Int 2013; 33(2): 210–219.
Štítky
Detská gastroenterológia Gastroenterológia a hepatológia Chirurgia všeobecná
Článok vyšiel v časopiseGastroenterologie a hepatologie
Najčítanejšie tento týždeň
2013 Číslo 5- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Kombinace metamizol/paracetamol v léčbě pooperační bolesti u zákroků v rámci jednodenní chirurgie
- Antidepresivní efekt kombinovaného analgetika tramadolu s paracetamolem
- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
- Srovnání analgetické účinnosti metamizolu s ibuprofenem po extrakci třetí stoličky
-
Všetky články tohto čísla
- Gastrointestinální onkologie
- Kvíz – postižení jater s normálními jaterními testy
- Metodika adresného zvaní občanů do českého programu screeningu nádorů tlustého střeva a konečníku
- Vliv klinických a molekulárních faktorů na odhad rekurence kolorektálních adenomů u dlouhodobě sledovaných pacientů
- Postavenie neoadjuvantnej terapie v multimodálnej liečbe karcinómu rekta – klinické výsledky
- Hereditárny difúzny karcinóm žalúdka
- Cílená léčba karcinomu pankreatu – minulost či budoucnost?
- Lymfomy tenkého střeva
- Stav onkochirurgické péče a vzdělávání v onkochirurgii v České republice
- Multidisciplinární přístup v diagnostice a léčbě karcinomu žaludku
- 1 000 transplantací jater v IKEM
- Prvních 1 000 transplantací jater v IKEM
- Transplantace jater pro chronickou hepatitidu C, význam protivirové léčby
- Transplantace jater pro primární sklerozující cholangitidu
- Méně časté indikace k ortotopické transplantaci jater
- Vývoj postupů v léčbě akutního selhání jater
- Endosonograficky navigovaná tenkoihlová aspiračná biopsia zo solídnych pankreatických más – presnosť a impakt na liečbu u 358 pacientov
- Správná odpověď na kvíz
- Příprava tlustého střeva u pacientů s idiopatickými střevními záněty před endoskopickými nebo kolografickými (CT/MR) vyšetřeními – stanovisko IBD pracovní skupiny
-
XXII. jarní setkání Loket 2013 – Neoplazie žaludku
3. postgraduální kurz společnosti pro gastrointestinální onkologii - Životní jubileum prof. Miroslava Zavorala
- Picoprep – očistný prostředek s dvojím účinkem
- Autodidaktický test: gastrointestinální onkologie
- Gastroenterologie a hepatologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Picoprep – očistný prostředek s dvojím účinkem
- Lymfomy tenkého střeva
- Transplantace jater pro primární sklerozující cholangitidu
- Hereditárny difúzny karcinóm žalúdka
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



