-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Transplantace jater pro chronickou hepatitidu C, význam protivirové léčby
Liver transplantation for chronic C hepatitis, significance for antivirus treatments
Chronic hepatitis C nowadays represents the most common indication for liver transplantation (LTx) worldwide. The survival rate of HCV patients after LTx is worse than that of patients transplanted for cirrhosis of other aetiology owing to HCV graft reinfection leading to the development of recurrent hepatitis C in the liver graft. We retrospectively reviewed 149 patients, 50 females and 99 males, who underwent LTx in the period from 1995 to 2013 of a total of 957 liver graft recipients who underwent LTx within the same period (HCV represents 15.6% of all LTx indications). The average age of the patients was 53 (ranging from 15 to 69). One hundred and forty-eight patients were infected with genotype 1b, only one patient had genotype 3a. Forty-eight patients had a small hepatocellular carcinoma. Eighty-two patients of 149 were given antiviral treatment. The survival of HCV patients was worse compared to the group of patients with non-HCV cirrhosis as well as of all other patients; three years 79.3%, five years 72.5% and 10 years 62.9% (non-HCV cirrhosis 89.4%, 87.2% and 79.7%; p < 0.001, all other patients 88.2%, 85.8% and 78.8 %; p < 0.001). Thirty-two of 82 patients achieved a sustained virological response (SVR) after administration of a combined antiviral therapy (39%). The survival of patients who achieved an SVR (100%, 92.0% and 92.0%) was significantly better than the survival of patients without SVR (85.7%, 76.9% and 63.3%; p = 0.0026), the worst was the survival of patients who were not treated due to a contraindication to therapy (63.1%, 58.3% and 47.0%, p < 0.001). Eradication of the HCV infection and SVR significantly increased the survival of patients transplanted for HCV infection but the number of patients, who are not eligible for peginterferon α-based therapy, still remains high.
Key words:
chronic hepatitis C – recurrence – liver transplantation – antiviral treatment – survival
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE „uniform requirements“ for biomedical papers.Submitted:
2. 9. 2013Accepted:
27. 9. 2013
Autoři: J. Šperl 1
; S. Fraňková 1
; P. Trunečka 2
Vyšlo v časopise: Gastroent Hepatol 2013; 67(5): 407-412
Kategorie: Hepatologie: původní práce
Souhrn
Chronická infekce virem hepatitidy C (HCV) je ve světě nejčastější indikací k transplantaci jater (LTx). Přežití pacientů po LTx pro HCV cirhózu je horší než u cirhóz jiné etiologie. Příčinou je reinfekce štěpu HCV, která u většiny pacientů vede k rozvoji tzv. rekurentní hepatitidy C. Retrospektivně jsme hodnotili 149 pacientů, 50 žen a 99 mužů, transplantovaných pro HCV v letech 1995–2013 z celkového počtu 957 příjemců transplantovaných ve stejném období (HCV 15,6 % indikací). Průměrný věk byl 53 let (15–69). Sto čtyřicet osm pacientů mělo genotyp 1b, jeden měl genotyp 3a. Hepatocelulární karcinom v cirhóze mělo 48 pacientů. Protivirovou léčbu dostalo 82 pacientů ze 149. Přežití HCV pacientů bylo horší než pacientů s cirhózou jiné etiologie i než ostatních pacientů; tři roky 79,3 %, pět let 72,5 % a deset let 62,9 % (ostatní cirhotici 89,4 %, 87,2 % a 79,7 %; p < 0,001, všichni ostatní pacienti 88,2 %, 85,8 % a 78,8 %; p < 0,001). Protivirovou léčbou dosáhlo setrvalé virologické odpovědi (SVR) 32/82 pacientů (39 %). Přežití pacientů, kteří dosáhli SVR (100 %, 92,0 % a 92,0 %) bylo významně lepší než přežití pacientů bez SVR (85,7 %, 76,9 % a 63,3 %; p = 0,0026). Ještě horší bylo přežití pacientů neléčených, kteří léčbu nemohli absolvovat (63,1 %, 58,3 % a 47,0 %; p < 0,001). Dosažení SVR signifikantně zlepšilo přežití pacientů transplantovaných pro HCV. Podíl pacientů po LTx, kteří léčbu založenou na peginterferonu α nemohou absolvovat pro vysoké riziko komplikací, je stále vysoký.
Klíčová slova:
chronická hepatitida C – rekurence – transplantace jater – protivirová léčba – přežitíInfekce virem hepatitidy C (HCV) je ve světě nejčastější příčinou nevratného selhání jater a indikací k transplantaci jater (LTx) [1]. U všech pacientů, kteří přicházejí k transplantaci s pozitivní viremií (HCV RNA), dochází k reinfekci štěpu jater. Protilátka neutralizující virus hepatitidy C schopná zabránit reinfekci není dosud k dispozici. Reinfekce štěpu virem hepatitidy C vede k rekurenci hepatitidy C ve štěpu, rekurentní hepatitida C je díky současnému podávání imunosupresiv akcelerovaná ve srovnání s průběhem chronické hepatitidy C ve vlastních játrech. Cirhózou štěpu trpí 20–30 % pacientů s rekurentní hepatitidou C již pět let po transplantaci [2]. Prognóza pacientů s cirhózou štěpu je velmi nepříznivá, k dekompenzaci cirhózy dochází do roka u 40 % pacientů. Jediným řešením dekompenzované cirhózy jaterního štěpu na podkladě rekurentní hepatitidy C je retransplantace. Přežití pacientů po transplantaci jater pro jaterní cirhózu C je kvůli závažnému průběhu rekurence HCV horší než u pacientů indikovaných k transplantaci pro cirhózy jiné etiologie a pohybuje v rozmezí 61–75 % za pět, resp. deset let po transplantaci [3–5]. Progresi fibrózy a vývoj cirhózy jaterního štěpu lze zvrátit jen úspěšnou protivirovou léčbou s dosažením setrvalé virologické odpovědi (SVR). Dosažení SVR znamená eliminaci viru z organizmu, trvale negativní viremii, ústup zánětlivých změn a zastavení progrese fibrózy štěpu; dosažení SVR je spojeno se zlepšením přežití pacientů po transplantaci [6,7]. Nepříznivým projevem reinfekce štěpu virem hepatitidy C je rozvoj tzv. fibrotizující cholestatické hepatitidy, která je charakterizovaná vysokou viremií, progresivní fibrózou, duktulární proliferací a cholestázou s nevýrazným zánětlivým infiltrátem. Bez úspěšné protivirové léčby spěje rychle k selhání štěpu [8]. V průběhu let byla identifikována řada faktorů spojených s nepříznivým průběhem rekurence HCV po transplantaci jater. Největší vliv má vysoká viremie v době transplantace [9] a genotyp HCV, nepříznivý průběh je spojen s genotypy HCV 1b a 4, zejména kvůli horší odpovědi na protivirovou léčbu [10,11]. Dalšími negativními prognostickými faktory jsou ženské pohlaví, vyšší věk dárce, steatóza štěpu, non-CC IL28B genotyp příjemce i dárce. Negativní vliv na průběh rekurence HCV má i současná aktivní infekce cytomegalovirem nebo herpes virem 6 [12–14]. Rozsáhle diskutována byla otázka vlivu imunosupresiv na průběh a léčbu rekurence HCV. Příznivý vliv cyklosporinu A ve srovnání s takrolimem nebyl jednoznačně prokázán, stejně tak nebyl prokázán příznivý vliv úplného vysazení kortikoidů.
Ideálním způsobem, jak zabránit rozvoji rekurentní hepatitidy C po transplantaci, by bylo zbavit pacienta HCV infekce ještě před transplantací. Protivirová léčba založená na pegylovaném interferonu α u kandidátů transplantace jater, tj. u dekompenzovaných cirhotiků, je málo účinná a je spojená s řadou závažných komplikací. Ani tzv. preemptivní léčba časně po transplantaci se nestala obecně doporučovaným postupem. Preemptivní léčba má zabránit rozvoji rekurentní hepatitidy, SVR při ní dosáhne jen 5–33 % pacientů s genotypem 1 [15,16]. Preemptivní léčba je spojena s vysokým výskytem nežádoucích účinků, k předčasnému ukončení dochází u jedné třetiny léčených pacientů, časté jsou bakteriální infekce i akutní rejekce (až 26 %). V současné době je obecně uznávanou strategií v léčbě HCV infekce po transplantaci zahájení léčby až při histologicky prokázané rekurentní hepatitidě. První úvaha o zahájení protivirové léčby tak obvykle nastává při hodnocení protokolární biopsie štěpu šest, resp. 12 měsíců po transplantaci. Při rozhodování o zahájení léčby je nutno brát v úvahu i věk pacienta, jeho celkový stav a stupeň fibrózy. Tolerance a účinnost jsou významně horší u pacientů s fibrózou F3 a horší. Volba doby k zahájení léčby je tak přísně individuální, s odstupem od transplantace na jednu stranu progreduje fibróza, na druhou stranu se zlepšuje celkový stav pacienta a tolerance léčby. Výjimkou je zmíněná fibrotizující cholestatická hepatitida štěpu, kdy odklad léčby znamená selhání štěpu jater. Až do roku 2011 byla standardním postupem v léčbě rekurence HCV léčba pegylovaným interferonem α a ribavirinem. Různí autoři popsali dosažení SVR v 8–45 % [17], později se účinnost ustálila na průměrné hodnotě 30 % [18]. Nižší účinnost léčby byla nalezena v souborech s vyšším zastoupením pacientů s cirhózou štěpu. Nejdůležitějším prognostickým faktorem dosažení SVR byl stejně jako u pacientů netransplantovaných rychlý iniciální pokles viremie (časná virologická odpověď, EVR). Popsaná účinnost platí pro léčbu trvající 48 týdnů, prodloužení léčby na 72 týdnů u pacientů s pozitivní viremií ve 12. týdnu léčby (bez dosažení EVR) se sice doporučovalo, ale nebylo podloženo publikovanými daty [6,19]. Odložená léčba na rozdíl od léčby preemptivní nezvyšuje výskyt akutních ani chronických rejekcí ve srovnání s pacienty neléčenými [20,21]. Od roku 2011 se v západních zemích stala standardem léčby rekurence HCV po LTx léčba trojkombinací, k původní kombinaci pegylovaného interferonu α s ribavirinem se přidává ještě tzv. proteázový inhibitor (telaprevir nebo boceprevir). Oba léky patří do kategorie přímo působících antivirotik (direct acting antivirals – DAA). V léčbě HCV u netransplantovaných pacientů významně zvyšují účinnost léčby ve smyslu dosahování SVR, u pacientů po LTx byla zatím publikována pouze studie na malém souboru 37 pacientů, SVR byla hodnocena 12 týdnů po léčbě. SVR dosáhlo 5/7 léčených kombinací s telaprevirem a 1/5 pacientů léčených kombinací s boceprevirem [22]. Nežádoucí účinky byly časté včetně tří pacientů s fatální infekcí. S léčbou DAA je spojen vyšší výskyt nežádoucích účinků (zejména anemie a kožní exantémy), které vyžadují intenzivní podpůrnou léčbu v podobě erytropoetinu a lokálních kortikoidů. Léčba kombinací s DAA dále zvyšuje sérové hladiny cyklosporinu A a takrolimu, dávkování imunosupresiv musí být redukováno a hladiny pečlivě monitorovány.
Specifikem našeho souboru pacientů transplantovaných pro jaterní cirhózu C od počátku programu transplantace jater v roce 1995 až dosud je převládající infekce hůře léčitelným genotypem 1b. Cílem předložené práce bylo zhodnotit dlouhodobé přežití našich pacientů s HCV po transplantaci jater, zhodnotit účinnost protivirové léčby rekurence HCV ve štěpu a přínos léčby pro dlouhodobé přežití po transplantaci.
Metodika práce a soubor pacientů
Retrospektivně jsme hodnotili 149 pacientů, 50 žen a 99 mužů, transplantovaných pro jaterní cirhózu C v letech 1995–2013 z celkového počtu 957 pacientů transplantovaných v daném období (HCV 15,6 % indikací). Jejich průměrný věk byl 53 let (15–69). Až na jednoho pacienta s genotypem HCV 3a byli všichni ostatní (148/149) infikováni genotypem 1b. Čtyřicet osm pacientů mělo malý hepatocelulární karcinom v cirhóze (31/48 známý před transplantací, 17/48 incidentalom nalezený až v explantovaných játrech), 101 pacientů bylo bez tumoru. Imunosupresivní režim zahrnoval nejprve trojkombinaci cyklosporin A, mykofenolát mofetil a prednizon (41 pacientů), od roku 2004 byl režim změněn na takrolimus, mykofenolát mofetil a prednizon (108 pacientů). Prednizon byl časně vysazován s cílem léčby pouze dvojkombinací imunosupresiv nejpozději šest měsíců po transplantaci. Ze 149 pacientů jich 82 absolvovalo protivirovou léčbu, 67 léčeno nebylo. Všichni léčení pacienti měli genotyp HCV 1b. Protivirová léčba byla vedena dle standardních doporučení platných v době léčby, do roku 2002 konvenčním interferonem α a ribavirinem, od roku 2002 pegylovaným interferonem α a ribavirinem. Léčba byla zahájena odloženě, tj. až po histologickém průkazu rekurentní hepatitidy C ve štěpu, u 18 pacientů s fibrotizující cholestatickou hepatitidou pak dříve než šest měsíců po transplantaci, nejkratší interval mezi LTx a protivirovou léčbou byl čtyři týdny. Dosažení SVR bylo hodnoceno jako negativní viremie 24 týdnů po ukončení protivirové léčby.
Přežití pacientů indikovaných k LTx pro jaterní cirhózu C bylo srovnáváno se souborem všech ostatních pacientů transplantovaných ve stejném období (808 pacientů) a s užším souborem pacientů transplantovaných pro jaterní cirhózu jiné etiologie než HCV (680 pacientů). Přežívání po transplantaci bylo hodnoceno metodou dle Kaplan-Meier, ke srovnání celých křivek byl použit Log-rank test, porovnání významnosti křivek v jednotlivých bodech bylo testováno pomocí konfidenčních intervalů.
Výsledky
Přežití HCV pacientů bylo signifikantně horší než všech pacientů ostatních (graf 1), tři roky 79,3 %, pět let 72,5 % a deset let 62,9 % (nonHCV všichni 88,2 %, 85,8 % a 78,8 %; p < 0,001). Ještě větší byl rozdíl proti skupině pacientů s cirhózou jiné etiologie (nonHCV cirhotici, 89,4 %, 87,2 % a 79,7 %; p < 0,001). Přežití pacientů s hepatocelulárním karcinomem v jaterní cirhóze C (69,0 %, 66,6 % a 47,0 %) bylo horší proti pacientům bez tumoru (83,4 %, 75,5 % a 67,7 %; p = 0,06), rozdíl ale nebyl signifikantní. Protivirovou léčbou dosáhlo SVR 32/82 pacientů (39 %). Léčbou konvenčním interferonem α a ribavirinem se vyléčil jeden pacient z 11 (9 %), pegylovaným interferonem α a ribavirinem se vyléčilo 31 z 81 pacientů (38,3 %). Přežití pacientů, kteří dosáhli SVR, bylo významně lepší než přežití pacientů, kteří SVR nedosáhli (tři roky 100 % vs 85,7 %, pět let 92 % vs 76,9 % a deset let 92 % vs 63,3 %; p = 0,0026). Kumulativní mortalita ve skupině pacientů se SVR byla jen 6,25 % (dva z 32), ze zbylých 117 pacientů, tj. pacientů bez SVR a pacientů neléčených, zemřelo 46, tj. 30,9 %. Pacienti, kteří léčbou dosáhli SVR, se významně nelišili od pacientů, kteří se nevyléčili, věkem, pohlavím ani stupněm dysfunkce jater (Child-Pugh skóre a MELD skóre) v době transplantace. Nejhoršího přežití bylo dosaženo ve skupině pacientů, kteří protivirovou léčbu vůbec nedostali (63,1 %, 58,3 % a 47,0 %; p < 0,001 vs křivka pacientů se SVR). Křivky přežití a jejich statistické srovnání jsou uvedeny grafech 1–3 a v tab. 1.
Graf 1. Křivky přežití po transplantaci jater pacientů indikovaných pro jaterní cirhózu C (HCV všichni), pacientů indikovaných pro jaterní cirhózu jiné etiologie než HCV (nonHCV cirhotici) a všech ostatních transplantovaných pacientů bez HCV infekce (nonHCV všichni). Graph 1. Survival curves for liver transplant patients indicated for liver cirrhosis C (HCV all) patients indicated for liver cirrhosis etiology other than HCV (nonHCV cirrhotic patients) and all other transplant patients without HCV infection (nonHCV all). 
Graf 2. Křivky přežití po transplantaci jater pacientů indikovaných pro jaterní cirhózu C (HCV všichni) a odděleně pacientů, kteří měli v cirhóze malý hepatocelulární karcinom (HCV s HCC) a pacientů bez tumoru (HCV bez HCC). Graph 2. Survival curves for liver transplant patients indicated for liver cirrhosis C (HCV all) and, separately, patients who had cirrhosis of small hepatocellular carcinoma (HCV with HCC) and patients without tumor virus (HCV without HCC). 
Graf 3. Křivky přežití po transplantaci jater pacientů indikovaných pro jaterní cirhózu C (HCV všichni) a odděleně pacientů, kteří protivirovou léčbou dosáhli SVR (HCV se SVR ), nedosáhli SVR (HCV bez SVR ) a pacientů, kteří protivirovou léčbu neabsolvovali (HCV neléčeni). Graph 3. Survival curves for liver transplant patients indicated for liver cirrhosis C virus (HCV all) and separately patients antiviral therapy SVR (HCV SVR), did not achieve SVR (HCV without SVR) for patients who have not received antiviral treatment (untreated HCV). 
Tab. 1. Statistické srovnání dlouhodobého přežití jednotlivých podskupin pacientů po transplantaci jater. Tab. 1. Statistical comparison of long-term survival of subsetspatients after liver transplantation. 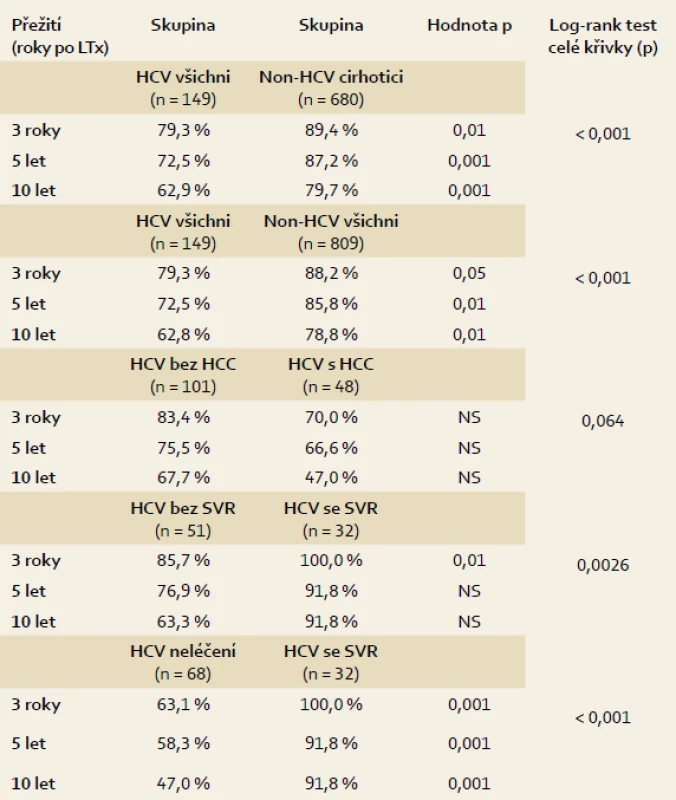
Diskuze
Dlouhodobé přežití po transplantaci jater všech ostatních nonHCV pacientů i podskupiny pacientů s nonHCV cirhózami bylo velmi dobré, srovnatelné s výsledky Evropského registru transplantací jater (European liver transplantation registry – ELTR) [23]. Stejně tak je horší přežití pacientů transplantovaných pro HCV kompatibilní s výsledky zmíněného registru. Přežití pacientů transplantovaných pro HCV v našem centru je nutno považovat za velmi dobré vzhledem ke skutečnosti, že až na jednoho byli všichni pacienti infikování nepříznivým genotypem 1b. Přítomnost hepatocelulárního karcinomu v cirhóze obvykle zhoršuje přežití ve srovnání s cirhotiky bez tumoru. Přežití našich pacientů s hepatocelulárním karcinomem v cirhóze bylo sice mírně horší než pacientů bez tumoru, rozdíl ale nebyl signifikantní, tím by se stal až při větším rozsahu souboru. Při hodnocení účinnosti a vlivu protivirové léčby na přežití pacientů jsme obě podskupiny (tj. pacienty s tumorem i bez tumoru) spojili. K rekurenci HCV po transplantaci dochází bez ohledu na přítomnost tumoru a protivirová léčba je indikována dle stejných kritérií bez ohledu, zda pacient měl před transplantací v cirhóze tumor, či nikoli. Výsledky naší retrospektivní analýzy jednoznačně dokládají příznivý vliv dosažení SVR protivirovou léčbou na dlouhodobé přežití pacientů indikovaných k transplantaci pro HCV. Dosažení SVR i u pacientů po transplantaci jater znamená úplnou eliminaci viru, všichni pacienti, kteří dosáhli SVR, mají natrvalo negativní viremii, u žádného z nich nedošlo k pozdnímu relapsu HCV. Vyléčení 38 % pacientů kombinací pegylovaného interferonu α a ribavirinu lze považovat za velmi dobrý výsledek s přihlédnutím ke skutečnosti, že všichni léčení pacienti byli infikováni genotypem 1b. Nepodařilo se nám nalézt významný prediktivní faktor úspěšnosti léčby; věkem, pohlavím a stupněm dysfunkce jater v době transplantace se pacienti se SVR a bez SVR nelišili. V retrospektivní analýze nebylo možno hodnotit nejvýznamnější popsané prediktivní faktory, kterými jsou viremie před léčbou, dosažení negativní viremie ve 4. a 12. týdnu léčby, IL28B genotyp příjemce i dárce. Viremie byla vyšetřována metodou odpovídající době léčby, z 90. let jsou k dispozici jen výsledky kvalitativních metod, před rokem 2005 pak jen výsledky málo citlivých metod kvantitativních. Stejně tak genotyp IL28B je znám pouze u pacientů léčených po roce 2008.
Nadějí na zlepšení dlouhodobé prognózy pro pacienty, kteří ho zatím nedosáhli SVR léčbou pegylovaným interferonem α a ribavivirinem, je léčba trojkombinací pegylovaný interferon α, ribavirin a boceprevir nebo telaprevir. V našem centru takto zatím léčíme šest pacientů, jeden léčbu předčasně ukončil pro těžkou, ale reverzibilní myelosupresi, zbývající dosáhli časné virologické odpovědi a zatím u nich nelze hodnotit SVR. Nejhorší přežití jsme zaznamenali u pacientů, kteří protivirovou léčbu vůbec nezahájili. Důvodem nezahájení léčby byly jiné závažné komplikace a komorbidity (infekce, dysfunkce štěpu, myelosuprese), které kontraindikovaly léčbu založenou na pegylovaném interferonu α. Přítomnost dalších závažných komplikací se odrazila na výrazném poklesu křivky přežití již v prvním roce po transplantaci, v dalších letech se pak pokles zastavil a křivka probíhá paralelně s křivkou pacientů, kteří nedosáhli SVR. Nadějí pro pacienty, kteří nemohou být léčeni pegylovaným interferonem α, je léčba kombinací přímo působících antivirotik, tzv. režim bez interferonu. V současné době probíhá vývoj řady preparátů určených ke kombinované léčbě v režimech bez interferonu. Zavedení do klinické praxe lze ale očekávat nejdříve za 3–4 roky.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
Doručeno: 2. 9. 2013
Přijato: 27. 9. 2013
MUDr. Jan Šperl, CSc.
Klinika hepatogastroenterologie, IKEM
Vídeňská 1958/9, 140 21 Praha 4
jan.sperl@ikem.cz
Zdroje
1. Charlton M, Ruppert K, Belle SH et al. Long-term results and modeling to predict outcomes in recipients with HCV infection: results of the NIDDK liver transplantation database. Liver Transpl 2004; 10(9): 1120–1130.
2. Gane EJ. The natural history of recurrent hepatitis C and what influences this. Liver Transpl 2008; 14 (Suppl 2): S36–S44.
3. Forman LM, Lewis JD, Berlin JA et al. The association between hepatitis C infection and survival after orthotopic liver transplantation. Gastroenterology 2002; 122(4): 889–896.
4. Neumann UP, Berg T, Bahra M et al. Long-term outcome of liver transplants for chronic hepatitis C: a 10-year follow-up. Transplantation 2004; 77(2): 226–231.
5. Berenguer M, Prieto M, San Juan F et al. Contribution of donor age to the recent decrease in patient survival among HCV-infected liver transplant recipients. Hepatology 2002; 36(1): 202–210.
6. Roche B, Sebagh M, Canfora ML et al. Hepatitis C virus therapy in liver transplant recipients: response predictors, effect on fibrosis progression, and importance of the initial stage of fibrosis. Liver Transpl 2008; 14(12): 1766–1777.
7. Picciotto FP, Tritto G, Lanza AG et al. Sustained virological response to antiviral therapy reduces mortality in HCV reinfection after liver transplantation. J Hepatol 2007; 46(3): 459–465.
8. Bedossa P, Poynard T. An algorithm for the grading of activity in chronic hepatitis C. The METAVIR Cooperative Study Group. Hepatology 1996; 24(2): 289–293.
9. Charlton M, Seaberg E, Wiesner R et al. Predictors of patient and graft survival following liver transplantation for hepatitis C. Hepatology 1998; 28(3): 823–830.
10. Gane EJ, Portmann BC, Naoumov NV et al. Long-term outcome of hepatitis C infection after liver transplantation. N Engl J Med 1996; 334(13): 815–820.
11. Zekry A, Whiting P, Crawford DH et al. Liver transplantation for HCV-associated liver cirrhosis: predictors of outcomes in a population with significant genotype 3 and 4 distribution. Liver Transpl 2003; 9(4): 339–347.
12. Charlton MR, Thompson A, Veldt BJ et al. Interleukin-28B polymorphisms are associated with histological recurrence and treatment response following liver transplantation in patients with hepatitis C virus infection. Hepatology 2011; 53(1): 317–324.
13. Fukuhara T, Taketomi A, Motomura T et al. Variants in IL28B in liver recipients and donors correlate with response to peg-interferon and ribavirin therapy for recurrent hepatitis C. Gastroenterology 2010; 139(5): 1577–1585.
14. Humar A, Kumar D, Raboud J et al. Interactions between cytomegalovirus, human herpesvirus-6, and the recurrence of hepatitis C after liver transplantation. Am J Transplant 2002; 2(5): 461–466.
15. Mazzaferro V, Tagger A, Schiavo M et al. Prevention of recurrent hepatitis C after liver transplantation with early interferon and ribavirin treatment. Transplant Proc 2001; 33(1–2): 1355–1357.
16. Shergill AK, Khalili M, Straley S et al. Applicability, tolerability and efficacy of preemptive antiviral therapy in hepatitis C-infected patients undergoing liver transplantation. Am J Transplant 2005; 5(1): 118–124.
17. Wang CS, Ko HH, Yoshida EM et al. Interferon-based combination anti-viral therapy for hepatitis C virus after liver transplantation: a review and quantitative analysis. Am J Transplant 2006; 6(7): 1586–1599.
18. Berenguer M, Aguilera V, Prieto M et al. Worse recent efficacy of antiviral therapy in liver transplant recipients with recurrent hepatitis C: impact of donor age and baseline cirrhosis. Liver Transpl 2009; 15(7): 738–746.
19. Berenguer M, Palau A, Fernandez A et al. Efficacy, predictors of response, and potential risks associated with antiviral therapy in liver transplant recipients with recurrent hepatitis C. Liver Transpl 2006; 12(7): 1067–1076.
20. Chalasani N, Manzarbeitia C, Ferenci P et al. Peginterferon alfa-2a for hepatitis C after liver transplantation: two randomized, controlled trials. Hepatology 2005; 41(2): 289–298.
21. Samuel D, Bizollon T, Feray C et al. Interferon-alpha 2b plus ribavirin in patients with chronic hepatitis C after liver transplantation: a randomized study. Gastroenterology 2003; 124(3): 642–650.
22. Coilly A, Roche B, Dumortier J et al. Safety and efficacy of protease inhibitors to treat hepatitis C after liver transplantation, a multicenter experience. J Hepatol 2013; doi: 10.1016/j.jhep.2013.08.018.
23. Adam R, Karam V, Delvart V et al. Evolution of indications and results of liver transplantation in Europe. A report from the European Liver Transplant Registry (ELTR). J Hepatol 2012; 57(3): 675–688.
Štítky
Detská gastroenterológia Gastroenterológia a hepatológia Chirurgia všeobecná
Článok vyšiel v časopiseGastroenterologie a hepatologie
Najčítanejšie tento týždeň
2013 Číslo 5- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Kombinace metamizol/paracetamol v léčbě pooperační bolesti u zákroků v rámci jednodenní chirurgie
- Antidepresivní efekt kombinovaného analgetika tramadolu s paracetamolem
- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
- Srovnání analgetické účinnosti metamizolu s ibuprofenem po extrakci třetí stoličky
-
Všetky články tohto čísla
- Gastrointestinální onkologie
- Kvíz – postižení jater s normálními jaterními testy
- Metodika adresného zvaní občanů do českého programu screeningu nádorů tlustého střeva a konečníku
- Vliv klinických a molekulárních faktorů na odhad rekurence kolorektálních adenomů u dlouhodobě sledovaných pacientů
- Postavenie neoadjuvantnej terapie v multimodálnej liečbe karcinómu rekta – klinické výsledky
- Hereditárny difúzny karcinóm žalúdka
- Cílená léčba karcinomu pankreatu – minulost či budoucnost?
- Lymfomy tenkého střeva
- Stav onkochirurgické péče a vzdělávání v onkochirurgii v České republice
- Multidisciplinární přístup v diagnostice a léčbě karcinomu žaludku
- 1 000 transplantací jater v IKEM
- Prvních 1 000 transplantací jater v IKEM
- Transplantace jater pro chronickou hepatitidu C, význam protivirové léčby
- Transplantace jater pro primární sklerozující cholangitidu
- Méně časté indikace k ortotopické transplantaci jater
- Vývoj postupů v léčbě akutního selhání jater
- Endosonograficky navigovaná tenkoihlová aspiračná biopsia zo solídnych pankreatických más – presnosť a impakt na liečbu u 358 pacientov
- Správná odpověď na kvíz
- Příprava tlustého střeva u pacientů s idiopatickými střevními záněty před endoskopickými nebo kolografickými (CT/MR) vyšetřeními – stanovisko IBD pracovní skupiny
-
XXII. jarní setkání Loket 2013 – Neoplazie žaludku
3. postgraduální kurz společnosti pro gastrointestinální onkologii - Životní jubileum prof. Miroslava Zavorala
- Picoprep – očistný prostředek s dvojím účinkem
- Autodidaktický test: gastrointestinální onkologie
- Gastroenterologie a hepatologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Picoprep – očistný prostředek s dvojím účinkem
- Lymfomy tenkého střeva
- Transplantace jater pro primární sklerozující cholangitidu
- Hereditárny difúzny karcinóm žalúdka
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



