Funkční testy pro detekci nádorových kmenových buněk
Functional Assays for Detection of Cancer Stem Cells
Cancer stem cells (CSCs) are considered to be a population of tumor cells, which are responsible for tumor initiation and progression. They are also involved in metastasizing and may be a possible cause of multidrug resistance and tumor recurrence. CSCs possess the ability to self ‑ renew and show a tumorigenic potential. Functional assays, which enable the detection of these properties, represent the main tool for identification of CSCs. This article summarizes both in vitro and in vivo methods used to identify the CSCs with emphasis on recently employed techniques of CSCs detection. In vivo tumorigenicity assay, sphere formation assay and colony ‑ forming unit assay belong to the most commonly used functional assays. Further, label ‑ retention assay and aldehyde dehydrogenase activity assay are described in this article.
Key words:
cancer stem cells – functional assays – tumorigenicity – tumor spheres – colony ‑ forming unit assay – side population cells – aldehyde dehydrogenase
The study was supported by grant of Internal Grant Agency of the Czech Ministry of Health No. NT13443-4 and by the European Regional Development Fund and the State Budget of the Czech Republic – RECAMO, CZ.1.05//2.1.00/03.0101 and by the project CEB, OP VK CZ.1.07/2.3.00/20.0183.
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE “uniform requirements” for biomedical papers.
Submitted:
16. 1. 2014
Accepted:
4. 4. 2014
Authors:
J. Škoda 1,2; J. Neradil 1,3; R. Veselska 1,2
Authors‘ workplace:
Laboratoř nádorové biologie, Ústav experimentální biologie, Přírodovědecká fakulta MU, Brno
1; Klinika dětské onkologie LF MU a FN Brno
2; Regionální centrum aplikované molekulární onkologie, Masarykův onkologický ústav, Brno
3
Published in:
Klin Onkol 2014; 27(Supplementum): 42-47
Overview
Nádorové kmenové buňky (cancer stem cells – CSCs) jsou považovány za populaci buněk, která odpovídá za iniciaci a progresi nádoru, účastní se procesu metastazování a je možnou příčinou získané lékové rezistence a rekurence nádorů. CSCs disponují schopností sebeobnovy a mají tumorigenní potenciál. Funkční testy, které umožňují detekovat zmiňované vlastnosti, jsou hlavním nástrojem pro identifikaci nádorových kmenových buněk. Tento článek přináší ucelený přehled in vivo a in vitro metod využívaných pro průkaz CSCs s důrazem na recentně zaváděné techniky detekce CSCs. Mezi nejčastěji prováděné funkční testy patří test tumorigenicity in vivo, testy tvorby sfér (sphere formation assay) a kolonií (colony ‑ forming unit assay) a rovněž detekce tzv. vedlejší populace (side population). Dále jsou popsány metody zadržování detekční značky (label ‑ retention assay) a test aktivity aldehyddehydrogenázy.
Klíčová slova:
nádorové kmenové buňky – funkční testy – tumorigenicita – nádorové sféry – tvorba kolonií – vedlejší populace buněk – aldehyddehydrogenáza
Úvod
Nádorové kmenové buňky (cancer stem cells – CSCs) jsou definovány jako subpopulace buněk nádoru, které jsou schopny sebeobnovy a mají potenciál diferencovat do všech typů nádorových buněk tvořících masu daného nádoru [1]. Dle tohoto modelu odpovídají CSCs za iniciaci a kontinuální růst nádoru a jsou také příčinou vysoké buněčné heterogenity, se kterou se u mnoha typů nádorů setkáváme [2]. Navíc již v řadě studií bylo prokázáno, že CSCs (podobně jako jiné druhy kmenových buněk) disponují zvýšenou odolností proti chemoterapii a radioterapii [3 – 5]. Z toho lze usuzovat, že právě CSCs by mohly být příčinou často se vyskytující získané lékové rezistence a rekurence nádorů, které představují v současnosti největší problém v léčbě nádorových onemocnění. Zatímco dosavadní léčba nádorů se zaměřuje především na redukci celkové masy nádoru, limitem v dlouhodobém vyléčení nemoci mohou být právě rezistentní CSCs, jež v určitém čase po terapii dají vzniknout nové populaci nádorových buněk – často již rezistentních k původní léčbě. Zejména v posledním desetiletí proto CSCs představují významnou oblast výzkumu nádorových onemocnění a recentní studie přinášejí slibné výsledky, kdy kombinovaná léčba zaměřující se mj. na CSCs vede k lepší léčebné odpovědi [3].
Základ modelu CSCs lze dohledat již v roce 1855, kdy Rudolf Virchow představil teorii, podle které nádory vznikají z nezralých buněk [6]. Termín „nádorové kmenové buňky“ byl však použit až v roce 1959 pro popis nepočetné populace buněk, jež byly rezistentní k chemoterapii a nacházely se u nich odlišné chromozomální změny v porovnání s ostatními buňkami nádoru [7]. Následné transplantační experimenty in vivo a klonogenní testy in vitro provedené v 70. letech minulého století potvrdily, že nádory mohou vznikat ze vzácně se vyskytujících buněk, které mají schopnost sebeobnovy a jsou schopny rekapitulovat buněčnou heterogenitu původního nádoru. S rozvojem technik průtokové cytometrie a s přispěním poznatků o biologii kmenových buněk bylo možné izolovat CSCs z nádorové tkáně na základě specifických povrchových markerů, často shodných s těmi, které se využívají pro identifikaci adultních kmenových buněk. Tímto přístupem byly CSCs nejprve identifikovány u hematoonkologických malignit [8], později u karcinomu prsu [9] a poté u celé řady dalších solidních nádorů [10]. V současné době je sortování buněk na základě povrchových markerů obecně uplatňovaným přístupem při výzkumu CSCs. Specifita markerů CSCs se však může mezi jednotlivými typy nádorů lišit a je nezbytné ověřit, zda izolovaná populace buněk disponuje základními vlastnostmi CSCs – schopností sebeobnovy a tumorigeneze. Pro tyto účely se využívají funkční testy, které lze dle metodického přístupu rozdělit na testy in vivo a in vitro. V následujících kapitolách bude podán přehled těchto metod.
Funkční testy CSCs in vivo
Test tumorigenicity
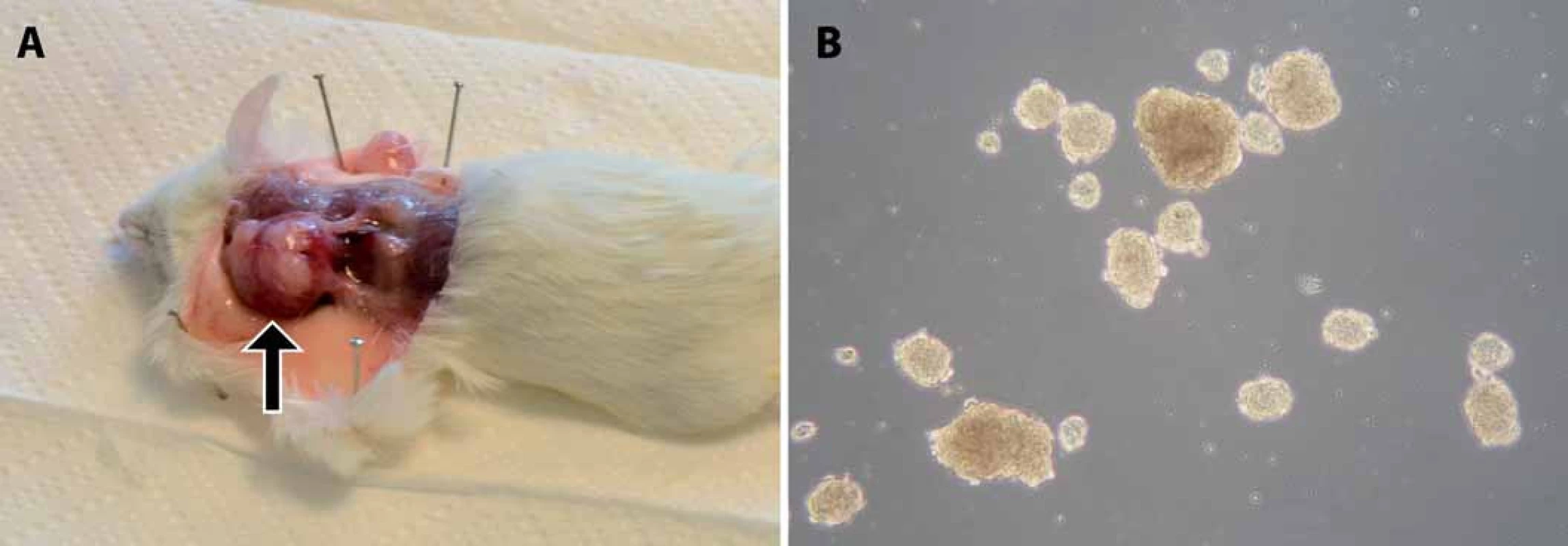
Test tumorigenicity představuje dosud nejlepší funkční test fenotypu CSCs, kterým lze současně ověřit schopnost sebeobnovy i schopnost vytvořit nádor, jenž rekapituluje buněčnou heterogenitu nádoru původního, a to přímo v prostředí in vivo. Principem testu je opakovaná transplantace testovaných buněk do zvířecího modelu, nejčastěji myši imunodeficientního kmene – typicky NOD/ SCID (nonobese diabetic/ severe combined immunodeficiency) (obr. 1) [1]. Dle původu a homogenity testované populace buněk bývá do vhodného místa myši injikováno 100 až několik miliónů buněk [9,11,12]. Injikace se obvykle provádí subkutánně, ale buňky lze transplantovat i do jednotlivých orgánů – mozku [11,13], svalu [12] či prsní žlázy [14]. Myši jsou poté průběžně kontrolovány a v případě nálezu nádoru nebo po uplynutí stanovené doby jsou usmrceny (obr. 2A). Schopnost tumorigeneze je hodnocena na základě poměru počtu zvířat, u kterých se vyvinul nádor, k počtu celkově injikovaných. Mezi další kritéria hodnocení pak patří velikost nádoru, doba do nálezu tumoru a počet injikovaných buněk. Schopnost sebeobnovy je však potřeba dále ověřit opakovanou izolací CSCs z xenograftového nádoru a jejich transplantací do dalšího zvířete (obr. 1) [1].
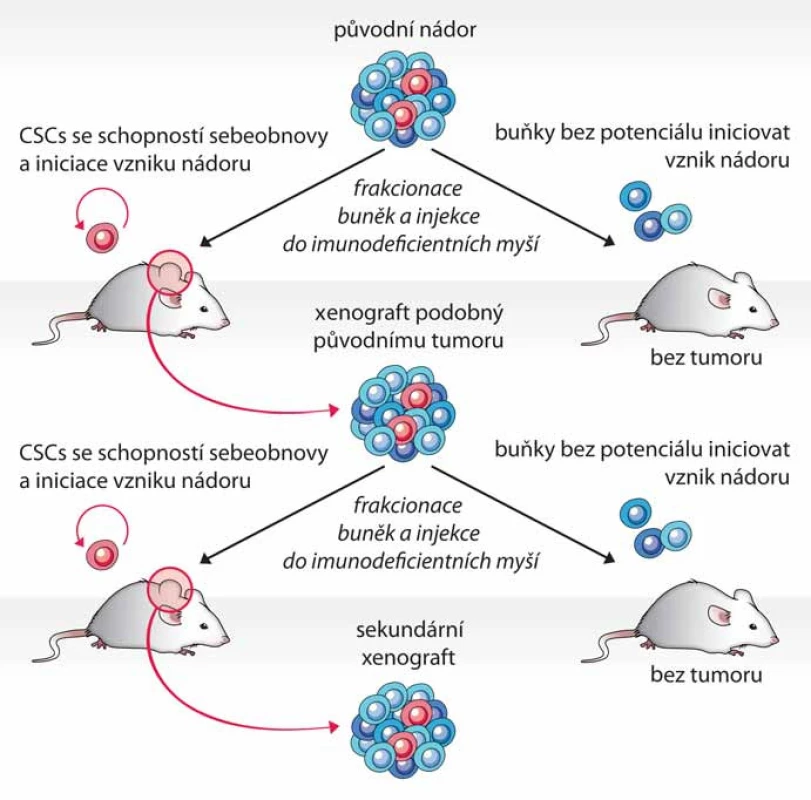
Ve většině prvotních prací prokazujících přítomnost nepočetné populace CSCs u různých typů nádorů byly pro test tumorigenicity využívány NOD/ SCID myši. V posledních letech ale byly publikovány práce, které ukázaly, že tumorigenicita testovaných buněk (a tedy i senzitivita testu) může být výrazně zvýšena použitím více imunodeficientních transgenních myších kmenů NOD/ SCID// IL2Rγnull, NOD/ ShiLtSz-scid/ IL2Rγnull (NSG) a NOD/ ShiJic-scid/ IL2Rγnull (NOG), nesoucích mutaci v genu pro řetězec gama receptoru pro interleukin‑2 [15]. Použitím NSG myší se u maligního melanomu zvýšilo vypočítané zastoupení CSCs z původně publikovaných 0,0001 % na 25 %, přičemž nádory u myší vznikaly již při injikaci jediné buňky [16]. Podobně došlo ke zvýšení tumorigenicity u leukemických kmenových buněk [17]. Ačkoliv u některých solidních nádorů, např. adenokarcinomu pankreatu, nebyla pozorována změna ve frekvenci výskytu CSCs [18], využití NSG myší obecně zkrátilo dobu do prvního nálezu nádoru. Právě časová náročnost testu tumorigenicity, kdy od injekce testovaných buněk do vytvoření nádoru uplyne často i několik měsíců, je jedna z nevýhod tohoto testu. CSCs mohou během této doby projít řadou genetických a epigenetických změn, což znesnadňuje interpretaci výsledků testu [1]. Využití více imunodeficientních kmenů myší, NSG a NOG, se proto jeví jako vhodná optimalizace testu.
Další limit testu tumorigenicity může představovat mikroprostředí v místě transplantace a způsob injikace buněk. Je známo, že kmenové buňky jsou do značné míry závislé na produkci signálů od okolního stromatu [19]. Při experimentech, kdy byly do myší injikovány smíšené populace nádorových buněk a fibroblastů asociovaných s nádorem (cancer‑associated fibroblasts), došlo ke zvýšení agresivity a velikosti nádoru [20]. Kombinace nádorových buněk s normálními diploidními fibroblasty měla po transplantaci do myši efekt opačný. Výsledky některých studií ukazují, že i samotné nádorové stroma ovlivňuje okolní buňky a původně nenádorové buňky umístěné do jeho blízkosti se pravděpodobně v důsledku genetických či epigenetických změn stávají tumorigenními [21 – 24]. Míra tumorigenicity může být také zvýšena přidáním mitoticky inaktivovaných podpůrných buněk (feeder cells) nebo MatrigeluTM, který obsahuje proteiny extracelulární matrix [1,16,25,26].
Potřeba sledovat interakce CSCs a mikroprostředí in vivo vedla v posledních letech k rozvoji specializovaných metod založených na intravitální mikroskopii a multifotonovém zobrazování [27]. Pomocí těchto metod je možné v čase a při rozlišení jednotlivých buněk pozorovat buňky exprimující fluorescenční protein přímo v myši bez nutnosti jejího usmrcení či narušení příslušné tkáně. To mimo jiné umožňuje sledování původu buněk (lineage tracing), což pomáhá lépe pochopit dynamiku tumorigeneze. V recentních studiích byly fluorescenčně značené nádorové buňky získány dvěma způsoby: 1. využitím transgenních kmenů myší, které spontánně vytvářejí nádory a zároveň v buňkách obsahují fluorescenční protein s regulovatelnou expresí [28 – 30], nebo 2. pomocí transdukce izolovaných buněk příslušnou fluorescenční značkou a jejich xenotransplantací do imunodeficientní myši [31]. Právě tento druhý přístup, kdy je možné izolovanou populaci CSCs značit fluorescenčním proteinem, injikovat do myši (případně i společně s dalšími odlišně značenými populacemi buněk) a sledovat v čase, by se v budoucnu mohl stát optimálním rozšířením klasického testu CSCs in vivo.
Funkční testy CSCs in vitro
Oproti metodám in vivo jsou in vitro testy fenotypu CSCs výhodné zejména z důvodu menší časové a finanční náročnosti. I přesto je nutné výsledky získané in vitro ověřit testem in vivo. Dobře navržený funkční test in vitro by měl mít dostatečnou specifitu a citlivost pro detekci nízce zastoupené populace CSCs a zároveň by měl umožňovat kvantitativní hodnocení. Mezi nejčastěji využívané funkční testy in vitro patří: 1. test tvorby buněčných sfér (sphere formation assay), 2. test tvorby kolonií (colony ‑ forming unit – CFU assay), označovaný též jako klonogenní test, 3. detekce vedlejší populace (side population – SP analysis), 4. test zadržování detekční značky v buňce (label ‑ retention assay) a 5. test aktivity aldehyddehydrogenázy [1,32].
Test tvorby buněčných sfér
Průkaz schopnosti původně jednotlivých buněk dělit se a vytvářet sféry – tedy kulovité shluky buněk – umožňuje kvantifikovat aktivitu a sebeobnovu CSCs (obr. 2B) [33]. Test je prováděn v médiu s definovaným obsahem růstových faktorů, aby se minimalizovalo působení externích buněčných signálů, a za neadherentních podmínek kvůli ověření nezávislosti na adherenci k substrátu. Pro ověření sebeobnovy CSCs je nutné sféry opakovaně pasážovat – sféry jsou enzymaticky převedeny na suspenzi jednotlivých buněk a opětovně kultivovány za definovaných podmínek [34,35]. Dle počtu zformovaných sfér v druhé a dalších generacích lze určit nejen schopnost sebeobnovy, ale také klonogenity příslušných buněk.
Buněčné sféry byly odvozeny z celé řady nádorů a často bývají nazývány dle tkáňového původu nebo názvu nádoru (uvedeno v závorce): neuronální nádory (neurosféry) [13,36], karcinom prsu (mamosféry) [14], rabdomyosarkom(rabdosféry) [12], osteosarkom (sarkosféry) [37,38], karcinom tlustého střeva (kolonosféry) [39], karcinom prostaty(prostasféry) [40] a hepatom (hepato-sféry) [41].
Nevýhodou počátečních experimentů prováděných v tekutém médiu byla skutečnost, že mohlo docházet k agregaci buněk, a sféry tak mohly vznikat z více než jedné buňky, přičemž tento aspekt je ale zásadním kritériem pro hodnocení testu. Uvedený problém lze překonat použitím semisolidního média, které omezuje pohyb buněk a tím i jejich možnou agregaci [37,38].
Obdobu testu tvorby sfér představuje test tvorby kolonií z jednobuněčné suspenze v měkkém agaru (soft agar colony ‑ forming assay), v němž je také ověřována schopnost sebeobnovy, tumorigenity a klonogenity CSCs [37,40]. Dělením jednotlivých buněk dochází v agaru ke vzniku trojrozměrných buněčných kolonií.
Test tvorby kolonií
Princip této metody je podobný jako u předchozího testu. Suspenze jednotlivých buněk izolované populace se vyseje na kultivační misku a po určité době se vyhodnotí počet kolonií (obvykle musí být tvořeny více než 30 – 70 buňkami) [41 – 44]. Kultivace však probíhá za adherentních podmínek v médiu s přídavkem séra. Povrch kultivačních misek může být případně potažen MatrigelemTM [41].
V minulém roce byl publikován postup, který test tvorby kolonií do značné míry automatizuje [44]. Buňky byly tříděny metodou FACS (fluorescence‑activated cell sorting, třídění buněk pomocí fluorescence) na základě exprese povrchových markerů CSCs a jednotlivě automaticky vysety do 96jamkových nebo 384jamkových mikrotitračních destiček. Tento přístup výrazně zkracuje časovou a manuální náročnost testu a díky použití vícejamkových destiček umožňuje velmi rychlé kvantitativní hodnocení, např. fluorescenčním skenovacím cytometrem [45].
Detekce vedlejší populace
Vedlejší populace (side population – SP)je definována jako populace buněk, která je schopna z cytoplazmy vylučovat fluorescenční barvivo Hoechst 33342 [46]. Tento fluorochrom s emisním maximem 460 nm (modrá barva spektra) má schopnost vázat se na DNA a v tomto stavu lze navíc detekovat emisi i v červené části spektra. Toho se využívá při průtokové cytometrii, případně při FACS, kdy SP vykazuje výrazně nižší fluorescenci v červeném spektru oproti modrému spektru.
K vypuzování fluorescenčního barviva dochází aktivitou membránových proteinů spadajících do rodiny ABC (ATP‑binding cassette) transportérů, které jsou mimo jiné odpovědné za transport xenobiotik [46,47]. V souvislosti s CSCs je z této skupiny nejčastěji zkoumaný protein ABCG2, jehož zvýšená exprese je považována za možnou příčinu rezistence CSCs k chemoterapeutikům [47,48]. Při detekci nebo izolaci CSCs na základě SP je proto nezbytné provést kontrolní experiment s využitím některého z inhibitorů ABCG2 proteinu – nejčastěji se používají verapamil [49] nebo fumitremorgin C [50].
Určitou nevýhodou detekce SP fluorochromem Hoechst 33342 je nutnost použití excitačního UV laseru (355 nm), který nebývá v základní konfiguraci obvykle používaných průtokových cytometrů. Jako alternativu k barvivu Hoechst 33342 lze použít rhodamin 123 (Rho123), který je vylučován stejným typem membránového transportéru a jeho excitace se provádí pomocí základního modrého laseru (488 nm) [38].
Test zadržování detekční značky
Další in vitro metodou pro identifikaci CSCs izolovaných ze solidních nádorů je test schopnosti zadržování detekční značky v buňce (label ‑ retention assay) [51 – 53]. V literatuře lze najít pod označením „label ‑ retention assay“ dvě metody značení buněk.
Původní metoda vychází z hypotézy existence „nesmrtelného řetězce“ (immortal strand hypothesis) a jejím cílem je průkaz kmenových buněk pomocí značení mateřského řetězce DNA H3 - thymidinem nebo bromdeoxyuridinem [51,54]. Testované buňky jsou nejprve označeny některým z těchto prekurzorů a po několika buněčných děleních je u nich detekována intenzita signálu. Během asymetrického dělení by měly kmenové buňky zadržovat značený mateřský („nesmrtelný“) řetězec a do dceřiné buňky by měl být předáván pouze nově vzniklý neznačený řetězec. Jiným vysvětlením pro zadržování detekční značky by mohl být prodloužený buněčný cyklus CSCs oproti ostatním buňkám nádoru. U buněk, které nemají vlastnosti CSCs, by mělo jejich dělením docházet k rozředění značených řetězců v populaci dceřiných buněk [55].
Druhá z metod označovaných jako „label ‑ retention assay“ využívá stabilní značení buněk fluorochromy [52,56]. Při buněčném dělení dochází k rovnoměrnému rozdělení těchto flurochromů do dceřiných buněk, a tedy ke snížení fluorescence jednotlivých buněk na polovinu. Po určitém počtu dělení (obvykle 8 – 10) dojde ke snížení intenzity fluorescence na úroveň neznačených buněk. Hodnocením fluorescence jednotlivých buněk lze potom určit míru proliferace dané populace buněk. Pro značení buněk je využíváno fluorescenční barvivo CFSE (carboxyfluorescein diacetate succinimidylester), které volně prostupuje přes plazmatickou membránu a kovalentně se váže na proteiny v buňkách, nebo sondy PKH26 a DiI, jež se vážou na plazmatickou membránu. Na základě vysoké fluorescence v důsledku prodlouženého buněčného cyklu byla pomocí této metody detekována populace buněk, která vykazuje další znaky typické pro CSCs, jako je zvýšená schopnost tvorby kolonií, tumorigeneze in vivo a exprese markerů kmenových buněk [57].
Test aktivity aldehyddehydrogenázy
Exprese aldehyddehydrogenázy (ALDH) je specifická pro kmenové buňky, a je proto využívána jako jeden z jejich markerů [58]. Měření aktivity ALDH pomocí štěpení specifického substrátu patří mezi funkční testy fenotypu CSCs [59]. Substrát označovaný jako BAAA (BODIPY aminoacetaldehyde) proniká difuzí do buňky, kde je štěpen pomocí ALDH na BAA (BODIPY amino acetate) a dochází tak k emisi fluorescence, která může být kvantifikována pomocí průtokové cytometrie. Buňky s vysokou intenzitou fluorescence (a tedy vysokou aktivitou ALDH) jsou považovány za CSCs. V současnosti existuje komerčně dostupný systém pro detekci aktivity ALDH pod označením AldefluorTM.
Závěr
Funkční testy pro detekci buněk s fenotypem CSCs představují nepostradatelnou součást aktuálního výzkumu nádorových onemocnění. Metodické přístupy, které byly pro účely detekce CSCs vyvinuty, jsou postupně využívány i pro výzkum léčiv cílených na CSCs stejně jako pro vývoj protinádorových léčiv obecně. Nádorové sféry představují lepší model solidního nádoru v podmínkách in vitro než buňky pěstované jako monolayer. Automatizovaná příprava kolonií umožňuje vysoce efektivně testovat a kvantifikovat účinky léčiv. Sledování původu buněk u transgenních kmenů myší může v budoucnu ukázat, které populace buněk jsou v organizmu použitou léčbou ovlivněny. Lze očekávat, že při dalším vývoji funkčních testů CSCs bude snaha lépe postihnout i vliv nádorového mikroprostředí na funkci CSCs a testy budou rozšiřovány o metody sledování původu buněk, které pomohou charakterizovat interakce CSCs a ostatních buněk nádoru.
Práce byla podpořena grantem IGA MZ ČR NT13443-4 a Evropským fondem pro regionální rozvoj a státním rozpočtem České republiky OP VaVpI – RECAMO, CZ.1.05/2.1.00/03.0101 a projektem CEB, OP VK CZ.1.07/2.3.00/20.0183.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
Mgr. Jan Škoda
Laboratoř nádorové biologie
Ústav experimentální biologie
Přírodovědecká fakulta MU
Kotlářská 2
611 37 Brno
e-mail: janskoda@sci.muni.cz
Obdrženo: 16. 1. 2014
Přijato: 4. 4. 2014
Sources
1. Clarke MF, Dick JE, Dirks PB et al. Cancer stem cells − perspectives on current status and future directions: AACR workshop on cancer stem cells. Cancer Res 2006; 66(19): 9339 – 9344.
2. Magee JA, Piskounova E, Morrison SJ. Cancer stem cells: impact, heterogeneity, and uncertainty. Cancer Cell 2012; 21(3): 283 – 296. doi: 10.1016/ j.ccr.2012.03.003.
3. Vidal SJ, Rodriguez ‑ Bravo V, Galsky M et al. Targeting cancer stem cells to suppress acquired chemotherapy resistance. Oncogene 2013; 10 : 1−13. doi: 10.1038/ onc.2013.411.
4. Baumann M, Krause M, Hill R. Exploring the role of cancer stem cells in radioresistance. Nat Rev Cancer 2008; 8(7): 545 – 554. doi: 10.1038/ nrc2419.
5. Hittelman WN, Liao Y, Wang L et al. Are cancer stem cells radioresistant? Future Oncol 2010; 6(10): 1563 – 1576. doi: 10.2217/ fon.10.121.
6. Cogle CR. Cancer stem cells: historical perspectives and lessons from leukemia. In: Alison AL (ed.). Cancer stem cells in solid tumors. Springer 2011 : 3 – 11.
7. Welte Y, Adjaye J, Lehrach HR et al. Cancer stem cells in solid tumors: elusive or illusive? Cell Commun Signal 2010; 8(1): 6. doi: 10.1186/ 1478 - 811X ‑ 8 - 6.
8. Bonnet D, Dick JE. Human acute myeloid leukemia is organized as a hierarchy that originates from a primitive hematopoietic cell. Nat Med 1997; 3(7): 730 – 737.
9. Al ‑ Hajj M, Wicha MS, Benito ‑ Hernandez A et al. Prospective identification of tumorigenic breast cancer cells. Proc Natl Acad Sci USA 2003; 100(7): 3983 – 3988.
10. Beck B, Blanpain C. Unravelling cancer stem cell potential. Nat Rev Cancer 2013; 13(10): 727 – 738. doi: 10.1038/ nrc3597.
11. Singh SK, Hawkins C, Clarke ID et al. Identification of human brain tumour initiating cells. Nature 2004; 432(7015): 396 – 401.
12. Walter D, Satheesha S, Albrecht P et al. CD133 positive embryonal rhabdomyosarcoma stem‑like cell population is enriched in rhabdospheres. PLoS One 2011; 6(5): e19506. doi: 10.1371/ journal.pone.0019506.
13. Hemmati HD, Nakano I, Lazareff JA et al. Cancerous stem cells can arise from pediatric brain tumors. Proc Natl Acad Sci USA 2003; 100(25): 15178 – 15183.
14. Ponti D, Costa A, Zaffaroni N et al. Isolation and in vitro propagation of tumorigenic breast cancer cells with stem/ progenitor cell properties. Cancer Res 2005; 65(13): 5506 – 5011.
15. McDermott SP, Eppert K, Lechman ER et al. Comparison of human cord blood engraftment between immunocompromised mouse strains. Blood 2010; 116(2): 193 – 200. doi: 10.1182/ blood ‑ 2010 - 02 - 271841.
16. Quintana E, Shackleton M, Sabel MS et al. Efficient tumour formation by single human melanoma cells. Nature 2008; 456(7222): 593 – 598. doi: 10.1038/ nature07567.
17. Agliano A, Martin‑Padura I, Mancuso P et al. Human acute leukemia cells injected in NOD/ LtSz ‑ scid/ IL‑2Rgamma null mice generate a faster and more efficient disease compared to other NOD/ scid‑related strains. Int J Cancer 2008; 123(9): 2222 – 2227. doi: 10.1002/ ijc.23772.
18. Ishizawa K, Rasheed ZA, Karisch R et al. Tumor ‑ initiating cells are rare in many human tumors. Cell Stem Cell 2010; 7(3): 279 – 282. doi: 10.1016/ j.stem.2010.08.009.
19. Scadden DT. The stem ‑ cell niche as an entity of action. Nature 2006; 441 : 1075 – 1079.
20. Orimo A, Gupta PB, Sgroi DC et al. Stromal fibroblasts present in invasive human breast carcinomas promote tumor growth and angiogenesis through elevated SDF ‑ 1/ CXCL12 secretion. Cell 2005; 121(3): 335 – 348.
21. Olumi AF, Grossfeld GD, Hayward SW et al. Carcinoma‑associated fibroblasts direct tumor progression of initiated human prostatic epithelium. Cancer Res 1999; 59(19): 5002 – 5011.
22. Tzukerman M, Skorecki K. A novel experimental platform for investigating tumorigenesis and anti‑cancer therapy in a human microenvironment derived from embryonic stem cells. Discov Med 2003, 3(19): 51 – 54.
23. Micke P, Ostman A. Tumour ‑ stroma interaction: cancer‑associated fibroblasts as novel targets in anti‑cancer therapy? Lung Cancer 2004; 45 (Suppl 2): 163 – 175.
24. Fabris VT, Sahores A, Vanzulli SI et al. Inoculated mammary carcinoma‑associated fibroblasts: contribution to hormone independent tumor growth. BMC Cancer 2010; 10 : 293. doi: 10.1186/ 1471 - 2407 - 10 - 293.
25. Yeung TM, Gandhi SC, Wilding JL et al. Cancer stem cells from colorectal cancer ‑ derived cell lines. Proc Natl Acad Sci USA 2010; 107(8): 3722 – 3727. doi: 10.1073/ pnas.0915135107.
26. Di Fiore R, Guercio A, Puleio R et al. Modeling human osteosarcoma in mice through 3AB ‑ OS cancer stem cell xenografts. J Cell Biochem 2012; 113(11): 3380 – 3392. doi: 10.1002/ jcb.24214.
27. Wyckoff J, Gligorijevic B, Entenberg D et al. High‑resolution multiphoton imaging of tumors in vivo. Cold Spring Harb Protoc 2011; 2011(10): 1167 – 1184. doi: 10.1101/ pdb.top065904.
28. Chen J, Li Y, Yu TS et al. A restricted cell population propagates glioblastoma growth after chemotherapy. Nature 2012; 488(7412): 522 – 526. doi: 10.1038/ nature11287.
29. Driessens G, Beck B, Caauwe A et al. Defining the mode of tumour growth by clonal analysis. Nature 2012; 488(7412): 527 – 530. doi: 10.1038/ nature11344.
30. Zomer A, Ellenbroek SI, Ritsma L et al. Intravital imaging of cancer stem cell plasticity in mammary tumors. Stem Cells 2013; 31(3): 602 – 606. doi: 10.1002/ stem.1296.
31. Lathia JD, Gallagher J, Myers JT et al. Direct in vivo evidence for tumor propagation by glioblastoma cancer stem cells. PLoS One 2011; 6(9): e24807. doi: 10.1371/ journal.pone.0024807.
32. Alison MR, Lim SM, Nicholson LJ. Cancer stem cells: problems for therapy? J Pathol 2011; 223(2): 147 – 161. doi: 10.1002/ path.2793.
33. Shaw FL, Harrison H, Spence K et al. A detailed mammosphere assay protocol for the quantification of breast stem cell activity. J Mammary Gland Biol Neoplasia 2012; 17(2): 111 – 117. doi: 10.1007/ s10911 - 012 - 9255 - 3.
34. Reynolds BA, Weiss S. Generation of neurons and astrocytes from isolated cells of the adult mammalian central nervous system. Science 1992; 255(5052): 1707 – 1710.
35. Dontu G, Wicha MS. Survival of mammary stem cells in suspension culture: implications for stem cell biology and neoplasia. J Mammary Gland Biol Neoplasia 2005; 10(1): 75 – 86.
36. Singh SK, Clarke ID, Terasaki M et al. Identification of a cancer stem cell in human brain tumors. Cancer Res 2003; 63(18): 5821 – 5828.
37. Tirino V, Desiderio V, d‘Aquino R et al. Detection and characterization of CD133+ cancer stem cells in human solid tumours. PLoS One 2008; 3(10): e3469. doi: 10.1371/ journal.pone.0003469.
38. Di Fiore R, Santulli A, Ferrante R et al. Identification and expansion of human osteosarcoma ‑ cancer ‑ stem cells by long‑term 3-aminobenzamide treatment. J Cell Physiol 2009; 219(2): 301 – 313. doi: 10.1002/ /jcp.21667.
39. Kanwar SS, Yu Y, Nautiyal J et al. The Wnt/ beta‑catenin pathway regulates growth and maintenance of colonospheres. Mol Cancer 2010; 9 : 212. doi: 10.1186/ 1476 - 4598 - 9 - 212.
40. Lee EK, Cho H, Kim CW. Proteomic analysis of cancer stem cells in human prostate cancer cells. Biochem Biophys Res Commun 2011; 412(2): 279 – 285. doi: 10.1016/ j.bbrc.2011.07.083.
41. Cao L, Zhou Y, Zhai B et al. Sphere‑forming cell subpopulations with cancer stem cell properties in human hepatoma cell lines. BMC Gastroenterol 2011; 11 : 71. doi: 10.1186/ 1471 - 230X ‑ 11 - 71.
42. Ye J, Wu D, Shen J et al. Enrichment of colorectal cancer stem cells through epithelial ‑ mesenchymal transition via CDH1 knockdown. Mol Med Rep 2012; 6(3): 507 – 512. doi: 10.3892/ mmr.2012.938.
43. Yang M, Yan M, Zhang R et al. Side population cells isolated from human osteosarcoma are enriched with tumor ‑ initiating cells. Cancer Sci 2011; 102(10): 1774 – 1781. doi: 10.1111/ j.1349 - 7006.2011.02028.x.
44. Fedr R, Pernicová Z, Slabáková E et al. Automatic cell cloning assay for determining the clonogenic capacity of cancer and cancer stem‑like cells. Cytometry A 2013; 83(5): 472 – 482. doi: 10.1002/ cyto.a.22273.
45. Wylie PG, Bowen WP. Determination of cell colony formation in a high‑content screening assay. Clin Lab Med 2007; 27(1): 193 – 199.
46. Bunting KD. ABC transporters as phenotypic markers and functional regulators of stem cells. Stem Cells 2002; 20(1): 11 – 20.
47. Dean M. ABC transporters, drug resistance, and cancer stem cells. J Mammary Gland Biol Neoplasia 2009; 14(1): 3 – 9. doi: 10.1007/ s10911 - 009 - 9109 - 9.
48. Veselska R, Skoda J, Neradil J. Detection of cancer stem cell markers in sarcomas. Klin Onkol 2012; 25 (Suppl 2): 2S16 – 2S20.
49. Mayol JF, Loeuillet C, Hérodin F et al. Characterisation of normal and cancer stem cells: one experimental paradigm for two kinds of stem cells. Bioessays 2009; 31(9): 993 – 1001. doi: 10.1002/ bies.200900041.
50. Hiraga T, Ito S, Nakamura H. Side population in MDA ‑ MB ‑ 231 human breast cancer cells exhibits cancer stem cell‑like properties without higher bone ‑ metastatic potential. Oncol Rep 2011; 25(1): 289 – 296.
51. Fillmore CM, Kuperwasser C. Human breast cancer cell lines contain stem‑like cells that self ‑ renew, give rise to phenotypically diverse progeny and survive chemotherapy. Breast Cancer Res 2008; 10(2): R25. doi: 10.1186/ bcr1982.
52. Dembinski JL, Krauss S. Characterization and functional analysis of a slow cycling stem cell‑like subpopulation in pancreas adenocarcinoma. Clin Exp Metastasis 2009; 26(7): 611 – 623. doi: 10.1007/ s10585 - 009 - 9260 - 0.
53. Roesch A, Fukunaga ‑ Kalabis M, Schmidt EC et al. A temporarily distinct subpopulation of slow ‑ cycling melanoma cells is required for continuous tumor growth. Cell 2010; 141(4): 583 – 594. doi: 10.1016/ j.cell.2010.04.020.
54. McDonald SA, Graham TA, Schier S et al. Stem cells and solid cancers. Virchows Arch 2009; 455(1): 1 – 13. doi: 10.1007/ s00428 - 009 - 0783 - 1.
55. Lee JT, Herlyn M. Old disease, new culprit: tumor stem cells in cancer. J Cell Physiol 2007; 213(3): 603 – 609.
56. Deleyrolle LP, Harding A, Cato K et al. Evidence for label ‑ retaining tumour ‑ initiating cells in human glioblastoma. Brain 2011; 134(Pt 5): 1331 – 1343. doi: 10.1093/ brain/ awr081.
57. Willan PM, Farnie G. Application of stem cell assays for the characterization of cancer stem cells. In: Allan AL (ed.). Cancer stem cells in solid tumors. Springer 2011 : 259−282.
58. Alison MR, Murphy G, Leedham S. Stem cells and cancer: a deadly mix. Cell Tissue Res 2008; 331(1): 109 – 124.
59. Storms RW, Trujillo AP, Springer JB et al. Isolation of primitive human hematopoietic progenitors on the basis of aldehyde dehydrogenase activity. Proc Natl Acad Sci USA 1999; 96(16): 9118 – 9123.
Labels
Paediatric clinical oncology Surgery Clinical oncologyArticle was published in
Clinical Oncology

2014 Issue Supplementum
- Possibilities of Using Metamizole in the Treatment of Acute Primary Headaches
- Metamizole at a Glance and in Practice – Effective Non-Opioid Analgesic for All Ages
- Metamizole vs. Tramadol in Postoperative Analgesia
- Spasmolytic Effect of Metamizole
- Safety and Tolerance of Metamizole in Postoperative Analgesia in Children
-
All articles in this issue
- Programovaná buněčná smrt v nádorových buňkách
- Využití průtokové cytometrie pro analýzu mitochondriální buněčné smrti
- Metody studia buněčné migrace a invazivity nádorových buněk
- Možnosti studia transendoteliální migrace in vitro
- Mechanizmy lékové rezistence a nádorové kmenové buňky
- Funkční testy pro detekci nádorových kmenových buněk
- Mikroprostředí nádoru – možnosti výzkumu v podmínkách in vitro
- Elektrochemická analýza nukleových kyselin, bílkovin a polysacharidů v biomedicíně
- Sekvenování nové generace a možnosti jeho využití v onkologické praxi
- Vývoj metod založených na PCR a jejich aplikace v onkologickém výzkumu a praxi
- Metody pro studium protein‑proteinových a protein‑ligandových interakcí
- Analýza proteinů pomocí hmotnostní spektrometrie
- p‑ SRM, SWATH a HRM – cílené proteomické přístupy na hmotnostním spektrometru TripleTOF 5600+ a jejich aplikace v onkologickém výzkumu
- Analýza fosfoproteínov a signálnych dráh kvantitatívno‑ proteomickými metódami
- Nové trendy ve studiu glykosylace proteinů u onkologických onemocnění
- Současné trendy ve využívání PET radiofarmak k onkologické diagnostice
- „Techneciová krize“ – příčiny, možná řešení a dopad na diagnostiku planární scintigrafií a SPECT
- Vitamin D jako významný steroidní hormon u karcinomu prsu
- Detekce protein‑proteinových interakcí metodami FRET a BRET
- Detekce proteinů, proteinových interakcí a modifikací s využitím „proximity ligation assay“ in situ
- Exprese a purifikace proteinů
- Kvantitativní hmotnostní spektrometrie a její využití v onkologii
- Clinical Oncology
- Journal archive
- Current issue
- About the journal
Most read in this issue
- Exprese a purifikace proteinů
- Metody studia buněčné migrace a invazivity nádorových buněk
- Sekvenování nové generace a možnosti jeho využití v onkologické praxi
- Analýza proteinů pomocí hmotnostní spektrometrie
