Nové trendy ve studiu glykosylace proteinů u onkologických onemocnění
New Trends in the Study of Protein Glycosylation in Oncological Diseases
Glycomics and glycoproteomics represent relatively new directions in detail analyses of complex biological media. These areas of increasing importance to cancer research complement the more established genomic profiling and proteomics. Glycoproteins are being increasingly recognized as important in cellular interactions and adhesion. Structural alterations of their glycan moieties seem to occur in different cancer conditions. We review current directions in glycomic profiling and glycoproteomic investigations of biological fluids and tissues pertaining to cancer. The used methods rely on capillary separation techniques, mass spectrometry, and the glycan and lectin arrays. They all show considerable promise for new diagnostic and prognostic measurements.
Key words:
glycomics – glycopeptides – cancer – liquid chromatography – mass spectrometry – capillary electrophoresis – glycan profiling – array analysis
This work was supported by the European Regional Development Fund and the State Budget of the Czech Republic (RECAMO, CZ.1.05/2.1.00/03.0101) and by MH CZ – DRO (MMCI, 00209805).
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE “uniform requirements” for biomedical papers.
Submitted:
21. 3. 2014
Accepted:
10. 4. 2014
Authors:
M. Zahradníková; L. Hernychová; B. Vojtěšek; M. V. Novotný
Authors‘ workplace:
Regionální centrum aplikované molekulární onkologie, Masarykův onkologický ústav, Brno
Published in:
Klin Onkol 2014; 27(Supplementum): 121-128
Overview
Glykomika a glykoproteomika představují relativně nové směry pro analýzy komplexních biologických vzorků a jejich důležitost neustále roste. Tyto oblasti jsou komplementární k dalším zavedeným přístupům, např. ke genomickému profilování a proteomice. Glykoproteiny jsou stále více uznávány jako důležité molekuly účastnící se buněčných interakcí a adhezí. Výskyt strukturních změn v glykanových částech se zdá být typický pro různé typy rakoviny. Následující souhrn se zabývá aktuálními trendy v glykomickém profilování a glykoproteomickém výzkumu biologických tekutin a tkání se zaměřením na rakovinu. Použité metody jsou založeny na principech kapilárních separačních technik, hmotnostní spektrometrie a glykanových a lektinových čipů. Všechny zmíněné metody mají značný potenciál pro využití v diagnostických a prediktivních vyšetřeních.
Klíčová slova:
glykomika – glykopeptidy – rakovina – kapalinová chromatografie – hmotnostní spektrometrie – kapilární elektroforéza – glykanové profilování – čipové analýzy
Úvod
Biomolekuly obsahující sacharidy mají četné biologické funkce v různých buňkách [1]. V procesu známém jako glykosylace dochází k připojení sacharidových struktur k lipidům a proteinům za vzniku glykolipidů a glykoproteinů. Glykanové struktury dodávají biomolekulám vysoký stupeň strukturní diverzity a mnohostranné biologické funkce. Glykoproteiny a glykolipidy lokalizované na buněčné membráně se podílejí na buněčném rozpoznávání a adhezi, zatímco další proteiny, lokalizované uvnitř buňky nesoucí malé sacharidové jednotky se často zapojují v kaskádách signálních drah. S řadou proteinů, které jsou v buněčném prostoru glykosylovány, může dojít k různorodým změnám ve složení glykanové části za různých biologických okolností. Sacharidy jsou biosynteticky mnohostranné molekuly z hlediska jejich strukturních parametrů, jako je např. řetězení se či výskyt různých glykosidických vazeb. Hlavní funkce glykanů v buňce jsou znázorněny na obr. 1. Strukturní vlastnosti glykanů a jejich množství na povrchu membrány určují adhezní vlastnosti buněk založené na interakci sacharid ‑ protein a tyto vlastnosti mohou být změněny během onemocnění. Nádorové bujení a metastatické procesy by tedy alespoň částečně mohly být vysvětleny těmito biomolekulárními interakcemi a procesy.
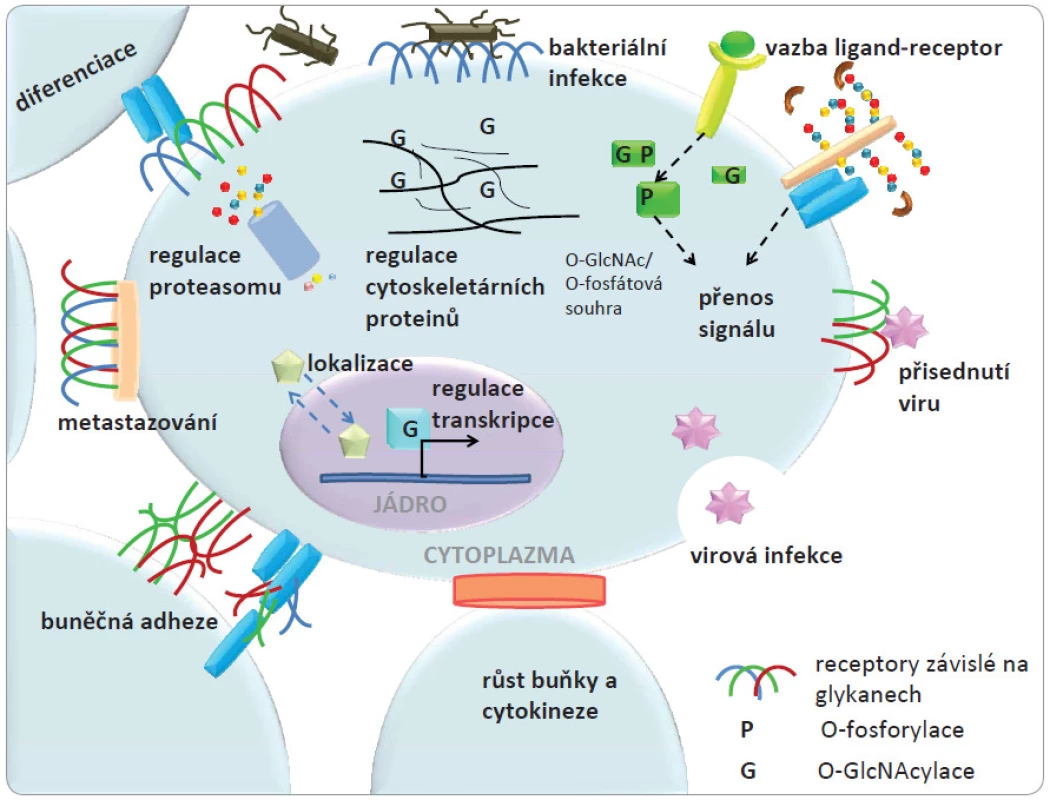
Studiem biologických procesů na buněčné a molekulární úrovni, do nichž jsou zapojeny sacharidy, se zabývá glykobiologie. Již před mnoha desítkami let bylo pozorováno spojení mezi rakovinou a glykosylovanými strukturami třeba v rozdílné aglutinaci normálních a nádorových buněk [2]. Význam glykosylace u rakoviny je v poslední době intenzivně zkoumán [3 – 6] s ohledem na pokročilé strukturní znalosti studovaných systémů. I když dřívější studie glykosylace poukázaly na její vztah k rakovině a zjevný význam i potenciál pro využití v onkologickém výzkumu a praxi, dřívější práce byly omezeny na poměrně malý počet specializovaných laboratoří. Hlavní důvod této situace byly metodologické problémy při identifikaci aberantních glykokonjugátů a jejich měření s vysokou citlivostí. Další komplikací byla komplexnost a neznalost procesu, kterým je biosyntéza glykanů řízena. Nicméně s rychlým pokrokem v rámci „omics“ vyvíjených technologií jsou v současné době rozvíjeny oblasti glykoproteomiky zabývající se studiem glykokonjugátů např. glykoproteinů, glykolipidů a glykomiky, která se zaměřuje na studium sacharidových složek [7,8]. Tyto pokročilé techniky se stále více uplatňují při řešení řady otázek týkajících se dalšího rozvoje výzkumu rakoviny.
Metodické pokroky ve výzkumu glykobiologie byly v poslední době zhodnoceny Národní radou pro výzkum ve zprávě pro americkou vládu [9]. Zpráva obsahuje naléhavé sdělení vybízející ke koordinaci výzkumných pracovišť v této oblasti, neboť glykokonjugáty hrají rozhodující roli v mnoha oblastech lidského zdraví, včetně zánětlivých onemocnění a rakoviny. Předpokládá se, že výsledky současného výzkumu v nádorové glykobiologii přinesou identifikaci nových biomarkerů vhodných nejen pro včasnou diagnostiku a prognostiku onemocnění, ale také pro potenciální vývoj nových farmaceutických přístupů k léčbě onemocnění.
Tento článek hodnotí současné pokroky v glykomice a glykoproteomice zaměřené na hledání biomarkerů rakoviny a poukazuje na rozdíly v expresi sacharidových struktur, které mohou pomoci rozlišit nádorové buňky od normálních. Hlubší poznatky o glykomu rakoviny mohou rovněž vést k novým způsobům léčby [10].
Současné pokroky v systémové glykobiologii
Biologické vzorky, jako je krevní sérum, cystická tekutina, tkáňové buňky atd., jsou typické materiály použité pro klinicky relevantní měření i pro výzkum nových nádorových biomarkerů. Jsou zdrojem proteinů a různých metabolických produktů přítomných ve velmi rozdílných koncentracích a formách. Při těchto typech analýz však vyvstávají následující otázky, na něž současná věda hledá odpovědi. Které složky jsou ale nejvhodnější pro diagnostiku a prognostiku? Jsou specifické pro různé typy nádorů a stadium jejich progrese? Jak těžké je bude analyzovat?
I když je již prokázáno, že nádorové buňky se vyznačují neobvyklými typy glykosylací, není známo, jakým způsobem se to projeví v biologických tekutinách. Současný výzkum ukázal některé rozdíly na úrovni glykoproteinů – tvorbě glykanů v různých typech nádorů [11 – 15]. Nicméně není stále jasné, které proteiny nesou tyto modifikace, protože ve výše uvedených studiích byly měřeny glykany, jež byly enzymaticky nebo chemicky odštěpeny z biologických vzorků. Není také zatím ověřeno, zda mohou mít naměřené rozdíly v glykomických profilech nádorové tkáně nebo okolní tkáně či některých glykoproteinech přítomných v oběhovém systému souvislost s imunitní odpovědí organizmu anebo s procesem zánětlivé či akutní fáze. Přesná glykomická měření tedy představují první krok ve strategii glykoproteomického výzkumu, jehož cílem je identifikace a strukturní charakterizace biomarkerů z řad molekul glykoproteinů.
Všechny rychle se rozvíjející „omics“ přístupy poskytují komplexní analytická data, která musí být v konečném důsledku redukována a srozumitelně interpretována, aby v tomto směru umožnila vývoj jednoduchých detekčních postupů přijatelných pro použití v klinické praxi. Na druhé straně zpracování takových dat vyžaduje výkonné výpočetní nástroje (bioinformatiku) a jejich vývoj v oblasti glykomiky a glykoproteomiky je taktéž centrem mezinárodního úsilí [16]. Analytické postupy glykomiky a glykoproteomiky, podrobněji popsané níže, jsou primárně založeny na metodách kapilární kapalinové chromatografie, kapilární elektroforézy a různých typů hmotnostní spektrometrie. Společně představují účinný přístup pro analýzu komplexních biologických směsí umožňující odhalit rozdíly na molekulární úrovni mezi fyziologickou a patologickou homeostázou. Biochemická individualita různých pacientů [17] spojená se statisticky významnými rozdíly ve složité struktuře proteinů či metabolitů měřených ve vzorcích získaných od různých jedinců musí být statisticky vyhodnocena v duchu systémové biologie, aby mohly být získány onkologicky relevantní informace z extrémně komplexního pozadí, z tzv. biologického šumu. Statistické hodnocení definovaných skupin může pomoci vytvořit charakteristické „glykorysy“ nebo vzory kvantitativně odlišných glykanů v rámci strukturní skupiny (v závislosti na substituci sacharidu či jeho větvení, vazby atd.).
Jestliže glykany s příslušnou strukturou nebo typem struktury mohou samy o sobě poskytovat diagnosticky důležité informace, je zároveň rozumné zvážit jejich strukturní a/ nebo funkční vztahy k jejich vazebným proteinovým partnerům. Stejně jako je dnes jasné, že v sérech pacientů s rakovinou jsou přítomny protilátky, které se mohou vázat ke glykanům a některým glykoproteinům [18], pak i detekce anti‑rakovinných glykokonjugátových protilátek v sérech pacientů může být v budoucnosti důležitá pro diagnostické a prognostické metody. Populární aplikací těchto principů jsou glykanové čipy [19,20], o kterých bude pojednáno později.
Na rozdíl od biologických mechanizmů, které udávají strukturu, funkci a informační obsah nukleových kyselin a proteinů, je biosyntéza glykanů komplexní beztemplátový proces, ve kterém počet a enzymatická aktivita glykosyltransferáz a glykosylhydroláz (lokalizovaných v různých specifických buněčných organelách) mohou vzájemně spolupracovat. I když mnohé geny související s glykany byly důkladně prostudovány [21], mnohem obsáhlejší informace o glykomu (souhrn glykanových struktur v proteomu) byly získány ze současných studií. Ve světle dnešních vědomostí o nádorové glykobiologii [22,23] je nutné zvážit i provedení dalších rozsáhlých transkriptomových profilování.
Význam glykosylovaných struktur v mnohých složitých funkcích imunitního systému je v současnosti poměrně dobře znám [24,25]. Různé typy buněk nesoucí glykoproteiny s N ‑ a O‑vázanými glykany se účastní přirozené i adaptivní imunity, významné změny ve struktuře oligosacharidů jsou spojeny s buněčnou diferenciací, aktivací a smrtí. Buněčné rozpoznávání a vazba klíčových proteinů (známých jako „siglecs“ – imunoglobulin typu lektin vázající sialovou kyselinu, lektiny C ‑ typu a galektiny) zahrnují změny v sialylaci a fukosylaci v imunologicky aktivních buňkách. Zatímco zánět, rakovina a imunologické procesy jsou propojeny v soubor komplexních molekulárních a buněčných interakcí [26], monitorování hladin glykanů a/ nebo klíčových glykopeptidů v tělních tekutinách je stále významné pro molekulární onkologii. Glykanové profilování a glykoproteomický výzkum tak doplňují zavedené „omics“ přístupy, jako je genomika, proteomika a metabolomika, a společně s interaktivním využitím glykoproteomiky a bioinformatických nástrojů systémové biologie představují značný potenciál pro výzkum rakoviny.
Glykomické profilování biologických tekutin a tkání
Záměrem glykomického profilování je zobrazit co nejvíce strukturně odlišných glykanových typů a změřit jejich relativní koncentrace v biologických vzorcích. To je v současnosti relativně jednoduchý úkol, pokud je vzorkem izolovaný glykoprotein. Jedná‑li se ovšem o měření glykanových profilů ve směsi glykoproteinů, např. krevní sérum nebo plazmatických proteinů, jde o úkol technicky mnohem náročnější. A to zejména pokud jde o velmi citlivé měření (nižší než pikomolární množství), neboť standardní obsah glykoproteinů v séru je odhadován přibližně na 1 % [27]. Před vlastní analýzou (kapalinová chromatografie, hmotnostní spektrometrie nebo kapilární elektroforéza) musí být glykany uvolněny a extrahovány z příslušných proteinů a separovány od ostatních interferujících látek. Selektivita a citlivost dalších měření jsou často zvyšovány vhodnou mikrochemickou modifikací glykanových analytů. Zatímco doposud nebyly vyvinuty žádné obecné protokoly týkající se glykomického profilování, předními glykobiologickými laboratořemi jsou publikovány pouze vlastní metody (jejich přehled je uveden v [28]). Profilování N ‑ glykanů a O ‑ glykanů se liší typem uvolňování glykanů z proteinů – enzymatické štěpení se používá pro N ‑ glykany, zatímco O ‑ glykany vyžadují uvolnění pomocí mikrochemických postupů. V praxi se komparativní glykomické profilování s vyhodnocování dat od zdravých a nemocných příliš neliší od jiných přístupů používaných v systémové biologii a „omics“ technikách. Glykomika má několik výhod ve srovnání s proteomikou – „užší“ dynamické rozpětí koncentrací (~103 u glykomiky a 106 – 1010 u proteomiky) a rychlejší analytické postupy s možností sestavení do multiplexu, ve kterém lze sledovat více signálů najednou. Při komparativních studiích nádorových biomarkerů je však nezbytné zajistit reprodukovatelnost ve všech jednotlivých analytických krocích: 1. uvolnění glykanů, 2. extrakce a purifikace, 3. derivatizace a 4. vlastní profilovací měření. Derivatizace glykanů spočívá v nahrazení vodíků za metylové skupiny, což je velmi výhodné pro měření na hmotnostních spektrometrech, kde takto upravené glykany snadněji ionizují.
Tři hlavní přístupy jsou používány v glykomickém profilování: 1. hmotnostní spektrometrie (mass spectrometry – MS), 2. kapalinová chromatografie (liquid chromatography – LC) s fluorescenční detekcí a 3. kapilární elektroforéza (capillary electrophoresis – CE) s laserově indukovanou fluorescenční detekcí. MS analýza může nebo nemusí používat derivatizaci vzorků, i když bylo mnohokrát prokázáno, že permetylace na pevné fázi [29] přináší jasné výhody co do zvýšené citlivosti a zahrnutí neutrálních i kyselých glykanových struktur v jednom analytickém měření. Různé detekční strategie pro LC a CE využívají mikrochemické navázání fluoroforu ke glykanům, které jinak neobsahují jednoduše detekovatelné motivy ve svých molekulách. Prostřednictvím rozlišení glykanů v čase a prostoru mohou některé LC a CE přístupy rozlišit glykanové izomery, např. u izomerické sialylace a fukosylace, což se zdá být velmi důležité při objevování nádorových biomarkerů. V současné době je značně náročné rozlišit glykanové izomery použitím technik založených pouze na MS.
Důležité kritérium při výběru metody pro glykanové profilování je počet profilových komponent, které mohou být pravidelně monitorovány s dobrou citlivostí a reprodukovatelností. Zatímco LC/ fluorescenční detekce je široce a úspěšně používána na mnohých vzorcích v rámci studií týkajících se dědičnosti a chorob v různých lidských populacích [30,31], všeobecný postup profilování je omezen na hlavní glykany uvolněné z imunoglobulinů a jiných proteinů přítomných v lidském séru ve vyšších koncentracích. Tyto glykany pak musí být strukturně ověřeny pomocí MS. Naopak metody založené na MS principech mohou změřit okolo 100 glykanových struktur a identifikovat je z jejich charakteristických spekter [7]. Pomocí nejpokročilejších CE postupů je možno rutinně monitorovat podobné množství glykanů, i když ještě ne všechny profily glykanových komponent byly pozitivně identifikovány.
Ve studiích rakoviny bylo glykomické profilování založené na MS s využitím ionizace/ desorpce laserem za přítomnosti matrice (matrix ‑ assisted laser desorption ‑ ionization – MALDI) úspěšně aplikováno při studiu glykanových směsí z metastatických karcinomů prostaty [11]. Ukázalo se rovněž být slibným přístupem při určení stadia nádorového onemocnění mléčné žlázy [32] a zvýraznilo další glykanové profily u rakoviny jícnu [33], jater [12,34], vaječníků [13], plic [14] a tlustého střeva [15]. Příklady glykanového profilování vzorků sér pocházejících od pacientek s nádorem vaječníků založeného na MALDI/ MS jsou znázorněny na obr. 2, 3.
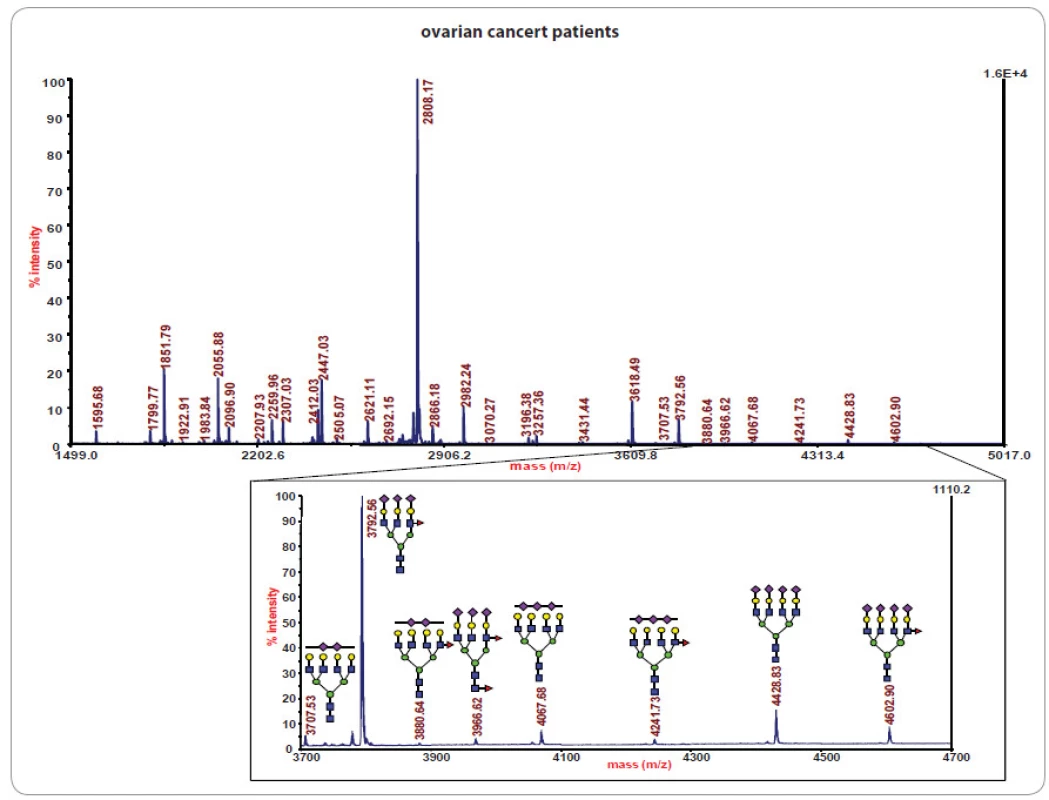
![Statistická analýza N-vázaných tříantenních glykanů přítomných v sérech pacientek s rakovinou vaječníků, pacientek se stejným onemocněním po chemoterapii a s kontrolními jedinci. Převzato z [13].](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/c0ceba755b75582447bc0f4a326ab853.jpg)
I když jsou vzorky sér jednotlivých pacientek profilované, kvantifikované a normalizované pomocí standardů, každý normalizovaný profil reprezentuje určitý vzor (příklad je uveden na obr. 2), který je statisticky porovnáván s jinými záznamy dané skupiny a séry z kontrolní skupiny bez diagnostikovaného zkoumaného onemocnění u stejného věku pacientů. Glykanové vzory jsou následně statisticky hodnoceny pomocí chemometrických postupů, např. analýza hlavních komponent a náhodná strategie vzorků s rekurzivním výběrem funkce založeným na podpůrných vektorových přístrojích [35]. Vybrané komponenty nebo skupiny glykanů mohou být pro jednotlivé skupiny pacientů dále evaluovány pomocí statisticky relevantních kritérií společných pro klinické laboratoře, např. p ‑ hodnoty nebo ROC analýza (receiver operating characteristic AUC). To ilustruje obr. 3 v rámci srovnání skupin 19 pacientek s rakovinou vaječníků, 11 pacientek se stejným onemocněním po chemoterapii [13] a 20 kontrolními jedinci. Srovnání na obr. 3 se vztahuje na N ‑ vázané tříantenní glykany, které odlišují zdravé jedince od pacientek s rakovinou. Vložený výřez spektra v obr. 2 ukazuje struktury považované za významné z hlediska rozdělení skupin pacientů.
V různých profilovacích studiích (mikročipová CE s laserově indukovanou fluorescenční detekcí) sér pacientek s rakovinou vaječníků [36] byl rovněž prokázán význam použití počítačových technik pro rozeznávání vzorů při práci s komplexními daty (obr. 4). V tomto případě glykanové mapy založené na CE se celkem zřetelně seskupují do odlišných kohortních skupin. Postupy založené na CE mikročipech tak vykazují značný potenciál pro budoucí klinické využití.
![PCA statistické vyhodnocení glykanových map získaných po separaci kapilární elektroforézou umožňuje rozdělení vzorků do odlišných kohortních skupin (stejné skupiny pacientek a kontrol jako u obr. 3). Převzato z [13].](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/bad3dc09823c88f1a5b506ae8ae3f332.jpg)
Přestože je většina aplikací glykomiky ve výzkumu rakoviny založena na analýze malých objemů krevního séra nebo plazmy (často jde o vzorky s objemem 1 µl), může být glykomické profilování aplikováno také na jiné biologické materiály, např. tekutiny z cyst [37] nebo buněčné nádorové linie [38], je však potřeba modifikovat protokol extrakce.
Obohacovací techniky a glykoproteomické přístupy
Je známo, že glykosylační profily se významně mění při ontogenezi, třeba zvýšená aktivita N ‑ acetylglukosaminyltransferázy V (enzym zodpovědný za tvorbu větvených N ‑ vázaných glykanů) bývá spojována s nádorovou invazí a metastazováním určitých typů nádorů [39]. Předpokládá se, že glykoproteiny vylučované nádory mohou být použity jako potenciální diagnostické markery. Jeden z nejlépe definovaných biomarkerů rakoviny je PSA (prostatický specifický antigen), glykoprotein s jedním definovaným N ‑ vázaným místem glykanové substituce, jež je primárně vylučován prostatickými epiteliálními buňkami do semenné plazmy. Bylo prokázáno, že glykanová část u zdravých jedinců a pacientů s diagnostikovanou rakovinou prostaty se liší [40]. Nádorově specifické změny glykanových struktur by mohly být dále využity pro nádorovou imunoterapii. Za příklad může posloužit jejich použití jako epitopů pro terapeutické monoklonální protilátky [41]. Významnou měrou se na získávání nových poznatků podílejí metodiky obohacení vzorku o glykoproteiny, které se opírají o tři základní přístupy: 1. chemické metody, 2. lektinovou afinitní chromatografii a 3. adsorpci na modifikovaný křemenný povrch [42].
Chemické metody jsou prezentovány dvěma přístupy: 1. hydrazidovou chemií a 2. chemií kyseliny borité. Oba přístupy využívají přítomnosti cis‑diolů v monosacharidech. Metodika hydrazidové chemie spočívá v oxidaci NaIO4 cis‑diolů na aldehydy, na které jsou následně kovalentně vázány funkční partikule s hydrazidovou skupinou. Takto označené glykoproteiny jsou pak in situ štěpeny trypsinem, zatímco neglykosylované i nenavázané proteiny jsou promytím odstraněny. Posledním krokem je uvolnění proteinové části glykoproteinu pomocí enzymu PNGasy F a analýza na LC ‑ MS/ MS. Metodika kyseliny borité je založena na její schopnosti vytvářet heterocyklické diestery pro kovalentní zachycení glykoproteinů následované elucí okyselením [43].
S využitím hydrazidové chemie byly analyzovány vzorky pleurálního výpotku pacientů s rakovinou plic. I přes nízké koncentrační rozmezí proteinů, které se pohybovalo v řádech µg/ ml až ng/ ml, se podařilo identifikovat několik proteinů (např. CA ‑ 125, CD44 nebo CD166) spojených s progresí nádoru nebo jeho schopností metastazovat [44].
Lektiny představují širokou skupinu proteinů velmi specificky se vázajících na vybrané monosacharidové zbytky nebo jejich funkční skupiny [45]. Princip lektinové afinitní chromatografie spočívá v zakotvení vybraných lektinů na pevný nosič, kterým může být agaróza, magnetické partikule, čipy, silika a další materiály [46], a následné separaci glykanů z komplexní biologické směsi. Řada současných studií prokázala, že glykoproteiny ovlivňující nádorová onemocnění mohou být identifikovány přímo ze séra nebo z plazmy. Při srovnávací studii glykosylačního profilu jedinců s adenokarcinomem plic a zdravých kontrol bylo pomocí lektinů z obilných klíčků (wheat germ agglutinin – WGA) z odebraných sér identifikováno 39 glykoproteinů vykazujících rozdílné zastoupení mezi sledovanými skupinami. Byly nalezeny tři glykoproteiny ve zvýšené koncentraci (adiponektin, ceruloplasmin a glykofosfatidyl ‑ inositol ‑ 80) a dva glykoproteiny ve snížené koncentraci (cyclin H a Fyt) přímo související s vývojem adenokarcinomu plic, které by mohly být užitečné pro včasnou detekci onemocnění nebo sledování jeho progrese [47].
Pomocí vhodně zacílené lektinové extrakce byly identifikovány hyper‑fukosylované proteiny, např. hemopoexin [48], využitelné v diagnostice onemocnění. Třetí přístup vhodný pro účely glykoproteomiky je použití komerčně vyráběných mikrokolon Nukleosil 4000 - 7 (Macherey ‑ Nagel GmbH & Co., Germany), které fungují na principu aniontového výměníku pro separaci proteinů a peptidů. Vhodnost mikrokolon je dána především chemickou inertností vůči zkoumanému vzorku (nedochází k nespecifické adsorpci jiných proteinů), kompaktností při užití HPLC (high performance liquid chromatography) a v neposlední řadě i velkým poměrem povrchu k objemu i pevností SiO2 [49].
Čipové technologie
V mnoha oblastech biologie a medicíny je důležité pochopení interakcí glykan ‑ protein. K tomu slouží glykanové mikročipy, které na svém povrchu nesou ucelené sety (knihovny) glykanů [50 – 52]. Formát mikročipů umožňuje rychlou a simultánní analýzu afinity glykan ‑ protein velkého množství odvozených glykanových struktur. Při použití tohoto přístupu mohou být stovky syntetických glykanů vloženy a imobilizovány na mikročipech a poté použity pro mapování glykoproteinů v biologických materiálech včetně detekce anti‑glykanových protilátek v séru. K imobilizaci mohou alternativně posloužit i glykany izolované z přírodních zdrojů. Pak probíhá nejčastěji detekce fluorescenčně značených proteinů vázaných na povrchu terčíků s následnou kvantifikací fluorescenčním skenerem. Různé charakteristiky glykanových čipů, včetně konstrukčních prvků, typů povrchů a metod imobilizace, byly v literatuře již prodiskutovány [53 – 55]. Využití glykanových čipů představuje velký potenciál pro sérologickou detekci nádoru. Je však zřejmé, že komplexní data získaná z proteinových interakcí vyžadují použití sofistikovaných výpočetních nástrojů a algoritmů [56,57].
Lektinové čipy představují další variantu čipové technologie vhodné pro mapování biologických vzorků na přítomnost glykanových epitopů. Bylo prokázáno, že lektiny získané z rostlin vykazují vyšší selektivitu a vazebnou afinitu k určitým typům glykanů než lektiny rekombinantní. Pouze několik málo lektinů bylo uvedeno v článku z roku 2005 [58], avšak technologický pokrok [59] umožňuje podstatně zvýšit počet dostupných lektinů a v nedávno uveřejněných publikacích byly popsány aplikace lektinových čipů i ve výzkumu rakoviny [60,61]. V nejbližší budoucnosti se předpokládá dostupnost lektinů s lepšími specificitami. Mohou to být rekombinantní proteiny a anti‑glykanové protilátky, které více zpřístupní lektinové čipy a jejich širší aplikaci. Podobně i glykanové čipy jsou většinou limitovány dostupností syntetických glykanů, i když nedávné pokroky v syntéze sacharidů [62] a optimalizace purifikace neobvyklých glykanů z biologických zdrojů [63] mohou výrazně obohatit využití současných čipových postupů.
Závěr
Metody systémové biologie přispívají k objasnění původu lidských nemocí včetně rakoviny. Informace získané z různých studií vedou k vývoji diagnostiky, prognostiky a nových strategií léčby. Relativně nedávné poznatky ve výzkumu rakoviny jsou velkou měrou založeny na genomických a proteomických postupech, glykomických a glykoproteomických měřeních a vykazují značný potenciál pro budoucí směr bádání. I když se v oblasti glykoproteomiky a glykomiky vyskytuje celá řada metodologických problémů, doposud dosažené výsledky naznačují značný potenciál při léčbě některých typů rakoviny.
Poděkování patří Mgr. Evě Michalové a Mgr. Marianě Pjechové za textové korekce.
Práce byla podpořena Evropským fondem pro regionální rozvoj a státním rozpočtem České republiky (OP VaVpI – RECAMO, CZ.1.05/2.1.00/03.0101) a MZ ČR – RVO (MOÚ, 00209805).
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
prof. RNDr. Miloš V. Novotný, DrSc.
Regionální centrum aplikované molekulární onkologie
Masarykův onkologický ústav
Žlutý kopec 7
656 53 Brno
e-mail: milos.novotny@mou.cz
Obdrženo: 21. 3. 2014
Přijato: 10. 4. 2014
Sources
1. Hart GW, Copeland RJ. Glycomics hits the big time. Cell 2010; 143(5): 672 – 676. doi: 10.1016/ j.cell.2010.11.008.
2. Aub JC, Sanford BH, Cote MN. Studies on reactivity of tumor and normal cells to a wheat agglutin. Proc Natl Acad Sci USA 1965; 54(2): 396 – 399.
3. Hakomori S. Glycosylation defining cancer malignancy; new wine in an old bottle. Proc Natl Acad Sci USA 2002; 99(16): 10231 – 10233.
4. Kobata A, Amano J. Altered glycosylation of proteins produced by malignant cells, and applications for the diagnosis and immunotherapy of tumors. Immunol Cell Biol 2005; 83(4): 429 – 439.
5. Ørntoft TF, Vestergaard EM. Clinical aspects of altered glycosylation of glycoproteins in cancer. Electrophoresis 1999; 20(2): 362 – 371.
6. Taniguchi N. Human disease glycomics/ proteome initiative (HGPI). Mol Cell Prot 2008; 7(3): 626 – 627.
7. Novotny MV, Alley WR Jr, Mann BF. Analytical glycobiology at high sensitivity: current approaches and directions. Glycoconjugate J 2013; 30(2): 89 – 117. doi: 10.1007/ s10719 - 012-9444 - 8.
8. Novotny MV, Alley WR Jr. Recent trends in analytical and structural glycobiology. Curr Opin Chem Biol 2013; 17(5): 832 – 841. doi: 10.1016/ j.cbpa.2013.05.029.
9. National Research Council (US) Committee on Assessing the Importance and Impact of Glycomics and Glycosciences (eds). Transforming glycoscience: a roadmap for the future [monograph on the Internet]. Washington (DC): National Academies Press (US); 2012 [cited 2014 January 17]. Available from: http:/ / www.ncbi.nlm.nih.gov/ books/ NBK109958/ .
10. Hudak JS, Bertozzi CR. New advances inspire a reemergance of glycans in medicine. Chemistry Biology 2014; 21 : 16 – 37. doi: 10.1016/ j.chembiol.2013.09.010.
11. Kyselova Z, Mechref Y, Al Bataineh M et al. Alterations in the serum glycome due to metastatic prostate cancer. J Proteome Res 2007; 6(5): 1822 – 1832.
12. Ressom HW, Varghese RS, Goldman L et al. Analysis of MALDI ‑ TOF mass spectrometry data for discovery of peptide and glycan biomarkers of hepatocellular carcinoma. J Proteome Res 2008; 7(2): 603 – 610. doi: 10.1021/ pr0705237.
13. Alley WR Jr, Vasseur JA, Goetz JA et al. N‑linked glycan structures and their expressions change in the blood sera of ovarian cancer patients. J Proteome Res 2012; 11(4): 2282 – 2300. doi: 10.1021/ pr201070k.
14. Vasseur JA, Goetz JA, Alley WR Jr et al. Smoking and lung cancer‑induced changes in N ‑ glycosylation of blood serum proteins. Glycobiology 2012; 22(12): 1684 – 1708. doi: 10.1093/ glycob/ cws108.
15. Alley WR Jr, Svoboda M, Goetz JA et al. Glycomic analysis of sera derived from colorectal cancer patients reveals increased fucosylation of highly branched glycans. In press 2014.
16. Hicks MG, Kettner C (eds). Glyco ‑ bioinformatics: cracking the sugar code by navigating the glycospace. Frankfurt: Logos ‑ Verlag 2012.
17. Novotny MV, Soini HA, Mechref Y. Biochemical individuality reflected in chromatographic, electrophoretic and mass ‑ spectrometric profiles. J Chromatogr B 2008; 866(1 – 2): 26 – 47.
18. Volmers HP, Brädlein S. Natural antibodies and cancer. J Autoimm 2007; 29(4): 295 – 302.
19. Bovin N, Obukhova P, Shilova N et al. Repertoire of human natural anti‑glycan immunoglobulins. Do we have auto ‑ antibodies? Biochim Biophys Acta 2012; 1820(9): 1373 – 1382.
20. Rillahan CD, Paulson JC. Glycan microarrays for decoding glycome. Annu Rev Biochem 2011; 80 : 797 – 823. doi: 10.1146/ annurev ‑ biochem ‑ 061809 - 152236.
21. Taniguchi N, Honke K, Fukuda M (eds). Handbook of glycosyltransferases and related genes, Tokyo: Springer ‑ Verlag 2002.
22. Nairn AV, York WS, Harris K et al. Regulation of glycan structures in animal tissues. Transcript profiling of glycan‑related genes. J Biol Chem 2008; 283(25): 17298 – 17313. doi: 10.1074/ jbc.M801964200.
23. Nairn AV, Moremen KW. Glycotranscriptomics. In: Cummings RD, Pierce JM (eds). Handbook of glycomics. New York: Academic Press/ Elsevier 2009 : 95 – 135.
24. Redelinghuys P, Crocker PR. Glycomics of the immune systems. In: Cummings RD, Pierce JM (eds). Handbook of glycomics. New York: Academic Press/ Elsevier 2009 : 237 – 261.
25. Kolarich D, Lepenies B, Seeberger PH. Glycomics, glycoproteomics and the immune system. Curr Opin Chem Biol 2012; 16(1 – 2): 214 – 220. doi: 10.1016/ j.cbpa.2011.12.006.
26. Grivennikov SI, Greten FR, Karin M. Immunity, inflammation, and cancer. Cell 2010; 140(6): 883 – 899. doi: 10.1016/ j.cell.2010.01.025.
27. Narimatsu H, Sawaki H, Kuni A et al. A strategy for discovery of cancer glycol ‑ biomarkers in serum using newly developed technologies for glycoproteomics. FEBS J 2009; 277(1): 95 – 105. doi: 10.1111/ j.1742 - 4658.2009.07430.x.
28. Alley WR Jr, Mann BF, Novotny MV. High‑sensitivity analytical approaches for the structural characterization of glycoconjugates. Chem Rev 2013; 113(4): 2668 – 2732. doi: 10.1021/ cr3003714.
29. Alley WR Jr, Madera M, Mechref Y et al. Chip‑based reversed ‑ phase liquid chromatography‑mass spectrometry of permethylated glycans: a potential methodology for cancer ‑ biomarker discovery. Anal Chem 2010; 82(12): 5095 – 5106. doi: 10.1021/ ac100131e.
30. Knezevic A, Gornik O, Polasek O et al. Effects of aging, body mass index, plasma lipid profiles, and smoking on human plasma N ‑ glycans. Glycobiol 2010; 20(8): 959 – 969. doi: 10.1093/ glycob/ cwq051.
31. Lauc G, Essafi A, Huffman JE et al. Genomics meets glycomics – the first GWAS study of human N ‑ Glycome identifies HNFIa as a master regulator of plasma protein fucosylation. PLoS Genet 2010; 6(12): e1001256. doi: 10.1371/ journal.pgen.1001256.
32. Kyselova Z, Mechref Y, Kang P et al. Breast cancer diagnosis and prognosis through quantitative measurements of serum glycan profiles. Clin Chem 2008; 54(7): 1166 – 1175. doi: 10.1373/ clinchem.2007.087148.
33. Mechref Y, Hussein A, Bekesova S et al. Quantitative serum glycomics of esophageal adenocarcinoma and other esophageal disease onsets. J Proteome Res 2009; 8(6): 2656 – 2666. doi: 10.1021/ pr8008385.
34. Kang P, Madera M, Alley WR Jr et al. Glycomic alterations in the highly ‑ abundant and lesser ‑ abundant blood serum protein fractions for patients diagnosed with hepatocellular carcinoma. Int J Mass Spectrom 2011; 305(2 – 3): 185 – 198.
35. Tang Z, Varghese RS, Bekesova S et al. Identification of N ‑ glycan serum markers associated with hepatocellular carcinoma from mass spectrometry data. J Proteome Res 2010; 9(1): 104 – 112. doi: 10.1021/ pr900397n.
36. Mitra I, Alley WR Jr, Goetz JA et al. Comparative profiling of N ‑ glycans isolated from serum samples of ovarian cancer patients and analyzed by microchip electrophoresis. J Proteome Res 2013; 12(10): 4490 – 4496. doi: 10.1021/ pr400549e.
37. Mann BF, Goetz JA, House MG et al. Glycomic and proteomic profiling of pancreatic cyst fluids identifies hyperfucosylated lactosamines on the N‑linked glycans of overexpressed glycoproteins. Mol Cell Proteomics 2012; 11(7): M111.015792. doi: 10.1074/ mcp.M111.015792.
38. Goetz JA, Mechref Y, Kang P et al. Glycomic profiling of invasive and non‑invasive breast cancer cells. Glycoconj J 2009; 26(2): 117 – 131. doi: 10.1007/ s10719 - 008 - 9170-4.
39. Siddiqui SF, Pawelek J, Handerson T et al. Coexpression of {beta}1,6 - N ‑ acetylglucosaminyltransferase V glycoprotein substrates defines aggressive breast cancers with poor outcome. Cancer Epidemiol Biomarkers Prev 2005; 14(11 Pt 1): 2517 – 2523.
40. Peracaula R, Tabares G, Royle L et al. Altered glycosylation pattern allows the distinction between prostate ‑ specific antigen (PSA) from normal and tumor origins. Glycobiology 2003; 13(6): 457 – 470.
41. Schietinger A, Philip M, Yoshida BA et al. A mutant chaperone converts a wild‑type protein into a tumor ‑ specific antigen. Science 2006; 314(5797): 304 – 308.
42. Wei X, Li L. Comparative glycoproteomics: approaches and applications. Brief Funct Genomics Proteomic 2009; 8(2): 104 – 113. doi: 10.1093/ bfgp/ eln053.
43. Drake M, Cho W, Li B et al. Sweetening the pot: adding glycosylation to the biomarker discovery equation. Clin Chem 2010; 56(2): 223 – 236. doi: 10.1373/ clinchem.2009.
44. Soltermann A, Ossola R, Kilgus ‑ Hawelski S et al. N ‑ glycoprotein profiling of lung adenocarcinoma pleural effusions by shotgun proteomics. Cancer 2008; 114(2): 124 – 133. doi: 10.1002/ cncr.23349.
45. Larkin A, Imperiali B. The expanding horizons of asparagine‑linked glycosylation. Biochemistry 2011; 50(21): 4411 – 4426. doi: 10.1021/ bi200346n.
46. Balonova L, Hernychova L, Bilkova Z et al. „Sladký“ svět bakterií: metodické přístupy využívané v analýze bakteriálních glykoproteinů. Vojenské zdravotnické listy 2010; 74(2): 54 – 59.
47. Hongsachart P, Huang ‑ Liu R, Sinchaikul S et al. Glycoproteomic analysis of WGA ‑ bound glycoprotein biomarkers in sera from patients with lung adenocarcinoma. Electrophoresis 2009; 30(7): 1206 – 1220. doi: 10.1002/ elps.200800405.
48. Tian Y, Zhang H. Glycoproteomics and clinical applications. Proteomics Clin Appl 2010; 4(2): 124 – 132. doi: 10.1002/ prca.200900161.
49. Svoboda M, Mann BF, Goetz JA et al. Examination of glycan profiles from IgG ‑ depleted human immunoglobulins facilitated by microscale affinity chromatography. Anal Chem 2012; 84(7): 3269 – 3277. doi: 10.1021/ ac203336u.
50. Fukui S, Feizi T, Galustian C et al. Oligosaccharide microarrays for high‑through ‑ out detection and specificity assignment of carbohydrate ‑ protein interactions. Nat Biotechnol 2002; 20(10): 1011 – 1017.
51. Houseman BT, Mrksich M. Carbohydrate arrays for the evaluation of protein binding and enzymatic modification. Chem Biol 2002; 9(4): 443 – 454.
52. Fazio F, Bryan MC, Blixt O et al. Synthesis of sugar arrays in microtiter plate. J Am Chem Soc 2002; 124(48): 14397 – 14402.
53. Rillahan CD, Paulson JC. Glycan microarrays for decoding the glycome. Annu Rev Biochem 2011; 80 : 797 – 823. doi: 10.1146/ annurev ‑ biochem ‑ 061809 - 152236.
54. Smith DF, Song X, Cummings RD. Use of glycan microarrays to explore specificity of glycan‑binding proteins. Methods Enzymol 2010; 480 : 417 – 444. doi: 10.1016/ S0076-6879(10)80033 - 3.
55. Liu Y, Palma AS, Feizi T. Carbohydrate microarrays: key developments in glycobiology. Biol Chem 2009; 390(7): 647 – 656. doi: 10.1515/ BC.2009.071.
56. Huflejt ME, Vuskovic M, Vasiliu D et al. Anti‑carbohydrate antibodies of normal sera: findings, surprises and challenges. Mol Immunol 2009; 46(15): 3037 – 3049. doi: 10.1016/ j.molimm.2009.06.010.
57. Vuskovic MI, Xu H, Bovin NV et al. Processing and analysis of serum antibody binding signals from Printed Glycan Arrays for diagnostic and prognostic applications. Int J Bioinf Res App 2011; 7(4): 402 – 426. doi: 10.1504/ IJBRA.2011.043771.
58. Kuno A, Uchiyama N, Koseki ‑ Kuno S et al. Evanescent ‑ field fluorescence ‑ assisted lectin microarray: a new strategy for glycan profiling. Nat Methods 2005; 2(11): 851 – 856.
59. Ribeiro JP, Mahal LK. Dot by dot: analyzing the glycome using lectin microarrays. Curr Opin Biol Chem 2013; 17(5): 827 – 831. doi: 10.1016/ j.cbpa.2013.06.009.
60. Bird ‑ Lieberman EL, Neves AA, Lao ‑ Sirieix P et al. Molecular imaging using fluorescent lectin permits rapid endoscopic identification of dysplasia in Barrett’s esophagus. Nat Med 2012 : 18(2): 315 – 321. doi: 10.1038/ nm.2616.
61. Gaziel ‑ Sovran A, Segura MF, Di Micco R et al. MiR ‑ 30b/ 30d regulation of GalNAc transferases enhances invasion and immunosuppression during metastasis. Cancer Cell 2011; 20(1): 104 – 118. doi: 10.1016/ j.ccr.2011.05.027.
62. Wang Z, Chinoy ZS, Ambre SG et al. A general strategy for the chemoenzymatic synthesis of asymmetrically branched N ‑ glycans. Science 2013; 341(6144): 379 – 383. doi: 10.1126/ science.1236231.
63. Alley WR Jr, Mann BF, Hruska V et al. Isolation and purification of glycoconjugates from complex biological sources by recycling high‑performance liquid chromatography. Anal Chem 2013; 85(2): 10408 – 10416. doi: 10.1021/ ac4023814.
Labels
Paediatric clinical oncology Surgery Clinical oncologyArticle was published in
Clinical Oncology

2014 Issue Supplementum
- Possibilities of Using Metamizole in the Treatment of Acute Primary Headaches
- Metamizole vs. Tramadol in Postoperative Analgesia
- Metamizole at a Glance and in Practice – Effective Non-Opioid Analgesic for All Ages
- Spasmolytic Effect of Metamizole
- Metamizole in perioperative treatment in children under 14 years – results of a questionnaire survey from practice
-
All articles in this issue
- Programovaná buněčná smrt v nádorových buňkách
- Využití průtokové cytometrie pro analýzu mitochondriální buněčné smrti
- Metody studia buněčné migrace a invazivity nádorových buněk
- Možnosti studia transendoteliální migrace in vitro
- Mechanizmy lékové rezistence a nádorové kmenové buňky
- Funkční testy pro detekci nádorových kmenových buněk
- Mikroprostředí nádoru – možnosti výzkumu v podmínkách in vitro
- Elektrochemická analýza nukleových kyselin, bílkovin a polysacharidů v biomedicíně
- Sekvenování nové generace a možnosti jeho využití v onkologické praxi
- Vývoj metod založených na PCR a jejich aplikace v onkologickém výzkumu a praxi
- Metody pro studium protein‑proteinových a protein‑ligandových interakcí
- Analýza proteinů pomocí hmotnostní spektrometrie
- p‑ SRM, SWATH a HRM – cílené proteomické přístupy na hmotnostním spektrometru TripleTOF 5600+ a jejich aplikace v onkologickém výzkumu
- Analýza fosfoproteínov a signálnych dráh kvantitatívno‑ proteomickými metódami
- Nové trendy ve studiu glykosylace proteinů u onkologických onemocnění
- Současné trendy ve využívání PET radiofarmak k onkologické diagnostice
- „Techneciová krize“ – příčiny, možná řešení a dopad na diagnostiku planární scintigrafií a SPECT
- Vitamin D jako významný steroidní hormon u karcinomu prsu
- Detekce protein‑proteinových interakcí metodami FRET a BRET
- Detekce proteinů, proteinových interakcí a modifikací s využitím „proximity ligation assay“ in situ
- Exprese a purifikace proteinů
- Kvantitativní hmotnostní spektrometrie a její využití v onkologii
- Clinical Oncology
- Journal archive
- Current issue
- About the journal
Most read in this issue
- Exprese a purifikace proteinů
- Metody studia buněčné migrace a invazivity nádorových buněk
- Sekvenování nové generace a možnosti jeho využití v onkologické praxi
- Analýza proteinů pomocí hmotnostní spektrometrie
